Úvod
Kruppelův faktor 4 (KLF4) je členem rodiny transkripčního faktoru zinku, který je exprimován v různých lidských tkáních. Je dobře známý jako jeden ze čtyř faktorů indukce pluripotentních kmenových buněk (IPSC) (Ghaleb a Yang, 2017). KLF4 může regulovat několik důležitých biologických procesů, jako je neuroinflamace, oxidační stres, proliferace, diferenciace a apoptóza (Kaushik et al., 2010; Mamonkin a kol., 2013; Zhang et al., 2015; Miao a kol., 2017; Xu et al., 2017). Množství předchozích studií se zaměřilo na roli KLF4 ve vývoji a progresi rakoviny (Karam et al ., 2017; Yadav et al., 2018). KLF4 je duálně funkční transkripční faktor, který může vykonávat svou roli onkogenu nebo genu potlačujícího nádor v závislosti na typu rakoviny nebo stadiu rakoviny (Evans a Liu, 2008). Může aktivovat nebo inhibovat transkripci genů zapojených do buněčné proliferace, diferenciace a apoptózy (Ding et al ., 2015). KLF4 může spolupracovat s dalšími přeprogramovacími faktory, aby přeměnil somatické buňky na IPSC a inhiboval diferenciaci kmenových buněk (Takahashi a Yamanaka, 2006; van Schaijik et al. , 2018). To poskytuje terapeutické vyhlídky na cévní onemocnění, imunitní onemocnění,anorexii a další nemoci (Imbernon et al., 2014; Liu y. a kol., 2015; Murgai a kol., 2017). Kromě toho může KLF4 hrát široce regulační roli v centrálním nervovém systému (CNS). Několik studií naznačuje, že KLF4 je spojen s mnoha neurologickými poruchami, včetně Alzheimerovy choroby (AD), epilepsie, Parkinsonovy choroby, hydrocefalu a schizofrenie (Qin et al ., 2011; Xie a kol., 2013; Han et al., 2015; Nishiguchi a kol., 2015; Li l. a kol., 2017).
AD je jedním z nejčastějších chronických neurodegenerativních onemocnění, které vede k kognitivním a paměťovým poruchám, různým mentálním příznakům a abnormalitám chování a progresivní demence je nejčastějším klinickým rysem (Jiang et al ., 2018). Současné potvrzené patogenní faktory AD zahrnují tvorbu senilních plaků vyvolaných abnormální depozicí amyloid-β (Aß)a neurofibrilárními spleti nebo dystrofickou neuritidou vyvolanou akumulací tau (Querfurth a LaFerla, 2010; Shinohara et al ., 2014). Kromě toho může být AD ovlivněna také genetickými faktory. Vyvolávající patogeneze je však stále nejasná. Mezi nejčastější léky pro léčbu AD patří látky zvyšující neurotransmiter, antiamyloidní činidla, neuroprotektivní peptidy a další léky (Cacabelos, 2018). Zejména několik studií ukázalo, že KLF4 hrál významnou roli v patogenezi AD. V tomto přehledu se zaměřujeme na regulační roli KLF4 v neuroinflamaci, neuronální apoptóze, axonální regeneraci a akumulaci železa, abychom vysvětlili souvislost mezi KLF4 a patogenezí AD, což by mohlo poskytnout vhled do buněčných a molekulárních mechanismů neurodegenerativních poruch.
biologické vlastnosti KLF4
KLF4 je jaderný protein obsahující Zinkový prst, izolovaný z knihovny NIH 3T3 a umístěný v buněčném jádru. To bylo nejprve identifikováno a charakterizováno Shields et al. (1996). Molekulová hmotnost lidského KLF4 je 55kD a je umístěna na chromozomu 9q31. KLF4 pokrývá genový segment 6,3 kb a má pět exonů. Jeho cDNA kódující oblast kóduje polypeptid sestávající ze 470 aminokyselinových zbytků (přesto et al., 1998; Ghaleb a Yang, 2017). Karboxyový konec KLF4 má oblast vazebné struktury DNA obsahující tři struktury zinkových prstů typu Cys2His2 (C2H2), které jsou tvořeny 81 vysoce konzervovanými aminokyselinami. Reguluje transkripci vysokou afinitou s prvky CACCC a sekvencemi DNA cílových genů bohatých na GC (Shields and Yang, 1998; Pearson et al., 2008). Většina míst vázajících DNA KLF4 je umístěna v oblasti zinkových prstů, včetně N-terminální transkripční aktivační domény pro interagující proteiny, struktury C-terminálního zinkového prstu pro vazbu DNA a inhibiční zónu transkripce (Bieker, 2001). KLF4 se podílí na regulaci exprese mnoha endogenních genů(Shields a Yang, 1998). Na amino konci KLF4 je vysoce variabilní transkripční regulační doména. Aminokyselinové zbytky umístěné mezi 91 a 117 amino tvoří transkripční aktivační doménu, která je bohatá na prolin a serin, zatímco transkripční represivní doména také existuje. Proto má KLF4 dva nepříznivé účinky: aktivaci a inhibici transkripce genů (přesto et al., 1998; Wei et al., 2006).
během embryonálního vývoje byl KLF4 vyšší v pozdním stádiu embryonálního vývoje. Zatímco ve zralých tkáních a orgánech je KLF4 exprimován hlavně v gastrointestinálním traktu, ústní dutině,kožní epidermis, vaskulárním endotelu a ledvinách a je méně exprimován v mozku (Segre et al ., 1999; Ghaleb a kol., 2011; Liu a kol., 2013; Chen a kol., 2015; on et al., 2015; Bin a kol., 2016). Předpokládá se, že hraje významnou roli při regulaci buněčné proliferace a diferenciace. Kromě toho může KLF4 také regulovat buněčný cyklus. KLF4 může aktivovat P21 způsobem závislým na P53 (Zhang et al ., 2000). Kromě toho bylo zjištěno, že buňky KLF4 (–/–) vstoupily do fáze senescence dříve než buňky KLF4 ( + / + ), což lze vysvětlit méně expresí antioxidačního genu a vyšší úrovní reaktivních druhů kyslíku (ROS) v buňkách KLF4 ( – / – ). ROS může zvýšit expresi p53 a p21 a následně podporovat poškození DNA (Liu C. et al ., 2015). Bylo zjištěno, že PRMT5 může zvýšit expresi KLF4 v hladinách bílkovin. Bylo hlášeno, že PRMT5 zvyšuje transkripci p21 a snižuje expresi bax prostřednictvím inhibice UBIKVITYLACE KLF4 (Hu et al ., 2015). Četné studie navíc prokázaly, že KLF4 se podílí na regulaci apoptózy neuronů (Kong et al ., 2016; Cui et al., 2017; Song et al., 2018). Fyziologická regulační role KLF4, kterou jsme znali, je stále málo a je zapotřebí dalšího vyšetřování.
Role KLF4 v AD
je dobře známo, že AD je charakterizován hlavně poruchami paměti a kognitivních funkcí a výkonnou dysfunkcí (Goedert a Spillantini, 2006). Mnoho studií prokázalo, že neuronální apoptóza a synaptická dysfunkce jsou patologickým základem poklesu kognitivní funkce (Caccamo et al ., 2017; Guo a kol., 2017; Yoon a kol., 2018). Nahromaděné poškození depozice Aß, oxidačního stresu a akumulace železa může vést k neuronální dysfunkci a apoptóze pacientů s AD. Několik studií ukázalo, že regulační role KLF4 se v CNS jeví jako zásadní. Vzhledem k tomu, že bylo hlášeno, že KLF4 reguluje neuronální apoptózu, synaptickou regeneraci, oxidační stres a neuroinflamaci, vztah mezi KLF4 a patogenezí AD může být potenciálním novým cílem léčby AD.
Role KLF4 v Neuroinflamaci
množství klinických studií ukázalo, že Aß může agregovat a je hlavní složkou extracelulárních depozit mozkové tkáně pacientů s AD, což může narušit okolní synapse a neurony a vést k neuronální smrti. Abnormální sekrece nebo nadměrná produkce Aß vede k patologickým změnám AD, takže depozice Aß je základním článkem AD (Rajmohan a Reddy, 2017). Studie navíc ukázaly, že nadměrná depozice Aß může stimulovat gliové buňky k vylučování ROS a dalších ovlivňujících faktorů, což vede k oxidačnímu stresu. Bylo známo, že oxidační stres může stimulovat produkci Aß. Proto Aß a oxidační stres mohou vzájemně interagovat a ovlivňovat progresi AD (Cheignon et al ., 2018).
KLF4 byl hlášen jako potenciální modulátor a má velký účinek na zánět zprostředkováním makrofágů a endotelových buněk (Obrázek 1) (Yoshida et al., 2014; Kapoor et al., 2015; Yang a kol., 2018). V CNS mohou nadměrné a chronické zánětlivé reakce způsobit poškození neuronu a neurogliocytů. Nedávno bylo prokázáno, že exprese KLF4 pozitivně korelovala s Neuroinflamací indukovanou Aß42. V mikrogliálních buňkách BV2 může oligomerní Aß42 zvýšit expresi KLF4, která je zprostředkována aktivovaným P53 (Li l. et al., 2017). Za zánětlivých stavů,jako je akumulace Aß, může být uvolňování prozánětlivých cytokinů stimulováno při tvorbě AD (Griffin a Barger, 2010). Neurotoxicita účinnost a prozánětlivá účinnost rozpustných oligomerů Aß42 je relativně vyšší než depozit nerozpustných vláken (Selkoe, 1991; Weinberg et al., 2018). Ticho KLF4 je schopno obnovit neuroinflamaci zprostředkovanou Aß42 a nadměrná exprese KLF4 může zhoršit neuroinflamaci zprostředkovanou Aß42 (Li l.et al., 2017). Akumulace Aß indukuje aktivaci astrocytů a mikroglií (Rodríguez et al., 2016). Aktivované astrocyty mohou zvýšit neuroinflamaci uvolněním prozánětlivých faktorů, jako jsou IL-1, IL-6 a TNF-α (Rubio-Perez a Morillas-Ruiz, 2012; Doméné et al. , 2016). Začarovaný cyklus zánětlivých odpovědí nakonec vede k dysfunkci a neuronální apoptóze.
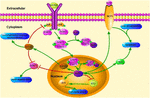
OBRÁZEK 1. Schematicilustration signálních drah souvisejících s KLF4. Tento údaj zdůrazňuje roli KLF4 v neuroprotekci a regeneraci axonů. Šipky na obrázku označují aktivaci nebo propagaci a přímky označují související inhibici. KLF4, Kruppelův faktor 4; STAT3, signální převodník a aktivátor transkripce 3; JAK, Janus kináza; SOCS3, supresor cytokinové signalizace 3; HCP1, hem nosičový protein 1; ERK5, mitogenem aktivovaná protein kináza 5.
KLF4 hraje klíčovou roli při regulaci prozánětlivých signálů. V gliových buňkách aktivace klf4 vyvolaná gemfibrozilem zvyšuje supresor cytokinového signálu 3 (SOCS3)cestou PI3-kinázy-AKT (Ghosh a Pahan, 2012). SiRNA zprostředkovaný knockdown KLF4 by mohl zmírnit hladinu SOC v astroglii a mikroglii myší,což by následně mohlo ovlivnit expresi zánětlivého genu (Kaushik et al ., 2010; Ghosh a Pahan, 2012). Kromě toho může delece SOCS podporovat přežití poškozených neuronů a podporovat regeneraci axonů (Smith et al ., 2009; Sun a kol., 2011). A KLF4 pozitivně reguluje produkci IL-1β nebo jiných prozánětlivých markerů. Pozitivně reguluje cyklooxygenázu-2 (Cox-2) a negativně reguluje indukovatelnou syntázu oxidu dusnatého (iNOS) (Kaushik et al., 2013). Kromě toho je KLF4 důležitým regulačním faktorem pro diferenciaci monocytů a potenciálním cílem imunitní regulace (Alder et al., 2008). Proto může KLF4 podporovat neuroinflamaci regulací těchto negativních regulátorů.
stojí za zmínku, že v modelu Parkinsonovy choroby může KLF4 podporovat oxidační stres a neurotoxicitu vyvolanou MPP+a poté zvýšit neuronální apoptózu a zpomalit proliferaci buněk (Chen et al ., 2013). Oxidační stres je nerovnováha mezi peroxidací a antioxidací. Volné radikály mohou způsobit změny v různých makromolekulách, což vede k poškození buněk, stárnutí buněk a poškození tkání (Parajuli et al ., 2013; Nie et al., 2015). Oxidační stres může zhoršit časný zánět a produkci Aß a poté zhoršit AD (Cai et al ., 2011). Proto může být KLF4 zapojen do oxidačního stresu v AD.
tyto nálezy naznačují, že KLF4 hraje klíčovou roli při zprostředkování neuroinflamace aktivací mikroglie a následným uvolňováním prozánětlivých cytokinů. Má potenciál zvýšit neuroinflamaci. Dosud se mnoho studií o patogenezi AD zaměřilo na neuroinflamaci. Jako potenciální cíl pro imunitní regulaci může KLF4 podporovat zánětlivé reakce mikroglie prostřednictvím ovlivnění souvisejících negativních regulátorů, což má velký vliv na vývoj AD.
Role KLF4 v apoptóze
neurodegenerativní změny zahrnují postupnou ztrátu neuronů a synapsí v reprezentativních oblastech mozku, jako je mozková kůra, hipokampus a další subkortikální oblasti. Funkční poruchy CNS vyvolané ztrátou neuronů jsou trvalé (Citron, 2010). Trvalý oxidační stres může vést k neuronální apoptóze (Wu et al ., 2010). Velké množství studií potvrdilo, že AD úzce souvisí s oxidačním stresem (Lee et al ., 2012; Yui a kol., 2015). Bylo zjištěno, že chronický oxidační stres může zvýšit expresi fosfolipázy A2 skupiny 3 (Pla2g3)v astrocytech a narušit rovnováhu Aß a následně vést k rozvoji AD (Yui et al ., 2015).
mnoho studií prokázalo, že KLF4 hraje důležitou roli při inhibici vývoje oxidačního stresu (Shi et al ., 2014; Liu C. a kol., 2015). Bylo zjištěno, že KLF4 může podporovat apoptózu buněk indukovanou H2O2, tato akce bude pravděpodobně způsobena zvýšenou expresí bax a sníženou expresí bcl-2 (Li et al., 2010). Quercetin může snížit expresi KLF4 v buňkách lidského neuroblastomu SH-SY5Y a zvýšit expresi poměru bcl-2 / bax. Kromě toho může Quercetin zmírnit rychlost apoptózy buněk SH-5YSY a snížit aktivitu enzymu kaspázy-3 (Xi et al., 2012). Nedávná studie zkoumala neuroprotektivní účinek mitogenem aktivované proteinové (MAP) kinázy 5 (ERK5) proti oxidačnímu stresu. Aktivace ERK5 může částečně snížit smrt hipokampálních neuronů indukovaných H2O2 a zvýšit neuroprotekci indukovanou NGF a PC (Su et al ., 2014). Nils et al. použil mutant mek5 (MEK5D)ke studiu transkripce aktivované ERK5 a funkčních odpovědí v lidských endotelových buňkách a identifikoval KLF4 byl nový navazující cíl ERK5 (Ohnesorge et al ., 2010). Bylo zjištěno, že nadměrná exprese KLF4 může potlačit zánětlivé reakce zprostředkované TNF a snížit adhezi leukocytů a apoptózu bazálních buněk. Tyto výsledky potvrzují, že KLF4 má protizánětlivé a antiapoptotické vlastnosti (Ohnesorge et al., 2010). Následné experimenty prokázaly, že zmizení mozkové kavernózní malformace 1 (CCM1)v endotelových buňkách aktivuje ERK5 prostřednictvím signální dráhy MEKK3-MEK5 a zvyšuje expresi KLF4 (Cuttano et al ., 2016). ERK5 hraje zprostředkovatelskou roli při stabilizaci (PC) a nervovém růstovém faktoru (NGF), který reguluje expresi KLF4 (Su et al., 2014). Kromě toho může RNAi zprostředkované klepání KLF4 také snížit neuroprotekci indukovanou NGF nebo PC. Nadměrná exprese KLF4 vede k vyššímu poměru bcl-2 / bax v buňkách stresovaných H2O2 (Su et al ., 2014). Nadměrně exprimovaný KLF4 urychluje změny v bcl-2 a bax kombinací s odpovídajícím promotorem (Li et al ., 2010). Kaskáda ERK5 / KLF4 může působit jako pivot v různých drahách, které chrání neurony před smrtí vyvolanou oxidačním stresem (Su et al., 2014).
oxidační stres byl považován za úzce související s mnoha degenerativními chorobami. KLF4 hraje významnou roli při udržování genomické stability v oxidačním stresu. KLF4 a ERK5 působí společně na ochranu neuronů před apoptózou vyvolanou oxidačním stresem. Proto může KLF4 působit jako terapeutický cíl, který působí proti oxidačnímu stresu, když je aktivován. Bylo hlášeno, že statinové léky mohou aktivovat ERK5, což vede k expresi KLF4 a jeho závislých genů (Ohnesorge et al ., 2010), ale mechanismus zůstává nejasný a klf4 související upstream a downstream cílové geny jsou méně studovány v oxidačním stresu, je třeba další studium.
Role KLF4 v regeneraci axonu
časná ztráta axonu je společným rysem neurodegenerativních onemocnění. Synaptická ztráta a porucha transportu u AD mohou způsobit kognitivní poruchy (Holtzman et al ., 2011; Coleman, 2013). Stupeň deklarativního poškození paměti souvisí se synaptickou hustotou v hipokampu a kůře. Rozpustné Aß oligomery snižují vychytávání glutamátu a podporují synaptickou dysfunkci, narušují synaptickou plasticitu (Li et al ., 2009). Proto je obzvláště důležité studovat, jak opravit axony v CNS. V retinálních gangliových buňkách mají axony silnou schopnost růst a regenerovat během raného vývoje, ale v CNS dospělých savců axony ztrácejí regenerační kapacitu a neurony mohou absolvovat smrt nebo atrofii (Goldberg a Barres, 2000; Goldberg a kol., 2002).
KLF4 hraje důležitou roli při inhibici růstu axonu. V embryonálních RGC může nadměrná exprese KLF4 snížit procento prodloužení neuritu, délku axonů a dendritů a větvení neuritu. Kromě toho bylo zjištěno, že nadměrná exprese KLF4 může snížit dlouhodobé postnatální tempo růstu axonu, ale nepodařilo se snížit krátkodobé tempo růstu axonu (Moore et al ., 2009; Steketee et al., 2014). Pozdější studie zjistily, že axonové svazky myší KLF4-cKO byly silnější než kontrolní myši (Fang et al ., 2016). Kromě toho odstranění exprese KLF4 během vývoje může zvýšit reprodukční potenciál dospělých RGC. Kromě toho KLF4 postrádající C-terminální dna vazebnou doménu neměl žádný vliv na růst axonu. Nebyl žádný vliv na přežití buněk poté, co byly zraněny gangliové buňky sítnice, pokud byl KLF4 vyřazen (Moore et al., 2009).
KLF4 může také ovlivnit regeneraci axonů. Nedávná studie uvádí, že snížení exprese KLF4 u dospělých buněk gangliových sítnic podporovalo regeneraci axonů cestou JAK-STAT3 (Qin et al ., 2013). KLF4 zvýšila fosforylaci STAT3 a regulovala růst axonu pomocí signalizace JAK-STAT (Qin a Zhang, 2012). Při léčbě cytokinů jsou členové rodiny proteinů STAT fosforylováni na karboxy-terminálních tyrosinových a serinových místech v buňce za vzniku stabilního dimeru. Tato modifikace zvyšuje transkripci genů spojených s buňkami (Yuan et al ., 2005). Interakce mezi KLF4 a STAT3 na fosforylaci tyrosin705 indukované cytokiny inhibuje expresi STAT3 inhibicí vazby STAT3 na DNA (Qin et al ., 2013). KLF4 knockdown zjevně zlepšuje regeneraci axonu v retinálních gangliových buňkách po poranění optického nervu a zabraňuje poškození nervu po mírném poranění mozku. Akce jsou zprostředkovány poklesem p-p53 a zvýšením hladin pSTAT3. KLF4 pozitivně reguluje neuronální apoptózu cestou p53 a JAK-STAT3 a KLF4 negativně reguluje axonální opravu cestou JAK-STAT3 (Cui et al ., 2017).
proto jsme předpokládali, že v AD lze regeneraci axonů dosáhnout změnou exprese KLF4 nebo změnou intracelulárních signálních drah a kontrolou progrese AD snížením chybějících axonů nebo snížením axonální dysfunkce. Nicméně, jak používat transkripční faktor KLF4 v potenciálních terapeutikách, stále potřebuje další průzkum.
Role KLF4 v akumulaci železa
železo je široce nalezené v biologických systémech, metaloproteinázy související se železem hrají klíčovou roli při transportu kyslíku, přenosu elektronů a katalyzování biochemických reakcí (Aisen et al ., 2001). Jakýkoli přebytek železa nad normální fyziologický rozsah však může poškodit lidské zdraví (Adlard a Bush, 2006). Studie zjistily, že obsah železa v hipokampu negativně koreluje s výkonem testů paměti (Ding et al., 2009). Zvýšené zatížení železem v mozku urychluje tvorbu Aß plaků a hyperfosforylovaných tau spleti a zároveň zvyšuje oxidační stres (Peters et al., 2015). Železo, které má vysoký stupeň propustnosti, podporuje růst nervů a spojení buněk s buňkami během vývoje mozku(Dallman a Spirito, 1977).
nedávná studie prokázala, že fyziologický stres způsobil aktivaci signální dráhy KLF4-HCP1 a zvýšené vychytávání hemu (Li H. et al ., 2017). Heme představuje 95% funkčního železa v lidském těle. Je to jedna z hlavních složek hemu oxygenázy (Hooda et al., 2014; Kurucz a kol., 2018). Zvýšení aktivity oxygenázy-1 může zpomalit oxidaci stárnoucího mozku (Verdile et al ., 2015; Serini a Calviello, 2016; Kurucz a kol., 2018). To má reliéfní účinek na AD. Fyziologický stres indukuje zvýšení hladiny glukokortikoidů, glukokortikoid zvyšuje expresi hemu nosného proteinu 1 (HCP1) prostřednictvím KLF4 a poté HCP1 podporuje vychytávání hemu (Li H.et al., 2017). Glukokortikoid a KLF4 společně regulují protizánětlivé geny a buňky s nízkým obsahem glukokortikoidů nemohou plně indukovat expresi KLF4 (Sevilla et al ., 2015). KLF4-indukované zvýšení příjmu hemu vede k akumulaci železa v mozku. Železo podporuje uvolňování ROS (Tronel et al ., 2013). Železný prvek zvyšuje oxidační stres mozku u potkanů pod psychickým stresem (Yu et al ., 2011). Proto může být HCP1 regulován KLF4 a glukokortikoidy společně. Zvýšení HCP1 zvyšuje absorpci hemu, což vede přímo k akumulaci železa v mozku, zhoršuje oxidaci, zvyšuje apoptózu nebo dysfunkci a zhoršuje poškození mozku.
obecně se uznává, že paměť a porucha učení jsou hlavními příznaky AD. Velké množství klinických údajů ukázalo, že aß plakové zatížení a reakce na akumulaci železa na vývoj učení a kognitivní dysfunkce u AD (van Bergen et al ., 2018). Nedávno zveřejněné údaje naznačují, že vysoká dávka železa zvyšuje depozici Aß a zmírňuje učení a paměť u myší (Guo et al ., 2013). Klinické studie ukázaly, že mikroglie obsahující železo se nachází v hipokampu pacientů s AD pod zobrazením magnetickou rezonancí (Zeineh et al., 2015). Microglia získává železo z přenosových nebo nepřenosných, extracelulárních a intracelulárních zdrojů (McCarthy et al ., 2018). Selektivní a trvalá exprese KLF4 může být indukována v jádru a cytoplazmě ischemických hipokampálních reaktivních astrocytů (Park et al ., 2014). Studie ukázaly, že KLF4 působí jako transkripční represor. To down-reguluje expresi ELK-3, a pak ELK-3 inhibuje expresi HO-1 (Tsoyi et al ., 2015). Hem oxygenáza-1 (HO-1) je stresový protein, který degraduje hem na bilirubin, volné železo a oxid uhelnatý. Up-REGULACE HO-1 v astrocytech může vést k abnormální depozici železa a mitochondriální dysfunkci v mozku, což vede ke snížené kognitivní schopnosti (Schipper, 1999, 2004). Proto může být KLF4 zapojen do procesu akumulace železa v astrocytech, což zhoršuje oxidaci v AD a zhoršuje poškození mozku.
závěr
KLF4 je obecně známo, že hraje klíčovou roli v regulaci buněčné proliferace, apoptózy a diferenciace. Předchozí studie se zaměřily na regulaci KLF4 v několika důležitých neurofyziologických procesech, včetně neuroinflamace, neuroprotekce a synaptické regenerace. Nedávno bylo zjištěno, že KLF4 hraje důležitou roli v patogenezi AD. V tomto článku přezkoumáváme roli KLF4 v neuroprotekci a neurogenezi v AD.
KLF4 je nejen regulátorem regulace buněčné proliferace a diferenciace, ale také potenciálním cílem pro regulaci imunitní odpovědi. KLF4 může regulovat negativní zánětlivé faktory a podporovat zánětlivou odpověď a mít velký vliv na expresi jaderné mikroglie astrocytů. Kromě toho mohou KLF4 a ERK5 působit společně a vyvíjet neuroprotektivní účinky. Kromě toho může být regenerace axonu provedena změnou obsahu specifických transkripčních faktorů, intracelulárních inhibitorů nebo změnou intracelulárních signálních drah. Vyřazení KLF4 může zvýšit regeneraci axonu a urychlit rychlost růstu axonu. Redukce exprese KLF4 podporuje regeneraci axonu cestou JAK-STAT3 a KLF4 podporuje cestu JAK-STAT3 k další regeneraci axonu. Proto může být KLF4 zapojen do procesu protizánětlivé, antiapoptózy, regenerace axonů a akumulace železa v CNS, což hraje klíčovou roli při tvorbě AD. Tato zjištění naznačují, že KLF4 představuje potenciální terapeutický cíl pro AD. Hluboké buněčné a molekulární mechanismy účinků KLF4 na AD však zůstávají nejasné a je třeba další vyšetřování.
autorské příspěvky
ZQC, XHZ a YJ napsal rukopis. SHG a JYL upravili rámec rukopisu. BJL a RJC poskytly kritické revize. Všichni autoři schválili konečnou verzi rukopisu k odeslání.
financování
tato práce byla podpořena granty z Přírodovědné nadace Číny (NSFC) (81871070, 31571126, 31471120) a financování Jilin Science and Technology Agency (Grant č. 20180519003JH, 20180414051GH, 20170414034GH a 20180414050GH).
Prohlášení o střetu zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být vykládány jako potenciální střet zájmů.
Cacabelos, R. (2018). Došlo za posledních 5 let ke zlepšení objevu léku na Alzheimerovu chorobu. Expo. Opine. Drug Discov. 13, 523–538. doi: 10.1080/17460441.2018.1457645
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Liu, y., Shi, J., and Chen, X. (2015). Identifikace nových cílů pro sezónní alergickou rýmu během pylové sezóny a mimo ni analýzou microarray. Acta Otolaryngol. 135, 1330–1336. doi: 10.3109 / 00016489.2015.1067906
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Serini, s., and Calviello, G. (2016). Snížení oxidačního / nitrosativního stresu v mozku a jeho zapojení do neuroprotektivního účinku n-3 PUFA u Alzheimerovy choroby. Curre. Alzheimer Res.13, 123-134. doi: 10.2174/1567205012666150921101147
PubMed Abstrakt / CrossRef Plný Text / Google Scholar