Úvod
adaptivní záření hmyzu v různých klimatických podmínkách bylo částečně usnadněno opakovaným vývojem diapause, předvídatelným vývojovým zastavením před nepříznivými podmínkami (např. zima, období sucha; Waterhouse a Norris, 1980; Tauber a kol., 1986; Danks, 1987; Hodkova a Hodek, 2004). Diapause je obvykle iniciována v reakci na token environmental cue (např., sezónní změny ve fotoperiodě), udržované po geneticky stanovené období a poté ukončené po návratu příznivých podmínek. Diapause tak umožňuje hmyzu sladit jejich růst a reprodukci s místními sezónními cykly (Tauber et al ., 1986; Danks, 1987). Diapause je klíčovým regulátorem historie života, geografického rozsahu a sezónního množství pro mnoho opylovačů hmyzu (např., 2013), zemědělští škůdci (např. Pullin et al., 1991; Li et al., 2012; Levine a kol. Denlinger a Armbruster, 2014; Gray et al., 2016). Diapause navíc vyvolává rozsáhlé fyziologické modifikace včetně akumulace zásob živin, potlačení metabolické aktivity, zvýšeného anaerobního katabolismu, zastavení buněčného cyklu, změn signalizace Wnt a upregulace různých mechanismů tolerance stresu (Denlinger, 2002; Hahn a Denlinger, 2007, 2011; King a MacRae, 2015; Ragland a Keep, 2017). Pochopení regulačních mechanismů, které jsou základem diapause, je dlouhodobým problémem v biologii organismů a usnadní vývoj nových přístupů k řízení klíčových druhů.
Ekdysteroidy a juvenilní hormony regulují širokou škálu fyziologických a vývojových procesů u hmyzu (Gruntenko a Rauschenbach, 2008; Jindra a kol., 2013; Palli, 2016), včetně diapause (Denlinger, 1985; Denlinger et al., 2012). Specifický hormonální signál regulující diapauzu má tendenci se lišit podle stadia, ve kterém dochází k zástavě vývoje (Denlinger et al ., 2012). Například zástava vývoje během larvální nebo pupální diapauzy je obvykle regulována změnami v hojnosti ekdysteroidů (např. Ohtaki a Takahashi, 1972; Bowen et al., 1984; Richard a kol., 1987). Naproti tomu zástava vývoje během diapause pro dospělé je často regulována změnami v hojnosti juvenilních hormonů (např., 1977; Saunders et al., 1990 a viz recenze v Denlinger et al., 2012).
v našem chápání hormonální regulace embryonální diapauzy existuje velká mezera, která je široce pozorována u Lepidoptera, Orthoptera, Hemiptera a Diptera. Předchozí výzkum rozsáhle dokumentoval endokrinní regulaci embryonální diapause u můry bource morušového (Bombyx mori) diapause hormonem (Hasegawa, 1963; Jamašita a Hasegawa, 1966; Jamašita, 1996). Zdá se však, že tato regulační role hormonu diapause je pro B. mori jedinečná, a proto poskytla malý vhled do hormonálního základu embryonální diapause u jiných druhů (Denlinger et al ., 2012). Kromě B. mori byla hormonální regulace embryonální diapause zavedena pouze u tří druhů. Cikánská můra (Lymantria dispar) prochází vývojovou zástavou iniciovanou a udržovanou vyšším množstvím ekdysteroidů (Lee et al ., 1997; Lee a Denlinger, 1997), zatímco nízká ekdysteroidní hojnost reguluje diapauzu ve dvou kobylkách (Chortoicetes terminifera, Locusta migratoria; Gregg et al., 1987; Tawfik a kol., 2002).
dosud žádná studie charakterizovala hojnost hormonů během embryonální diapauzy jakéhokoli druhu Dipteranu. Zde řešíme tuto mezeru zkoumáním hormonální regulace embryonální diapause u asijského tygřího komára, Aedes albopictus. Za posledních 30 let tento lékařsky důležitý vektor (Paupy et al., 2009) úspěšně napadl mírné oblasti po celém světě (Benedict et al., 2007) částečně kvůli embryonální diapauze, která usnadnila přežití během dálkové dopravy (Juliano a Lounibos, 2005; Diniz et al. , 2017) a rychle se vyvinul, aby sladil načasování zástavy vývoje s místními klimatickými podmínkami (Urbanski et al ., 2012). Mírné populace Ae. albopictus vstupuje do mateřské regulované fotoperiodické diapauzy. Pod krátkými podzimními denními délkami produkují samice vajíčka, která dokončují embryonální vývoj, ale zůstávají refrakterní vůči násadovým podnětům jako larvy pharate uvnitř chorionu vajíčka až do následujícího jara. Během posledního desetiletí, transkripční regulace embryonální diapause v Ae. albopictus byl značně charakterizován (Urbanski et al., 2010; Poelchau et al., 2011, 2013a, b; Huang X. a kol., 2015; Batz a kol., 2017), ale hormonální regulace této zásadní adaptace zůstává neznámá. Kvantifikovali jsme 20-hydroxyekdyson (20HE) a juvenilní hormon III (JH3) v diapausing a non-diapausing vejce ve třech časových bodech, které tvoří klíčové fáze embryonálního vývoje a interpretovaly naše výsledky v kontextu dříve shromážděných RNAseq (Poelchau et al., 2013a, b)a manipulativní data (Suman et al., 2015).
materiály a metody
sběr vajec
všechna měření použitá F11 vejce z laboratorní kolonie Ae. albopictus byl založen v srpnu 2015 z více než 200 larev shromážděných v Manassas, VA, Spojené státy americké. Před tímto experimentem byla populace udržována za dříve popsaných podmínek . Pro vytvoření vzorků vajec pro tento experiment byly larvy F10 udržovány v 5,5 L sterlitových nádobách o hustotě přibližně 250 larev na 2.5 L deionizované (DI) vody s 5 mL potravinářské kaše (Armbruster and Conn, 2006) pod LD fotoperiodou při 21°C a 80% RH. Každé pondělí-středa-pátek byly larvy filtrovány přes jemnou síťovinu a poté přeneseny do čisté nádoby na sterlit 5.5 L; kukly byly distribuovány do dospělých klecí udržovaných pod fotoperiodou LD odvrácenou diapause nebo diapause vyvolávající krátkou fotoperiodu (SD, 8: 16 L: D).
dospělým samicím byly poskytnuty týdenní krveprolití a ovipoziční pohár lemovaný neběleným papírovým ručníkem a napůl naplněný DI vodou, dokud ovipozice nepřestala. Vejce byla shromažďována denně, udržována na mokrém papírovém ručníku po dobu 48 hodin, poté sušena na vzduchu a skladována v nádobách za podmínek SD. V 5, 7 a 11 dnech po ovipozici (dpov) byla odebraná vejce zvážena na nejbližší 1 µg (průměr: 11.460 mg, rozmezí: 9.1-19.5 mg) na mikrobalanci MX5 (Mettler-Toledo, Columbia, OH, Spojené státy americké), umístěna do 1,5 mL zkumavek, zmrazena v kapalném dusíku mezi 11: 00 a 12: 00 (Zeitgeber čas 3-4 h) a skladována při -80°C. Byla zachována podmnožina vajec, aby se potvrdilo, že podmínky fotoperiod ld a SD stimulovaly produkci vajec bez diapause a diapause (viz Urbanski et al ., 2012).
odebrali jsme vzorky vajec v 5, 7 a 11 dpov ze dvou důvodů. Za Prvé, Ae. albopictus iniciuje diapause (sensu Koštál, 2006; Koštál et al., 2017) po dokončení embryonálního vývoje (Mori et al., 1981). Za podmínek používaných v našich experimentech, Ae. embrya albopictus procházejí segmentací přibližně u 5 dpov a embrya bez diapause jsou kompetentní k vylíhnutí přibližně u 7 dpov (Poelchau et al ., 2013a). Do 11 dpov je vývojová zástava pevně stanovena v embryích diapause (Poelchau et al ., 2013b). Proto jsme se rozhodli porovnat diapause a non-diapause embrya v časových bodech bracketing období vylíhnutí kompetence, včetně stanovení vývojové zástavy během diapause. Za druhé jsme vybrali časové body, které byly podobné těm, které byly použity pro předchozí experimenty rnaseq embryí (Poelchau et al., 2013a, b) aby tyto údaje mohly být využity k interpretaci našich současných výsledků. Tyto výsledky RNAseq byly dříve shledány dobře korelovanými s výsledky genové exprese získané pomocí qRT-PCR (Poelchau et al ., 2013a).
Ekdysteroidní kvantifikace
pro extrakci ekdysteroidů byly vzorky vajec umístěny do borosilikátové skleněné zkumavky s kónickým dnem s mikro tkáněmi (Wheaton, Millville, NJ, Spojené státy americké) s 1 µg farnesolu (Sigma-Aldrich, St.Louis, MO, Spojené státy americké) přidané jako vnitřní standard. Vejce byla ručně homogenizována třikrát teflonovou paličkou v 300 µL chlazené MeOH třídy HPLC a poté se točila při 12 000 RCF po dobu 10 minut v chlazené (4°C) odstředivce. Výsledný supernatant byl sloučen a poté eluován kolonami oxidu hlinitého dvakrát s chlazeným 90% MeOH a jednou s MeOH. Vzorky byly vysušeny v chlazené (4°C) vakuové odstředivce, resuspendovány v 20 µL MeOH a skladovány při -80°C až do analýzy. Pozitivní kontroly byly připraveny přidáním 1 µg každé z 20HE (Sigma-Aldrich) a farnesolu do prázdných zkumavek, které byly jinak zpracovány identicky. Analýza vzorků koncentrace ekdysteroidů byla provedena pomocí Mikromassu Quattro Micro LC-MS/MS (Waters Co., Milford, MA, Spojené státy americké). Vstřikovací objemy byly 5,0 µL, přičemž separace byly provedeny pomocí ACQUITY UPLC BEH C18 2,1 mm po 50 mm sloupcích se stacionární fází 1,7 µm (Waters Co.). Provozní podmínky pro LC běhy byly průtok mobilní fáze 0,37 mL min-1 s binární mobilní fází 0,1% kyseliny mravenčí v acetonitrilu a 0,1% kyseliny mravenčí ve vodě. Počáteční podmínky byly 1: 99 acetonitril: voda, následovaný izokratickým průtokem po dobu 0,3 min. Při 0,3 min lineární gradient od 1:99 až 99: 1 acetonitril: voda byla aplikována po dobu 4,2 min, následovala 1,0 min izokratický průtok při 99: 1 acetonitril: voda, po které se mobilní fáze vrátila na 1: 99 acetonitril: voda. Nastavení hmotnostního spektrometru bylo elektrosprejové pozitivní, s teplotou desolvace 350°C. 20HE a farnesol eluovány při 2,89 a 4,97 min, v uvedeném pořadí, a byly kvantifikovány pomocí vícenásobného sledování reakce charakteristických přechodů: 481,22 (m/z) > 445,24 (m/z), a 205,41 (m/z) > 121,09 (m/z), v uvedeném pořadí. Detekční limit testu je přibližně 5 pg.
kvantifikace juvenilních hormonů
každý vzorek vajec byl umístěn do borosilikátové skleněné 0,5 mL zkumavky na mikrotiskovou tkáň s kónickým dnem (Wheaton) s 1 µg farnesolu (Sigma-Aldrich) přidaného jako vnitřní standard. Vejce byla třikrát ručně homogenizována teflonovou paličkou v 500 µL chlazeného hexanu třídy HPLC, poté se točila při 12 000 RCF po dobu 10 minut v chlazené odstředivce (4°C). Hexanové frakce byly rekombinovány v čisté injekční lahvičce z borosilikátového skla a vysušeny vakuovou centrifugací. JH byl kvantifikován pomocí plynové chromatografie / hmotnostní spektrometrie, jak bylo popsáno výše (Brent a Vargo, 2003). Krátce byl zbytek vymyt z lahviček třemi výplachy hexanu a přidán do kolon borosilikátového skla naplněných oxidem hlinitým. Pro odfiltrování kontaminantů byly vzorky eluovány kolony postupně hexanem, 10% ethylether-hexanem a 30% ethylether-hexanem. Po vysušení byly vzorky odvozeny zahříváním při 60°C po dobu 20 minut v roztoku methyl-D alkoholu (Sigma-Aldrich) a kyseliny trifluoroctové(Sigma-Aldrich). Vzorky byly vysušeny, promíchány v hexanu a znovu eluovány kolony oxidu hlinitého. Nederivatizované složky byly odstraněny 30% ethyletherem. Derivát JH byl odebrán do nových injekčních lahviček přidáním 50% ethyl-acetát-hexanu. Po vysušení byly vzorky resuspendovány v hexanu a poté analyzovány pomocí HP 7890a Series GC (Agilent Technologies, Santa Clara, CA, Spojené státy americké) vybavené 30 m × 0,25 mm Zebron ZB-voskovou kolonou (Fenomenex, Torrance, CA, Spojené státy americké) spojenou s detektorem selektivní inertní hmoty HP 5975C. Helium bylo použito jako nosný plyn. Forma JH byla potvrzena prvními běžícími zkušebními vzorky v režimu skenování pro známé podpisy JH 0, JH I, JH II, JH3, a JH3 ethyl; JH3 byl potvrzen jako primární endogenní forma u tohoto druhu. Následující vzorky byly analyzovány pomocí režimu MS SIM, monitorování při m / z 76 a 225, aby byla zajištěna specificita pro derivát D3-methoxyhydrinu JH3. Celková hojnost byla kvantifikována proti standardní křivce derivatizovaného JH3 a upravena pro počáteční hmotnost vajec. Detekční limit testu je přibližně 1 pg.
statistické analýzy
analýzy byly provedeny v R (R Core Team, 2019). Hojnost JH3 byla log-transformována a analyzována pomocí ANOVA k testování účinků stavu diapause, stáří, a jejich interakce. 20h hojnost byla nelineární a fit pomocí dvou polynomiálních regresních modelů: úplný model včetně věku a vývojového stavu (diapause, non-diapause) a snížený model obsahující pouze věk. Modely byly porovnány pomocí ANOVA, aby se zjistilo, zda včetně vývojového stavu výrazně zlepšilo vysvětlující sílu.
Transkripční analýzy využily dříve shromážděná data RNAseq z diapause a non-diapause Ae. vejce albopictus (Doplňkový datový soubor 1; Poelchau et al., 2013a, b). Odlišně exprimované geny na 3, 6 a 11 dpov byly zkoumány analýzami obohacování genových sad (Mootha et al., 2003) s použitím klavírního balíčku (Väremo et al., 2013) nastaven na výchozí parametry následované korekcí FDR. Soubor referenčních genů byl anotován termíny biologického procesu go přiřazenými na VectorBase (Giraldo-Calderón et al., 2015). Geny JH3 a ekdysteroidní syntézy, stejně jako receptory JH3 a degradační geny byly ručně anotovány podle předchozí literatury (Bai et al ., 2007; Li a kol., 2011; nouzová a kol., 2011; Niwa a Niwa, 2014; Matthews a kol., 2016). Kromě toho jsme anotovali JH3 a ekdysteroidní induktivní geny na základě genových popisů poskytnutých ve VectorBase (Giraldo-Calderón et al., 2015). Kompletní přehled těchto genových sad je uveden v doplňkovém datovém souboru 1.
výsledky
Průměrná incidence diapauzy byla 95,9% (rozmezí: 90,5–100%) u SD fotoperiod a 5.4% (Rozsah: 1,8–9,5%) pod LD fotoperiodou (Doplňkový datový soubor 2); naše fotoperiodická léčba tedy vyvolala očekávané diapause odpovědi. 20h dosáhl vrcholu za podmínek diapause i non-diapause na 7 dpov, ale včetně stavu diapause jako faktoru v kvadratickém modelu pro 20h hojnost nezlepšila vysvětlující sílu modelu (obrázek 1A a doplňkový datový soubor 3; F3, 43 = 0.21, p = 0.890). Tyto výsledky naznačují, že stav diapause významně nevysvětluje změnu titru 20HE. Analýza dráhy RNAseq ukázala, že ani cesta syntézy 20HE, ani geny inducibilní 20HE nebyly významně změněny za podmínek diapause vs. non-diapause při 3, 6 nebo 11 dpov (Tabulka 1).

Tabulka 1. Výsledky analýzy obohacení genových sad, viz Doplňkový datový soubor 1 pro úplné shrnutí těchto genových sad.
bylo potvrzeno, že JH3 je primární formou juvenilního hormonu u tohoto druhu. Hojnost JH3 byla významně snížena u embryí diapause (obrázek 1B a doplňkový datový soubor 3; F1, 64 = 5,08, p = 0,028). Nicméně věk (F2, 64 = 0,66, p = 0,518) a interakce stavu diapause a věku (F2, 64 = 0,13, p = 0,883) neovlivnily hladiny JH3. Analýza dráhy dat RNAseq ukázala, že cesta syntézy JH3 byla významně potlačena u 3 dpov a geny inducibilní JH byly významně potlačeny u 6 dpov (Obrázek 2 a tabulka 1).
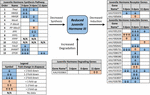
Obrázek 2. Shrnutí diferenciální exprese genů zapojených do syntézy JH3, degradace, a indukce Ae. albopictus (Poelchau et al., 2013a, b). Významné snížení vyvolané diapauzou (modrá) nebo zvýšení (oranžová) jsou indikovány stínovanými buňkami. Diferenciální velikost je označena šipkami, jak je popsáno v legendě vlevo dole. ∗Geny bez běžných názvů jsou identifikovány identifikačním číslem VectorBase.
diskuse
Diapause je rozšířená adaptace, která umožňuje hmyzu sladit jejich růst a reprodukci se sezónně příznivými podmínkami (Tauber et al., 1986; Danks, 1987). Pochopení hormonálních změn, kterými hmyz koordinuje vnímání vnějších podnětů vyvolávajících diapauzu s fyziologickými mechanismy, které vedou k zástavě vývoje, je dlouhodobým cílem v biologii (Lees, 1956; Denlinger, 2002). Desetiletí výzkumu vedly k identifikaci běžných hormonálních strategií pro diapause v larválních, pupálních a dospělých stádiích; hormonální regulace embryonální diapause však zůstává do značné míry neznámá, zejména u Diptera (Denlinger, 1985, 2002; Denlinger et al ., 2012). V této studii je naše přímé měření snížené hojnosti JH3 v diapauze potvrzeno předchozím profilováním genové exprese (Poelchau et al., 2013a, b) a manipulativní experimenty (Suman et al., 2015) podporující hypotézu, že JH3 reguluje embryonální diapauzu u tohoto druhu.
Ekdysteroidy
v této studii jsme přímo měřili hojnost ekdysteroidů ve třech časových bodech za podmínek diapause a non-diapause u embryí komára AE. albopictus. V souladu s předchozími výsledky Toxorhynchites amboinensis (Russo a Westbrook, 1986) dosáhly 20HLADINY vrcholu blízko závěru embryonálního vývoje (7 dpov; obrázek 1A). Nicméně, 20 titr se významně nelišil mezi diapause a non-diapause vejce. Kromě toho ani cesta syntézy 20HE ani geny indukované 20HE neprodělaly žádné významné koordinované změny v genové expresi (Tabulka 1). Došli jsme k závěru, že na rozdíl od dříve vyšetřených embryonálních diapauz u Lepidoptera a Orthoptera (Hasegawa, 1963; Yamashita a Hasegawa, 1966; Gregg et al., 1987; Yamashita, 1996; Lee a Denlinger, 1997; Lee a kol., 1997; Tawfik a kol., 2002), 20NEREGULUJE zahájení diapauzy v Ae. albopictus.
juvenilní hormon
naproti tomu jsme pozorovali přibližně dvojnásobně nižší hojnost JH3 u embryí diapause (obrázek 1B). Zatímco menší než rozdíly v hojnosti JH3 zjištěné za diapause vs. non-diapause podmínky u hmyzu, který diapause v jiných životních fázích (např Yin a Chippendale, 1979; Walker a Denlinger, 1980; Readio et al. , 1999), Naše přímá měření jsou potvrzena transkripčními důkazy (Obrázek 2). Například cesta syntézy JH3 je významně potlačena během rané přípravy diapause (3 dpov). Na podporu naší interpretace těchto výsledků předchozí studie zjistily, že snížená exprese genů podél cesty syntézy JH3 je silně korelována s nižší hojností JH3 v obou Aedes aegypti (Nouzova et al ., 2011; Rivera-Perez et al., 2014) a Diploptera punctata (Huang J. et al., 2015). Geny indukované JH jsou také významně potlačeny během pozdní přípravy diapause (6 dpov; Tabulka 1), což naznačuje, že embrya určená k diapause mají omezenou schopnost reagovat na signalizaci JH3 v době, kdy se embrya bez diapause stanou kompetentními k vylíhnutí. Kromě toho je genová exprese pro enzym degradující JH3 (JH esteráza) významně upregulována v časné údržbě diapause (11 dpov; Obrázek 2), jakož i později v údržbě diapause (21 a 40 dpov; Poelchau et al. , 2013b), což naznačuje, že JH3 může zůstat v nízké hojnosti po celou dobu diapauzy u tohoto druhu.
snížená hojnost JH3 během vývojové zástavy je poněkud kontraintuitivní, protože nízký titr juvenilních hormonů je obvykle spojen s progresivními molty, zejména od larválního až pupálního stadia (Palli, 2016). Nicméně aplikace analogu JH3 (pyriproxyfen) na diapause Ae. albopictus vejce urychluje rychlost ukončení diapause v závislosti na dávce (Suman et al ., 2015). Při nejúčinnější dávce přibližně 80% vajec vystavených pyriproxyfenu ukončí diapause o 30 dpov ve srovnání s pouhým 1% diapause ukončením o 80 dpov pro kontrolní vejce (Suman et al ., 2015). Změny v hojnosti JH3 mohou také generovat embryonální fenotyp podobný diapauze u jiných druhů. Například v B. mori, experimentální redukce syntézy JH3 pomocí jhamt knockout má za následek plně vyvinuté larvy pharate, které nereagují na násadové podněty; tento fenotyp lze zachránit způsobem závislým na dávce aplikací buď extrahovaného JH3 nebo methoprenu, analogu JH3 (Nakao et al., 2015). Podobně experimentální suplementace jiného analogu juvenilních hormonů (RO-20-3600) k nově uloženým vajíčkům Drosophila melanogaster produkuje larvy pharate, které jsou ve vajíčku pohyblivé, ale nedokáží se vylíhnout (Smith a Arking, 1975). Společně tyto údaje naznačují, že hojnost juvenilních hormonů pravděpodobně přispívá k regulaci násadových reakcí u různého hmyzu. Embryonální diapause v larválním stádiu pharate je definována neschopností reagovat na násadové podněty, změny v hojnosti juvenilních hormonů mohou představovat běžnou hormonální strategii pro regulaci této formy diapause.
ve shodě s předchozími transkripčními a manipulativními údaji naše výsledky silně implikují sníženou hojnost JH3 jako pravděpodobný regulátor embryonální diapauzy v Ae. albopictus. Tento výzkum je první přímou kvantifikací množství hormonů během embryonální diapauzy u všech druhů Dipteranů a představuje důležitý krok k objasnění hormonální regulace této zásadní adaptace na nepříznivé prostředí. Charakterizace vazby mezi vnějšími podněty a vývojovou zástavou prostřednictvím hormonální signalizace zůstává hlavní výzvou (Denlinger, 1985; Denlinger et al., 2012). Objasnění těchto cest u různých druhů poskytne kritický pohled na základní a aplikované problémy, včetně pochopení molekulárního a fyziologického základu evoluce historie života, předpovídání reakcí druhů na změnu klimatu a identifikace nových cílů pro řízení druhů škůdců a vektorů (Denlinger, 2008).
Prohlášení o dostupnosti dat
všechny datové sady generované pro tuto studii jsou zahrnuty v článku / doplňkovém materiálu.
autorské příspěvky
ZB, CB a PA přispěly ke koncepci, návrhu studie a připravily Počáteční návrh rukopisu. ZB, MM a JS provedli chov zvířat a odebrali vzorky vajec. CB provedla analýzy LC-MS/MS a GC-MS. ZB provedla statistické analýzy. Všichni autoři přispěli k revizi rukopisu a schválili předloženou verzi.
financování
tato práce byla podpořena National Institutes of Health (1R15A / 111328-01) a Davis Family Endowment to PA.
střet zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být vykládány jako potenciální střet zájmů.
poděkování
Děkujeme Allan Knopf a Dan Langhorst za pomoc při měření titrů hormonů. Děkujeme také Davidu Denlingerovi za užitečné komentáře k dřívějším verzím rukopisu. Použití obchodních názvů nebo komerčních produktů v tomto článku je výhradně za účelem poskytování konkrétních informací a neznamená doporučení nebo schválení Ministerstvem zemědělství Spojených států. USDA je poskytovatelem rovných příležitostí a zaměstnavatelem.
Doplňkový Materiál
R Core Team (2019). R: jazyk a prostředí pro statistické výpočty. Vídeň: Tým R Core.
Google Scholar
Väremo, L., Nielsen, J., and Nookaew, i. (2013). Obohacení analýzy genových sad dat v celém genomu začleněním směrovosti genové exprese a kombinací statistických hypotéz a metod. Nukleové Kyseliny Rez.41, 4378-4391. doi: 10.1093/nar / gkt111
PubMed Abstrakt / CrossRef Plný Text / Google Scholar