dávková forma: aerosol, pěna
lékařsky hodnoceno Drugs.com. Naposledy aktualizováno září 1, 2019.
- přehled
- vedlejší účinky
- dávkování
- Profesionální
- těhotenství
- více
- indikace a použití pro Ketokonazolovou pěnu
- Ketokonazolová pěna dávkování a podání
- lékové formy a síly
- Kontraindikace
- upozornění a opatření
- kontaktní senzibilizace
- hořlavý obsah
- systémové účinky
- nežádoucí účinky
- zkušenosti z klinických studií
- studie dermální bezpečnosti
- postmarketingové zkušenosti
- použití u specifických populací
- těhotenství
- laktace
- ženy a muži s reprodukčním potenciálem
- pediatrické použití
- geriatrické použití
- Ketokonazolová pěna popis
- Ketokonazolová pěna-Klinická farmakologie
- mechanismus účinku
- farmakodynamika
- farmakokinetika
- mikrobiologie
- Neklinická Toxikologie
- karcinogeneze, mutageneze, poškození Fertility
- klinické studie
- jak je dodáván / skladování a manipulace
- informace o poradenství pro pacienty
- návod k použití
- informace pro pacienta
- balení / štítek hlavní zobrazovací PANEL-krabička
- více o ketokonazolu aktuální)
- Consumer resources
- Professional resources
- Related treatment guides
indikace a použití pro Ketokonazolovou pěnu
Ketokonazolová pěna, 2% je indikováno pro lokální léčbu seboroické dermatitidy u imunokompetentních pacientů.pacienti ve věku 12 let a starší.
omezení použití
bezpečnost a účinnost Ketokonazolové pěny, 2% pro léčbu plísňových infekcí nebyla stanovena.
Ketokonazolová pěna dávkování a podání
Ketokonazolová pěna, 2% by mělo být aplikováno na postiženou oblast(oblasti) dvakrát denně po dobu čtyř týdnů.
držte nádobu ve svislé poloze a do uzávěru plechovky nebo jiného chladného povrchu dávkujte 2% Ketokonazolovou pěnu v množství dostatečném k pokrytí postižené oblasti(oblastí). Dávkování přímo na ruce se nedoporučuje, protože pěna se začne tát okamžitě po kontaktu s teplou pokožkou. Zvedněte malé množství Ketokonazolové pěny, 2% špičkami prstů a jemně vmasírujte do postižené oblasti(oblastí), dokud pěna nezmizí. U oblastí nesoucích vlasy rozdělte vlasy tak, aby Ketokonazolová pěna mohla být 2% aplikována přímo na kůži (spíše než na vlasy).
Zabraňte kontaktu s očima a jinými sliznicemi. Ketokonazolová pěna, 2% není určena pro oční, orální nebo intravaginální použití.
lékové formy a síly
Ketokonazolová pěna, 2% obsahuje 20 mg ketokonazolu, USP na gram, dodávané v 50 g a 100 g nádobách.
Kontraindikace
Žádné.
upozornění a opatření
kontaktní senzibilizace
Ketokonazolová pěna, 2% může vést k senzibilizaci kontaktů, včetně fotoalergenity.
hořlavý obsah
obsah Ketokonazolové pěny, 2% obsahuje alkohol a propan/butan, které jsou hořlavé. Během aplikace a bezprostředně po ní se vyhněte požáru, plameni a/nebo kouření. Nádoby nepropichujte a / nebo nespalujte. Nevystavujte nádoby teplu a / nebo skladujte při teplotách nad 120°F (49°C).
systémové účinky
hepatitida byla pozorována u perorálně podávaného ketokonazolu (incidence hlášená v poměru 1:10 000). Při vysokých dávkách perorálně podávaného ketokonazolu byly pozorovány snížené hladiny testosteronu a kortikosteroidů indukovaných ACTH. Tyto účinky nebyly pozorovány u topického ketokonazolu.
nežádoucí účinky
zkušenosti z klinických studií
vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze četnost nežádoucích účinků pozorovaných v klinických studiích s léčivem přímo porovnat s četností v klinických studiích s jiným léčivem a nemusí odrážet četnost pozorovanou v praxi. Informace o nežádoucích účincích z klinických studií však poskytují základ pro identifikaci nežádoucích účinků, které se zdají souviset s užíváním drog, a pro přibližnou míru.
údaje o bezpečnosti uvedené v tabulce 1 odrážejí expozici Ketokonazolové pěně, 2% u 672 subjektů ve věku 12 let a starších se seboroickou dermatitidou. Subjekty aplikovaly Ketokonazolovou pěnu, 2% nebo pěnu vehikula dvakrát denně po dobu 4 týdnů na postižené oblasti obličeje, pokožky hlavy a/nebo hrudníku. Nežádoucí účinky vyskytující se u > 1% subjektů jsou uvedeny v tabulce 1.
Tabulka 1: Nežádoucí účinky hlášené >1% subjektů v klinických studiích
|
nežádoucí účinky |
Ketokonazolová pěna, 2% N=672 n (%) |
Vehicle Foam N=497 n (%) |
|
subjekty s nežádoucím účinkem |
188 (28%) |
122 (25%) |
|
vypalování místa aplikace |
67 (10%) |
49 (10%) |
|
reakce v místě aplikace |
41 (6%) |
24 (5%) |
reakce v místě aplikace, které byly hlášeny u <1% subjektů, byly suchost, erytém, podráždění, parestézie, svědění, vyrážka a teplo.
studie dermální bezpečnosti
ve studii fotoalergenity mělo 9 z 53 subjektů (17%) reakce během období výzvy na ozářených i neozářených místech léčených Ketokonazolovou pěnou, 2%. Ketokonazolová pěna, 2% může způsobit senzibilizaci kontaktů.
postmarketingové zkušenosti
během postmarketingového užívání Ketokonazolové pěny byly zjištěny následující nežádoucí účinky, 2%:
gastrointestinální poruchy: cheilitida
Celkové poruchy a reakce v místě aplikace: bolest v místě aplikace a popálení v místě aplikace
poruchy kůže a podkožní tkáně: Pocit pálení kůže a erytém
vzhledem k tomu, že tyto příhody jsou hlášeny dobrovolně z populace s nejistou velikostí, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
použití u specifických populací
těhotenství
souhrn rizik
nejsou k dispozici žádné údaje o Ketokonazolové pěně, 2% použití u těhotných žen k identifikaci rizika závažných vrozených vad, potratu nebo nepříznivých výsledků u matky nebo plodu. S Ketokonazolovou pěnou, 2%, nebyly provedeny žádné reprodukční studie na zvířatech. Ve studiích reprodukce na zvířatech u březích myší, potkanů a králíků byly po perorálním podání ketokonazolu během organogeneze pozorovány jak embryotoxické, tak vývojové účinky (strukturální abnormality). Za předpokladu ekvivalentní systémové absorpce topických a perorálních dávek ketokonazolu a Ketokonazolové pěny, 2% maximální doporučené dávky pro člověka (MRHD) 8 gramů (ekvivalentní 160 mg ketokonazolu), byly embryotoxické účinky pozorovány při 0, 8 až 2, 4násobku MRHD a vývojové účinky byly pozorovány při 4.8 krát MRHD .
základní riziko závažných vrozených vad a potratu u indikované populace není známo. Všechna těhotenství mají riziko vrozené vady, ztráta, nebo jiné nepříznivé výsledky. V běžné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznávaných těhotenství 2 až 4% a 15 až 20%.
údaje
údaje na zvířatech
zvířecí násobky výpočtů expozice u člověka jsou založeny na srovnání plochy povrchu těla (BSA) perorálních dávek podávaných zvířatům a Ketokonazolové pěny, 2% maximální doporučená dávka pro člověka (MRHD) 8 gramů (což odpovídá 2, 67 mg ketokonazolu/kg / den pro jednotlivce o hmotnosti 60 kg nebo 98, 8 mg ketokonazolu / m2 / den).
byly provedeny studie Embryofetálního vývoje u myší, potkanů a králíků s perorálně podávaným ketokonazolem. Při perorálním podání myším v gestačních dnech 6 až 18 (pokrývající období organogeneze) byl ketokonazol embryotoxický (25 mg/kg a vyšší; 0,8 násobek MRHD na základě srovnání BSA) s vysokým výskytem resorpcí, zvýšeným počtem mrtvě narozených dětí a zpožděným porodem. Bylo také pozorováno zpoždění zrání. Při dávkách až 50 mg/kg (1,5 násobek MRHD na základě srovnání BSA) nebyly zjištěny žádné známky toxicity nebo malformací u matek. Při dávce 10 mg/kg (0,3 násobek MRHD na základě srovnání BSA) nebyly pozorovány žádné vývojové účinky související s léčbou.
v přítomnosti mateřské toxicity u potkanů byl perorálně podávaný ketokonazol embryotoxický (40 mg / kg a vyšší; 2,4 násobek MRHD na základě srovnání BSA), včetně zvýšených resorbovaných plodů a mrtvě narozených dětí, a teratogenní (80 mg/kg a vyšší; 4,8 násobek MRHD na základě srovnání BSA), včetně syndaktylie, oligodaktylie, zvlněných žeber a rozštěpu patra. Navíc 100 mg/kg (6násobek MRHD na základě srovnání BSA) ketokonazol perorálně podávaný jeden den během těhotenství (gestační dny 9 až 12) byl embryotoxický (zvýšená resorpce). Stejná perorální dávka podaná 12., 13., 14. nebo 15. den těhotenství vyvolala vnější malformace včetně rozštěpu patra, mikromelie a digitálních anomálií (brachydaktyly, ektrodaktyly, syndaktyly).
u březích králíků, kterým byl perorálně podáván ketokonazol, byly pozorovány známky embryotoxicity (zvýšené resorpce) při dávce 10 mg / kg (1,2 násobek MRHD na základě srovnání BSA) a vyšší a zvýšený výskyt kostních abnormalit byl pozorován při dávce 40 mg / kg(4,8 násobek MRHD na základě srovnání BSA).
laktace
souhrn rizik
nejsou k dispozici žádné informace o přítomnosti ketokonazolu v lidském mléce nebo o účincích na kojené dítě nebo o účincích na produkci mléka po topické aplikaci Ketokonazolové pěny, 2% u kojících žen. Ve studiích na zvířatech byl ketokonazol nalezen v mléce po perorálním podání. Vývojový a zdravotní přínos kojení by měl být zvážen spolu s klinickou potřebou Ketokonazolové pěny matky, 2% a případnými nežádoucími účinky na kojené dítě z Ketokonazolové pěny, 2% nebo ze základního stavu matky.
ženy a muži s reprodukčním potenciálem
neplodnost
ve studiích fertility na zvířatech u potkanů a psů vedlo podávání perorálních dávek ketokonazolu mezi 3denním a 3měsíčním obdobím k reverzibilní neplodnosti .
pediatrické použití
bezpečnost a účinnost Ketokonazolové pěny, 2% u dětských pacientů mladších 12 let nebyla stanovena.
z 672 subjektů léčených Ketokonazolovou pěnou bylo 2% v klinických studiích 44 (7%) ve věku od 12 do 17 let. .
geriatrické použití
ze 672 subjektů léčených Ketokonazolovou pěnou bylo 2% v klinických studiích, 107 (16%) bylo 65 let a více.
klinické studie s Ketokonazolovou pěnou nezahrnovaly 2% subjektů ve věku 65 a více let dostatečný počet subjektů, aby bylo možné určit, zda reagují odlišně než mladší subjekty.
Ketokonazolová pěna popis
Ketokonazolová pěna, 2% obsahuje 2% ketokonazolu USP, antimykotika, v termolabilní hydroethanolové pěně pro topickou aplikaci.
Chemický název pro ketokonazol je piperazin, 1-acetyl-4-methoxy] fenyl] -, cis – s molekulárním vzorcem C26H28CI2N4O4 a molekulovou hmotností 531,43.
následující je chemická struktura:
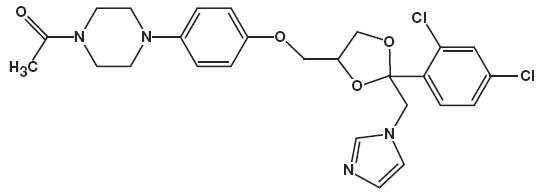
Ketokonazolová pěna, 2% obsahuje 20 mg ketokonazolu na gram v termolabilním hydroethanolovém pěnovém vehikulu sestávajícím z cetylalkoholu, kyseliny citronové, ethanolu (denaturovaného terc-butylalkoholem a brucinsulfátem) 58%, polysorbátu 60, citrátu draselného, propylenglykolu, čištěné vody a stearylalkoholu natlakovaného uhlovodíkovou (propan/butanovou) hnací látkou.
Ketokonazolová pěna-Klinická farmakologie
mechanismus účinku
mechanismus účinku ketokonazolu při léčbě seboroické dermatitidy není znám.
farmakodynamika
farmakodynamika Ketokonazolové pěny, 2% nebyla stanovena.
farmakokinetika
ve studii biologické dostupnosti aplikovalo 12 subjektů se středně těžkou až těžkou seboroickou dermatitidou 3 g Ketokonazolové pěny, 2% dvakrát denně po dobu 4 týdnů. Cirkulující plazmatické hladiny ketokonazolu byly < 6 ng/mL u většiny subjektů (75%), přičemž maximální hladina 11 ng/mL byla pozorována u jednoho subjektu.
mikrobiologie
ketokonazol je antimykotikum, které inhibuje in vitro syntézu ergosterolu, klíčového sterolu v buněčné membráně Malassezia furfur. Klinický význam antifungální aktivity při léčbě seboroické dermatitidy není znám.
Neklinická Toxikologie
karcinogeneze, mutageneze, poškození Fertility
dlouhodobé studie na zvířatech nebyly provedeny za účelem vyhodnocení kancerogenního nebo fotokarcinogenního potenciálu Ketokonazolové pěny, 2%.
ve studiích perorální kancerogenity u myší (18 měsíců) a potkanů (24 měsíců) při dávkách 5, 20 a 80 mg/kg/den nebyl ketokonazol kancerogenní. Vysoká dávka v těchto studiích byla přibližně 2, 4 až 4, 8krát vyšší než MRHD na základě srovnání BSA. V testu reverzní mutace bakterií ketokonazol nevykazoval žádný mutagenní potenciál. Ve třech testech in vivo (sesterská výměna chromatidů u lidí, dominantní letální a mikronukleární testy u myší) nevykazoval ketokonazol Žádný genotoxický potenciál.
ve studiích fertility na zvířatech narušil perorální ketokonazol samčí i samičí fertilitu u potkanů v závislosti na dávce a délce trvání. U žen neměly perorální dávky do 40 mg/kg (2,4 násobek MRHD na základě srovnání BSA) žádný vliv na fertilitu, zatímco dávky 75 mg/kg (4,5 násobek MRHD na základě srovnání BSA) a vyšší snížily míru těhotenství a počet míst implantace. U samců potkanů vedlo perorální dávkování 200 mg / kg / den (12násobek MRHD na základě srovnání BSA) po dobu tří dnů ke snížení fertility a 400 mg / kg / den (24násobek MRHD na základě srovnání BSA) po dobu tří dnů k úplné ztrátě fertility. Při podávání po delší dobu (až 3 měsíce) byla pozorována snížená Fertilita u samců potkanů při dávkách až 24 mg / kg / den(1,4 násobek MRHD na základě srovnání BSA). U psů beagle se podává perorální dávka 25 mg/kg/den ketokonazolu po dobu až 4 týdnů (5 .2 krát MRHD na základě srovnání BSA) vedlo ke snížení motility spermií, sníženému počtu spermií, zvýšenému abnormálnímu spermatu a atrofii varlat. Tyto účinky byly po vysazení léčby zvráceny.
klinické studie
bezpečnost a účinnost Ketokonazolové pěny byla 2% hodnocena v randomizované, dvojitě zaslepené, vehikulem kontrolované studii u subjektů ve věku 12 let a starších s mírnou až těžkou seboroickou dermatitidou. Ve studii dostalo 427 subjektů Ketokonazolovou pěnu, 2% a 420 subjektů dostalo pěnu vehikula. Subjekty aplikovaly Ketokonazolovou pěnu, 2% nebo pěnu vehikula dvakrát denně po dobu 4 týdnů na postižené oblasti obličeje, pokožky hlavy a/nebo hrudníku. Celková závažnost onemocnění z hlediska erytému,škálování a indurace byla hodnocena na začátku a ve 4. týdnu na 5bodové stupnici Static Global Assessment (Isga) zkoušejícího.
úspěšnost léčby byla definována jako dosažení skóre ISGA ve 4. týdnu (konec léčby) 0 (clear) nebo 1 (většina lézí má individuální skóre pro škálování, erytém a induraci, které je v průměru 1) a nejméně dva stupně zlepšení oproti výchozí hodnotě. Výsledky jsou uvedeny v tabulce 2. Databáze nebyla dostatečně velká, aby posoudila, zda existují rozdíly v účincích ve věku, pohlaví nebo rasových podskupinách.
Tabulka 2: Výsledky účinnosti
|
počet subjektů |
Ketokonazolová pěna, 2% N = 427 n (%) |
Vehicle Foam N = 420 n (%) |
|
subjekty dosahující úspěchu léčby |
239 (56%) |
176 (42%) |
jak je dodáván / skladování a manipulace
Ketokonazolová pěna, 2% obsahuje 20 mg ketokonazolu, USP na gram. Termolabilní hydroethanolová pěna je k dispozici následovně:
NDC 45802-532-32
50 g hliníkové plechovky
NDC 45802-532-33
100 g hliníkové plechovky
Skladujte při 20° až 25°C (68° až 77°F). .
uchovávejte v chladničce.
obsah je hořlavý. Nevystavujte nádoby teplu a / nebo skladujte při teplotách nad 49°C (120°F). Neuchovávejte na přímém slunečním světle.
obsah pod tlakem. Nepropichujte a / nebo nespalujte nádobu.
Uchovávejte mimo dosah dětí.
informace o poradenství pro pacienty
viz Označení pacienta schválené FDA (příbalová informace pro pacienty).
Poučte pacienty o správném použití Ketokonazolové pěny, 2%.
* během aplikace a bezprostředně po ní se vyhněte požáru, plameni a/nebo kouření. * Nepoužívejte Ketokonazolovou pěnu, 2% přímo na ruce. Dávkujte na chladný povrch a aplikujte na postižené oblasti pomocí prstů. • Umyjte si ruce po aplikaci * Ketokonazolová pěna, 2% může způsobit podráždění kůže (pálení v místě aplikace a / nebo reakce) • Poučte pacienta, aby kontaktoval poskytovatele zdravotní péče, pokud oblast aplikace vykazuje známky zvýšeného podráždění a hlásí jakékoli známky nežádoucích účinků.
Vyrobeno v Izraeli
vyrobeno společností Perrigo
Yeruham, Izrael
distribuováno společností
Perrigo®
Allegan, MI 49010
www.perrigo.com
Rev 08-18
5K200RCJ3
Ketokonazolová pěna, 2%
důležité informace: Ketokonazolová pěna, 2% je určena pouze na kůži. Nepoužívejte Ketokonazolovou pěnu, 2% do očí, úst nebo pochvy.
Krok 1: Odstraňte čirý uzávěr z Ketokonazolové pěny, 2% plechovka.
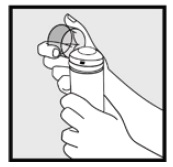
Krok 2: držte plechovku ve svislé poloze a pevně stiskněte trysku, abyste dávkovali Ketokonazolovou pěnu, 2% do čirého víčka. * Dávkujte dostatek Ketokonazolové pěny, 2% na pokrytí celé postižené oblasti(oblastí).
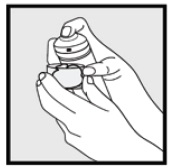
• pokud se plechovka jeví jako teplá nebo se zdá, že pěna je rýma, spusťte plechovku pod studenou vodou.
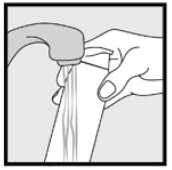
Krok 3: zvedněte malé množství Ketokonazolové pěny, 2% prsty a jemně protřete pěnu do postižené oblasti(oblastí), dokud pěna nezmizí.
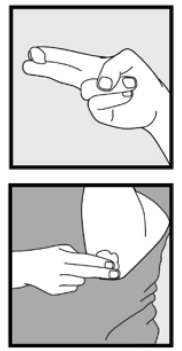
• pokud ošetřujete oblasti, jako je pokožka hlavy, rozdělte vlasy tak, aby Ketokonazolová pěna, 2% lze aplikovat přímo na kůži.

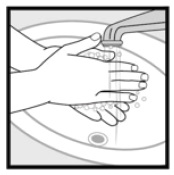
Krok 4: Po nanesení Ketokonazolové pěny si umyjte ruce, 2%. • Všechen nepoužitý přípravek, který zbyl v uzávěru, vyhoďte.
Jak mám uchovávat Ketokonazolovou pěnu, 2%?
• 2% Ketokonazolovou pěnu Skladujte při pokojové teplotě mezi 68°F až 77°F (20°C až 25°C). * Neuchovávejte Ketokonazolovou pěnu, 2% plechovku v chladničce nebo mrazničce. * Udržujte Ketokonazolovou pěnu, 2% mimo dosah tepla. Nikdy nevyhazujte plechovku do ohně, i když je plechovka prázdná. * 2% Ketokonazolovou pěnu Neuchovávejte při teplotách nad 120 ° F (49°C). • Nepropichujte (nepropichujte) Ketokonazolovou pěnu, 2% plechovku.
uchovávejte Ketokonazolovou pěnu, 2% a všechny léky mimo dosah dětí.
tento návod k použití byl schválen americkým Úřadem pro kontrolu potravin a léčiv.
pouze Rx
Vyrobeno v Izraeli
vyrobeno společností Perrigo
Yeruham, Izrael
distribuováno společností
Perrigo®
Allegan, MI 49010
www.perrigo.com
Rev 08-18
informace pro pacienta
Ketokonazolová pěna, 2%
důležité informace: Ketokonazolová pěna, 2% je určena pouze na kůži. Nepoužívejte Ketokonazolovou pěnu, 2% do očí, úst nebo pochvy.
co je Ketokonazolová pěna, 2%?
Ketokonazolová pěna, 2% je lék na předpis používaný na kůži (topický) k léčbě seboroické dermatitidy u lidí ve věku 12 let a starších s normálním imunitním systémem.
není známo, zda je Ketokonazolová pěna 2% bezpečná a účinná při léčbě plísňových infekcí.
není známo, zda Ketokonazolová pěna, 2% je bezpečná a účinná u dětí mladších 12 let.
před použitím Ketokonazolové pěny, 2%, informujte svého poskytovatele zdravotní péče o všech svých zdravotních onemocněních, včetně případů, kdy:
* jste těhotná nebo plánujete otěhotnět. Není známo, zda Ketokonazolová pěna, 2% poškodí vaše nenarozené dítě. * kojíte nebo plánujete kojit. Není známo, zda ketokonazol pěna, 2% přechází do mateřského mléka. Poraďte se se svým poskytovatelem zdravotní péče o nejlepším způsobu krmení dítěte během léčby Ketokonazolovou pěnou, 2%.
informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků.
Jak mám používat Ketokonazolovou pěnu, 2%?
* použijte Ketokonazolovou pěnu, 2% přesně podle pokynů vašeho poskytovatele zdravotní péče. Pokyny k aplikaci Ketokonazolové pěny, 2% správným způsobem, naleznete v podrobném“ návodu k použití “ na konci této příbalové informace. * Aplikujte Ketokonazolovou pěnu, 2% na postiženou oblast kůže 2krát denně po dobu 4 týdnů. Měli byste použít dostatek Ketokonazolové pěny, 2% na pokrytí celé postižené oblasti(oblastí). * Poraďte se se svým poskytovatelem zdravotní péče, pokud se vaše pokožka po 4 týdnech léčby Ketokonazolovou pěnou nezlepší, 2%. * Dávkujte Ketokonazolovou pěnu, 2% přímo do víčka. Nedávejte Ketokonazolovou pěnu, 2% přímo na ruce, protože pěna se začne tát při kontaktu s teplou pokožkou. * Po nanesení Ketokonazolové pěny si umyjte ruce, 2%.
co bych se měl vyhnout při použití Ketokonazolové pěny, 2%?
* Ketokonazolová pěna, 2% je hořlavá. Vyhněte se ohni, plamenům nebo kouření během a hned po aplikaci Ketokonazolové pěny, 2% na kůži. * Nepoužívejte Ketokonazolovou pěnu, 2% do očí, úst, rtů nebo pochvy nebo v jejich blízkosti. Pokud dostanete Ketokonazolovou pěnu, 2% na rtech nebo v očích, ústech nebo pochvě, dobře opláchněte vodou.
jaké jsou možné vedlejší účinky Ketokonazolové pěny, 2%?
Ketokonazolová pěna, 2% může způsobit závažné nežádoucí účinky, včetně:
* podráždění kůže v oblasti aplikace, včetně kožních reakcí způsobených vystavením světlu. Informujte svého poskytovatele zdravotní péče, pokud se u vás během léčby Ketokonazolovou pěnou objeví podráždění kůže, 2%.
mezi nejčastější nežádoucí účinky Ketokonazolové pěny, 2%, patří pálení, suchost, zarudnutí, podráždění, necitlivost, svědění, vyrážka a teplo v místě aplikace.
to nejsou všechny možné vedlejší účinky Ketokonazolové pěny, 2%.
vyhledejte lékařskou pomoc ohledně nežádoucích účinků. Můžete hlásit nežádoucí účinky FDA na 1-800-FDA-1088.
Jak mám uchovávat Ketokonazolovou pěnu, 2%?
• 2% Ketokonazolovou pěnu Skladujte při pokojové teplotě mezi 68°F až 77°F (20°C až 25°C). * Neuchovávejte Ketokonazolovou pěnu, 2% plechovku v chladničce nebo mrazničce. * Udržujte Ketokonazolovou pěnu, 2% mimo dosah tepla. Nikdy neházejte Ketokonazolovou pěnu, 2% plechovku do ohně, i když je plechovka prázdná. * 2% Ketokonazolovou pěnu Neuchovávejte při teplotách nad 120 ° F (49°C). • Nepropichujte (nepropichujte) Ketokonazolovou pěnu, 2% plechovku. Uchovávejte Ketokonazolovou pěnu, 2% a všechny léky mimo dosah dětí.
obecné informace o bezpečném a účinném použití Ketokonazolové pěny, 2%.
léky jsou někdy předepsány pro jiné účely, než které jsou uvedeny v příbalové informaci pro pacienta. Nepoužívejte Ketokonazolovou pěnu, 2% pro stav, pro který nebyla předepsána. Nedávejte Ketokonazolovou pěnu, 2% jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit. Můžete požádat svého lékárníka nebo poskytovatele zdravotní péče o informace o Ketokonazolové pěně, 2%, která je napsána pro zdravotnické pracovníky.
jaké jsou složky v Ketokonazolové pěně, 2%?
účinná látka: ketokonazol
neaktivní složky: cetylalkohol, kyselina citronová, ethanol (denaturovaný terc-butylalkoholem a brucinsulfátem) 58%, polysorbát 60, citrát draselný,propylenglykol, čištěná voda a stearylalkohol pod tlakem s uhlovodíkovou (propan/butanovou) hnací látkou
pro více informací volejte Perrigo na čísle 1-866-634-9120
Tato příbalová informace pro pacienty byla schválena americkým Úřadem pro kontrolu potravin a léčiv.
balení / štítek hlavní zobrazovací PANEL-krabička
pouze Rx
Ketokonazolová pěna, 2%
pouze pro lokální použití.
není určen k očnímu, perorálnímu nebo intravaginálnímu podání.
100 g

následující obrázek je zástupný symbol představující identifikátor produktu, který je během operace balení buď připevněn nebo vytištěn na štítku obalu léku.

| ketokonazol ketokonazolový aerosol, pěna |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
Labeler-Perrigo New York Inc (078846912)
více o ketokonazolu aktuální)
- nežádoucí účinky
- během těhotenství nebo kojení
- informace o dávkování
- porovnat alternativy
- ceny & kupóny
- španělština
- 36 recenze
- Drug class: topical antifungals
Consumer resources
- Patient Information
- Ketoconazole Topical (Advanced Reading)
Professional resources
- Prescribing Information
- Ketoconazole (Topical) (Professional Patient Advice)
- Ketoconazole Cream (FDA)
- Ketoconazole Shampoo (FDA)
Other brands Nizoral Shampoo, Ketodan, Extina, Xolegel
Related treatment guides
- Seborrheic Dermatitis
- Cutaneous Candidiasis
- Androgenetic Alopecia
- Dandruff
- … + 4 další
Zdravotní Disclaimer