Úvod
akutní junkční ektopická tachykardie (JET) se může objevit po operaci vrozených srdečních vad. Ačkoli je samovolně omezující během 48-72 hodin, úmrtnost při absenci okamžité léčby je 40% 1 kvůli zvýšené srdeční frekvenci (HR) a atrioventrikulární disociaci (AVD). Špatná odpověď na farmakologickou léčbu vedla k hledání dalších možností léčby, včetně mírné hypotermie.2 Tato léčba, poprvé popsaná v roce 1987,3, byla v literatuře hlášena zřídka a všechny zprávy zahrnují nízký počet pacientů.
pacienti a metoda
pacienti
zkontrolovali jsme klinické záznamy pacientů operovaných pro vrozené srdeční vady mezi zářím 1999 a říjnem 2001 v Área Infantil del Corazón (Dětská srdeční služba) nemocničního komplexu Juan Canalejo V A Coruña v severozápadním Španělsku. Byly zkoumány standardní elektrokardiogramy, stejně jako síňové elektrogramy zaznamenané během epizod arytmie s síňovými elektrodami umístěnými během chirurgického zákroku nebo s jícnovými elektrodami. Do této studie byli zahrnuti pouze pacienti s potvrzeným nebo pravděpodobným proudem, kteří byli léčeni podchlazením.
diagnostická kritéria
– potvrzená tryska: a) tachykardie s komplexem QRS podobným bazálnímu sledování nebo sledování získanému stimulací síní spolu s b) AVD s pomalejší síňovou rychlostí než komorová frekvence.
– pravděpodobný proud: zaznamenáno, když bylo splněno kritérium 1, Jak bylo uvedeno výše, ale nebylo možné prokázat AVD, nebo když došlo k retrográdní vodivosti 1:1 a arytmie nereagovala na elektrickou kardioverzi nebo nadměrnou stimulaci síní.
léčba
léčba JET byla založena na: a) základních opatřeních (snížené užívání inotropních látek, sedace, korekce elektrolytové nerovnováhy); b) kardiostimulátor (k obnovení atrioventrikulární synchronizace stanovením HR rychleji než ta způsobená tryskou); c) hypotermie a d) antiarytmika. Digoxin byl použit pro inotropní a diuretickou podporu u některých pacientů.
hypotermie byla zahájena, když se hemodynamický stav navzdory základním opatřením zhoršil, nebo když nebylo možné udržovat rychlost kardiostimulátoru rychleji než rychlost trysky. Všichni pacienti byli sedativy a umístěni na mechanickou ventilaci svalovými relaxanci. Byly použity ventilátory, studené obaly umístěné na kůži a výplach studeným fyziologickým roztokem nasogastrickou sondou. Teplota byla snížena, dokud rychlost trysky neklesla, ale nikdy pod 33 ° C, měřeno rektálním teploměrem. Pacienti byli pomalu zahříváni (1 ºC/8 h) po nejméně 36 hodinách hemodynamické stability (adekvátní centrální žilní tlak, arteriální tlak a diuréza) zvýšením vnějších zdrojů tepla za konstantního elektrokardiografického sledování. U pacientů léčených kardiostimulátorem byla tato léčba přerušena, když se objevil normální sinusový rytmus nebo když rychlost tryskání klesla pod 75. percentil normality podle věku.
Statistická analýza
kvantitativní proměnné jsou vyjádřeny jako průměr±směrodatná odchylka a medián je také uveden pro proměnné, jejichž distribuce byla výrazně asymetrická. Kategorické proměnné jsou vyjádřeny jako absolutní hodnoty (procenta). Změny hemodynamických hodnot získaných při 1, 2,4, 8, 12 a 24 h od začátku hypotermie byly analyzovány s MANOVOU pro lineární trendy pro opakovaná měření; normální distribuce dat byla předem ověřena Shapiro-Wilksovým testem. Rozdíly byly považovány za významné při výsledcích P
celkem 138 pacientů podstoupilo dětskou srdeční operaci s kardiopulmonálním bypassem; u 21 (15,2%) se vyvinul potvrzený nebo pravděpodobný proud a hypotermie byla použita u 12 analyzovaných pacientů (9 dívek, průměrný věk 2,1±2,0 měsíců) (Tabulka 1). Nástup proudu byl zaznamenán 6, 3±11, 9 h po operaci (medián, 2 h). V té chvíli byla teplota 37,0±0,7 °C (tabulka 2). Hypotermie byla zahájena 1, 5±0, 5 h po nástupu trysky (medián, 1,0 h) a trvala 74±42 h (rozsah, 36-144 h). Během hypotermie byl digoxin použit u 6 pacientů a u 4 z nich byl amiodaron také podán k podpoře během hypotermie. Kardiostimulátor byl použit u 10 pacientů: v 9 byly na operační sál umístěny epikardiální elektrody a v 1 byla použita jícnová elektroda.
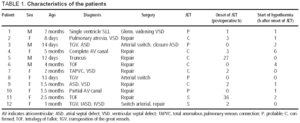
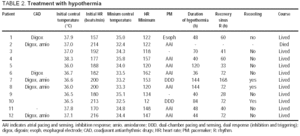
změny centrální teploty a hemodynamického stavu během prvních 24 hodin jsou znázorněny na obrázku 1. Největší zlepšení bylo dosaženo během prvních 4 hodin hypotermie, po které pacienti zůstali stabilní.
obr. 1. Kurz během prvních 24 hodin hypotermie. Řádky ilustrují prostředky a 95% intervaly spolehlivosti. Hodnoty P odkazují na testy lineárních trendů MANOVA pro opakovaná opatření. HR indikuje srdeční frekvenci; tepů / min, tepů za minutu; T, teplota; SBP, systolický krevní tlak; CVP, centrální žilní tlak.
všichni pacienti kromě jednoho přežili. Dítě, které zemřelo, mělo nízký výstupní stav sekundární k tryskám, který byl refrakterní k léčbě. Nebyly zjištěny žádné komplikace přímo způsobené podchlazením. V době opětovného zahřívání mělo 5 pacientů JET; jeden vyžadoval opětovné chlazení kvůli významnému zvýšení HR. převážně sinusový rytmus se znovu objevil 65±38 h po začátku hypotermie. Dva ze 6 pacientů, kteří během hypotermie obnovili normální sinusový rytmus, vyžadovali opětovné chlazení, protože se znovu objevil JET a rapid HR.
11 propuštěných pacientů zůstalo naživu a nemělo neurologické následky po průměrné době sledování 15±12 měsíců (rozmezí 2-36 měsíců). Sinusový rytmus byl udržován bez arytmie během sledování.
diskuse
pooperační paprsek vychází z ektopického zaměření umístěného v uzlové tkáni nebo svazku His a je vyvolán mechanickým podrážděním během operace.2 díky své ektopické povaze je citlivý na sympaticko-vagální rovnováhu a odolný vůči nadměrné stimulaci síní nebo elektrické kardioverzi. Vysoký HR a AVD snižují srdeční výdej, což zase zrychluje arytmii kvůli zvýšenému adrenergnímu tónu, čímž vytváří začarovaný kruh.1,2 protože proces je samovolně omezující během 48-72 h, 2 hlavním cílem léčby je udržení vhodného srdečního výdeje, dokud arytmie spontánně nezmizí.
léčba by měla zahrnovat1,2,4,5 korekce nerovnováhy elektrolytů a acidobazické nerovnováhy, odstranění adrenergních podnětů (bolest, podráždění, úzkost), vhodné sedace a snížené hladiny inotropních a vazodilatačních činidel, které urychlují HR a JET.2 odpověď na antiarytmika je špatná, 2 a digoxin není účinný.5 zdá se, že propafenon má určitý přínos, 6 navzdory skutečnosti, že se jedná o negativní inotropní činidlo. Amiodaron je užitečný7, 8, i když podle našich zkušeností může vyžadovat rozšíření objemu kvůli výskytu hypotenze. Prokainamid je účinný v kombinaci s hypotermií pouze tehdy, když je samotná hypotermie nedostatečná.5 úloha beta blokátorů je kontroverzní, 2 a antagonisté vápníku se nedoporučují. Dalšími možnostmi léčby jsou různé způsoby stimulace kardiostimulátory a rychlá ablace svazku His v refrakterních případech.1,2
včasná diagnóza je zásadní. Pokud je podezření na JET, měl by být proveden 12-olověný elektrokardiogram a síňový elektrogram.9 v naší sérii pacientů umožnila síňová elektrografie odhalit AVD u 2 pacientů a potvrdit podezření u 6 pacientů, u kterých povrchový elektrokardiogram naznačoval AVD (Obrázek 2).
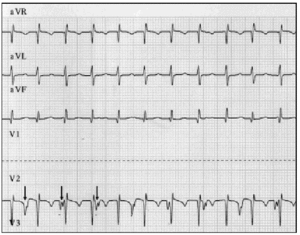
obr. 2. Elektrokardiografické sledování JET, včetně AVR, aVL a aVF vede. Dolní trasování ukazuje síňový elektrogram a bylo získáno připojením olova obvykle používaného pro elektrodu V2 k síňové epikardiální elektrodě. Toto sledování ukazuje zvýšenou síňovou aktivitu (šipky); atrioventrikulární disociace je patrná z pomalejší síňové rychlosti ve srovnání s komorovou frekvencí.
léčba hypotermie je založena na pozorování, že snížená centrální teplota snižuje Automatičnost buněk kardiostimulátoru. Vzhledem k tomu, že první zpráva o této léčbě byla zveřejněna Bash et al., v roce 1987,3 se objevily rozptýlené zprávy o úspěšném použití hypotermie u malého počtu pacientů.9,10 cílem těchto zásahů bylo dosáhnout centrální teploty 32-35 °C. Naším cílem bylo snížit HR, dokud nebude možná vhodná léčba kardiostimulátorem, a vyhnout se tak hluboké hypotermii a jejím možným vedlejším účinkům. U 2 pacientů nebyly použity kardiostimulátory, protože síňové epikardiální elektrody nebyly k dispozici. Vzhledem k jejich dobrému klinickému průběhu jsme se rozhodli nepoužívat jícnovou elektrodu. Vzhledem k našemu studijnímu návrhu nebylo možné posoudit relativní užitečnost digoxinu a amiodaronu podávaných během hypotermie při kontrole HR.
u této řady pacientů byla hypotermie spojená s použitím kardiostimulátoru účinnou a bezpečnou volbou. Hemodynamické změny nastaly během několika hodin a nebyly pozorovány žádné vedlejší účinky přímo způsobené hypotermií. Ačkoli malý počet pacientů, které jsme studovali, nám neumožňuje zobecnit, úmrtnost v naší sérii 8, 3% byla jasně nižší než 40% údaj hlášený pro konzervativní léčbu.1 dítě, které zemřelo, bylo jedním z prvních pacientů v sérii a mělo velmi rychlou tachykardii, která by mohla představovat selhání hypotermie.
opětovné zahřívání bylo zahájeno po nejméně 36 h hemodynamické stability bez čekání na obnovení stabilního sinusového rytmu. Pravděpodobnost, že by bylo zapotřebí opětovné chlazení (27%), nesouvisela se sinusovým rytmem nebo proudem, a proto máme pocit, že opětovné zahřívání lze načasovat pouze na základě hemodynamických kritérií.
omezení naší studie jsou omezení spojená s jakoukoli retrospektivní observační analýzou založenou na malém počtu pacientů bez kontrolní skupiny. Přesto se domníváme, že naše zjištění spolu s dalšími publikovanými zprávami podporují použití hypotermie jako účinné a bezpečné léčby pro řízení pooperačního proudu.