IVMED-80, et to gange dagligt øjendråber til behandling af keratoconus under udvikling af iVeena Delivery Systems, blev for nylig tildelt orphan drug betegnelse af FDA. Dette lægemiddel med sin kobberbaserede formulering er angiveligt det første øjendråbe designet til behandling af keratoconus uden behov for supplerende laserbehandling eller kirurgisk indgreb. Humane kliniske forsøg er indstillet til at begynde i første halvdel af dette år.
tidlige dyreforsøg har vist,at øjendråber inducerede central udfladning og øget corneastivning in vivo hos kaniner (Figur 1), 1 og humane kadaverundersøgelser har vist, at formuleringen øgede aktiviteten af lysyl-OKSIDASE og hornhindestivhed hos humane keratokoniske hornhinder tidligere vivo.2 Lav LOKSAKTIVITET i hornhinden har været forbundet med udviklingen af keratoconus både genetisk og biokemisk.3 IVMED – 80 formuleringen er baseret på en cofaktor for loks. Detaljerede resultater fra disse tidlige undersøgelser vil blive rapporteret på ARVO i Maj.
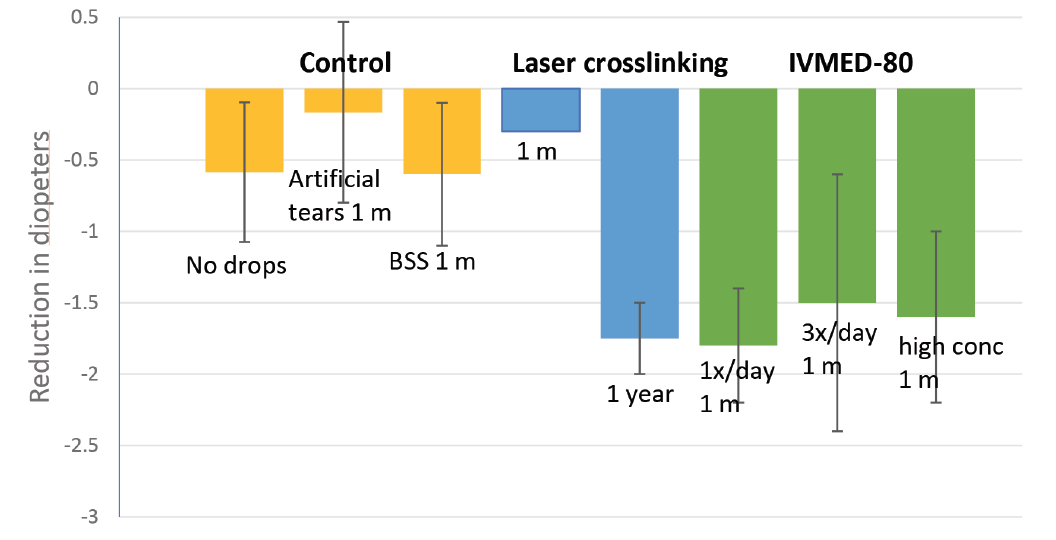
Figur 1. IVMED – 80 var effektivt til at reducere hornhindedioptermålinger hos kaniner sammenlignet med kontrolbehandlinger. Øjenfaldet opnåede forbedring i hornhindeelastisk modul inden for 1 til 4 ugers behandling til et niveau, der kunne sammenlignes med konventionel CKSL 1 år efter laseroperation hos kaniner.
- tidlige undersøgelsesresultater
- klinisk FORSØGSMÅL
- INSPIRATION og INNOVATION
- Eksperimentelle Øjendråber: Et muligt skridt fremad i Keratoconus-behandling
- en konservativ, ikke-invasiv behandling kunne øge hornhindens biokemiske og biomekaniske resistens mod ektasi-progression.
- forbindelsen
- eksperimentelle øjendråber til KERATOCONUS
- Cosimo, MD, PhD
- Cosimo, MD, PhD
- Bala Ambati, MD
- Bala Ambati, MD
- Gerald Simmons
- Gerald Simmons
- Sarah Molokhia, PhD
- Sarah Molokhia, PhD
- Michael Burr, MS, MBA
- Michael Burr, MS, MBA
tidlige undersøgelsesresultater
de tidlige in vivo-og tidligere vivo-studier blev ledet af hovedforsker Sarah Molokhia, ph.d., iveenas direktør for forskning og udvikling. I en samtale med CRST sagde dr. Molokhia sagde, at IVMED-80 i både in vivo-dyreforsøgene og de humane kadaver tidligere vivo-undersøgelser viste en effekt 6 uger efter, at dråber blev administreret. “Med dyrene kiggede vi på topografi såvel som OCT-billeder, og vi har set hornhindefladning og en stigning i hornhindens biomekaniske styrke. Og med de eks vivo keratokoniske humane hornhinder, vi kiggede på LOKSAKTIVITETEN af hornhindefibroblaster såvel som hornhindens biomekanik—hornhindens stress-belastningskurver—og indtil videre har vi set en effekt 6 uger eller tidligere i begge modeller,” hun sagde. “Vi arbejder i øjeblikket med dosering og får en bedre forståelse af koncentrationen og regimen. Vi planlægger at starte en fase 1 – 2a undersøgelse, primært for sikkerhed, inden for de kommende 3 til 4 måneder.”
klinisk FORSØGSMÅL
formålet med det kommende kliniske forsøg er at undersøge, om behandlingen kræver brug i hele patientens liv, eller om der er en dosis, der kan tages over en periode for at give langvarig eller permanent forbedring af kollagenstivhed. “Jeg er virkelig interesseret i at se, om effekten vil vare; Jeg vil gerne forstå, hvor længe patienterne skal tage dråberne. Effekten kommer ret hurtigt, men spørgsmålet er: hvis øjendråben stoppes, vil effekten ende?”Sagde Dr. Molokhia. “En måde, vi behandler dette spørgsmål på, er ved at designe det kliniske forsøg med en arm, der giver behandling i 6 uger, og en anden, der går længere,” forklarede hun.
de humane kliniske forsøg vil målrette behandling hos patienter med mild til moderat keratoconus, og forsøgsdosering vil være to gange dagligt, ifølge Michael Burr, MS, MBA, iVeena vicepræsident for produktudvikling. “Vi tror, det vil have applikationer i flere faser af sygdomsprogressionen,” sagde han.
INSPIRATION og INNOVATION
IVMED-80 er udtænkt af cornea specialist og Iveena grundlægger Bala Ambati, MD. Dr. Ambati, der er professor i oftalmologi ved Moran Eye Center ved University of Utah, fulgte de kliniske forsøg med stor interesse og begyndte at spekulere på, om der kunne være en måde at formulere et øjendråbe på, der kunne have samme virkning som tværbinding. Hvis det var muligt, begrundede han, ville resultatet være en ikke-invasiv, relativt omkostningseffektiv topisk terapi til behandling af keratoconus. Dr. Ambati sagde, ” farmakologisk tværbinding uden laser eller kirurgi ville være en spilskifter for læger og patienter med en kronisk sygdom, der i øjeblikket behandles med en operation-epi—off-det er meget dyrt, tidskrævende og har betydelige risici.”
Eksperimentelle Øjendråber: Et muligt skridt fremad i Keratoconus-behandling
en konservativ, ikke-invasiv behandling kunne øge hornhindens biokemiske og biomekaniske resistens mod ektasi-progression.
MD, PhD

FDA tildelte for nylig forældreløs lægemiddelstatus til IVMED-80 (iVeena), et øjendråbe til behandling af keratoconus uafhængig af kirurgi eller laserbehandling. Denne nye teknologi er baseret på en cofaktor for lysyl-aktivitet. Ifølge foreløbige data er lav LOKSAKTIVITET i hornhinden blevet knyttet til de biokemiske patogenetiske faktorer, der er involveret i udviklingen af keratoconus.1-3
Lysyl oksidaser, en familie bestående af loks og fire LOKSLIGNENDE bindinger (LOKSL1-4), katalyserer dannelsen af kollagentværbindinger og elastin og er impliceret i den aldersrelaterede afstivning af hornhinden synonymt med keratoconus. Selvom patogenesen af keratoconus er kompleks og uklar, er en nuværende hypotese baseret på ændringer i organisationen og strukturen af kollagenfibriller og ekstracellulær matrice.
ifølge litteraturen er alle fire LOKSLIGNENDE stoffer til stede i hvert hornhindelag såvel som i limbus og bindehinde. En lavere farvningsintensitet af LOKSL2 blev fundet ved anvendelse af immunhistokemi og vestlig blot-analyse i keratoconus-prøver.1
forbindelsen
en metaanalyse, der evaluerede sammenhængen mellem genetiske varianter i loks med keratoconus, viste, at to LOKSVARIANTER (rs2956540 og rs10519694) kan påvirke individuel modtagelighed for keratoconus; resultaterne forblev imidlertid ufattelige på grund af den store heterogenitet, der eksisterede på tværs af populationer.2 faktisk kræves større og multietniske genetiske undersøgelser af keratoconus for yderligere at validere disse resultater.
nylige undersøgelser, der evaluerede korrelationen mellem visuelle og keratometri-resultater efter CKSL hos patienter med keratoconus og kegleepitel-specifikke genekspressionsniveauer, viste, at præoperative niveauer af molekylære faktorer som f.eks.3 undersøgelsen belyste den differentielle ekspression af et sæt lokale molekylære faktorer i hornhindens ektatiske kegleområde for at afdække en funktionel årsag til den fokale hornhindesvækkelse, der er karakteristisk for keratoconus i humane hornhindeprøver. Epitelceller blev opsamlet fra keratoconus-patienter (n = 66), der gennemgik CKSL-procedurer fra keglepunkt og periferi. Patienter med nonektatisk refraktiv kirurgi (n = 23) tjente som kontroller.
forholdet mellem epitelgenekspression i keglen og periferien af hvert øje blev estimeret ved kvantitativ polymerasekædereaktionsanalyse og korreleret med kliniske data. Epitel fra keglepunktet hos keratoconus-patienter havde forhøjede niveauer af de inflammatoriske faktorer tumornekrosefaktor-kur, interlukin-6 og matrice metalloproteinase 9 (MMP-9), men reduceret loks. Denne undersøgelse giver det første bevis for, at ændret hornhindeepitel og stromal ekspression af specifikke gener ved hornhindekeglens spids driver fokal strukturel svaghed i keratoconus.
eksperimentelle øjendråber til KERATOCONUS
de eksperimentelle resultater af iVeena-øjendråbernes virkning på humane keratokoniske hornhinder viste en stigning i LOKSAKTIVITET og afstivning af hornhinden. Ifølge morfologiske beviser, en induceret Central hornhindefladning hos kaniner blev demonstreret på Oct hornhindescanninger.
efter min mening kan dette lægemiddel repræsentere et skridt fremad for konservativ ikke-invasiv keratoconus-behandling, hvilket muliggør en relativt omkostningseffektiv behandling for keratoconus-progression, der skal bruges som en førstelinjetilgang i den tid, der er nødvendig for at opnå en spontan stabilitet af den ektatiske sygdom (35-40 år) eller i kombination med CKSL. Hvis det ikke var tilstrækkeligt alene, kunne ivmed-80 biokemisk behandling kombineres med både epitel-off og epitel-on CKSL. Især hvis kliniske resultater viser sikkerhed og effektivitet, kan denne terapi være en ikke-invasiv metode til behandling af progressiv keratoconus eller en adjuverende behandling af epitel-on CK, forbedring af dens effektivitet og reduktion af bivirkningerne ved fjernelse af epitel, såsom hornhindeinfektioner, postoperativ smerte og sårrelaterede komplikationer.
Point-of-care-test er nødvendige for at detektere specifik koncentration af LOKSNIVEAUER for at forudsige keratoconus-progression og respons på kombinerede terapier.
1. Dudakova L Sasaki T, Liskova P, Palos M, Jirsova K. I human kontrol og keratokoniske hornhinder. Histol Histopatol. 2016; 31(1):63-71.
2. J, J, Hong J et al. Associering af almindelige varianter i loks med keratoconus: en meta-analyse. PLoS One. 2015; 10 (12): e0145815.
3. Pahuja N, Kumar NR, Shroff R, et al. Differentiel molekylær ekspression af ekstracellulær Matrice og inflammatoriske gener ved hornhindens keglepunkt driver fokal svækkelse i keratoconus. Invest Ophthalmol Vis Sci. 2016;57(13):5372-5382.
Cosimo, MD, PhD
Cosimo, MD, PhD
- adjunkt i hornhindepatologi, Postgraduate oftalmologi skole, institut for medicin, kirurgi og neurovidenskab, University of Siena, Italien
- direktør, Siena Crosslinking Center, Ocu-Medical VISION
- [email protected]
- finansielle oplysninger: ingen anerkendt
FDA ‘ s Orphan Drug Act giver et bundt af fordele, der har til formål at anspore udviklingen af behandlinger for sjældne sygdomme. Disse fordele kan omfatte skattefradrag for at udligne udgifter til kliniske forsøg og markedseksklusivitet efter godkendelse.
Gerald Simmons, IVEENAS administrerende direktør, bemærkede, at FDA ‘ s forældreløse lægemiddelbetegnelse er ret signifikant. “Hvad det i det væsentlige betyder er, at vi skal kunne tage produktet igennem til kommercialisering, og hvis det bliver godkendt af FDA, vil det betyde, at vi har eneret til at markedsføre et øjendråbe til keratoconus i 7 år. Intet andet selskab ville være i stand til at markedsføre et lignende aktuelt øjendråbe for keratoconus i hele denne periode. Denne eksklusivitet er ekstremt værdifuld, fordi den eliminerer potentialet for konkurrence inden for den tidsramme, og det er uvurderligt, især for et lille voksende firma som vores.”Han siger, at det også er stærkt for en potentiel corporate licenstager, fordi “hvis vi skulle licensere dette produkt til et stort lægemiddelfirma, ville det sikre den samme eksklusivitet.”
Mr. Burr foreslog, at den forældreløse betegnelse også har uskrevne fordele. “Hvad orphan drug-betegnelsen gør for vores virksomhed er, at det straks giver os troværdighed, fordi det repræsenterer et valideringssignal fra FDA om, at vi faktisk har udviklet noget, der har et enormt potentiale.”
1. Data på filen; iVeena.
2. Data på filen; iVeena.
3. Bykhovskaya Y, Li, Epifantseva I, et al. Keratoconus i familie-og case-kontrolundersøgelser. Invest Ophthalmol Vis Sci. 2012;53(7):4152-4157.
Bala Ambati, MD
Bala Ambati, MD
- grundlægger og præsident, iVeena Delivery Systems
- professor i oftalmologi, Moran Eye Center, University of Utah
- [email protected]
- finansiel oplysning: ejer af egenkapital og konsulent (iVeena Delivery Systems)
Gerald Simmons
Gerald Simmons
- CEO, iVeena Delivery Systems
- [email protected]
- finansielle oplysninger: Medarbejder (iVeena Delivery Systems)
Sarah Molokhia, PhD
Sarah Molokhia, PhD
- direktør for forskning og udvikling, iVeena Delivery Systems
- adjungeret adjunkt, University of Utah School of Medicine
- [email protected]
- finansielle oplysninger: Medarbejder (iVeena Delivery Systems)
Michael Burr, MS, MBA
Michael Burr, MS, MBA
- vicepræsident for produktudvikling, iVeena Delivery Systems
- [email protected]
- finansiel oplysning: medarbejder (iVeena Delivery Systems)