introduktion
Kruppel-lignende faktor 4 (KLF4) er medlem af familien af sinc-finger transkriptionsfaktor,som udtrykkes i forskellige humane væv. Det er velkendt som en af de fire faktorer for induktion til pluripotente stamceller (iPSC ‘ er) (Ghaleb og Yang, 2017). KLF4 kan regulere flere vigtige biologiske processer såsom neuroinflammation, oksidativ stress, proliferation, differentiering og apoptose (Kaushik et al., 2010; Mamonkin et al., 2013; Chang et al., 2015; Miao et al., 2017; Et Al., 2017). Mængder af tidligere undersøgelser fokuserede på KLF4S rolle i kræftudvikling og progression (Karam et al., 2017; Yadav et al., 2018). KLF4 er en transkriptionsfaktor med dobbelt funktion, som kan udøve sin rolle som et onkogen eller et tumorundertrykkende gen afhængigt af kræfttypen eller kræftstadiet (Evans og Liu, 2008). Det kan aktivere eller hæmme transkription af gener involveret i celleproliferation, differentiering og apoptose (ding et al., 2015). KLF4 kan samarbejde med andre omprogrammeringsfaktorer for at konvertere de somatiske celler til iPSC ‘ er og hæmme differentieringen af stamceller (Takahashi og Yamanaka, 2006; van Schaijik et al., 2018). Dette giver terapeutiske udsigter til vaskulære sygdomme, immunsygdomme, anoreksi og andre sygdomme (Imbernon et al., 2014; Liu Y. et al., 2015; Murgai et al., 2017). Desuden kan KLF4 spille en bredt regulerende rolle i centralnervesystemet (CNS). Flere undersøgelser tyder på, at KLF4 er forbundet med flere neurologiske lidelser, herunder ad, epilepsi, Parkinsons sygdom, hydrocephalus og schisofreni., 2011; et al., 2013; Han et al., 2015; Nishiguchi et al., 2015; Li L. et al., 2017).
AD er en af de mest almindelige kroniske neurodegenerative sygdomme, som fører til kognitive og hukommelsessvigt, forskellige mentale symptomer og adfærdsmæssig abnormitet og progressiv demens er det mest almindelige kliniske træk (Jiang et al., 2018). Den nuværende bekræftet patogene faktorer af ANNONCEN omfatter dannelsen af senile plaques, der er fremkaldt af unormal amyloid-β (Aß) deposition og neurofibrillary tangles eller dystrofiske neuritis, der er fremkaldt af tau ophobning (Querfurth og LaFerla, 2010; Shinohara et al., 2014). Derudover kan AD også påvirkes af genetiske faktorer. Imidlertid er den fremkaldte patogenese stadig uklar. De mest udbredte lægemidler til AD-behandling inkluderer neurotransmitterforstærkere, anti-Amyloidmidler, neuroprotektive peptider og andre lægemidler (Cacabelos, 2018). Især har flere undersøgelser vist, at KLF4 spillede en væsentlig rolle i patogenesen af AD. I denne gennemgang fokuserer vi på klf4 ‘ s regulerende rolle i neuroinflammation, neuronal apoptose, aksonal regenerering og jernakkumulering for at forklare sammenhængen mellem KLF4 og patogenesen af AD, som kan give indsigt i de cellulære og molekylære mekanismer for neurodegenerative lidelser.
de biologiske egenskaber ved KLF4
KLF4 er et fingerholdigt nukleart protein, isoleret fra NIH 3T3 bibliotek og placeret i cellekernen. Det blev først identificeret og karakteriseret ved Shields et al. (1996). Molekylmassen af human KLF4 er 55kD, og den er placeret på kromosomet 9k31. KLF4 dækker et 6,3 kb gensegment og har fem eksoner. Dens cDNA-kodende region koder for et polypeptid bestående af 470 aminosyrerester (endnu et al., 1998; Ghaleb og Yang, 2017). Den carboksyterminal af KLF4 har en DNA-bindende struktur region indeholdende tre Cys2His2 (C2H2) type sinc finger strukturer, som er dannet af 81 stærkt konserverede aminosyrer. Det regulerer transkription ved høj affinitet med CACCC-elementer og GC-rige målgen-DNA-sekvenser (Shields and Yang, 1998; Pearson et al., 2008). De fleste af KLF4 ‘ s DNA-bindingssteder er placeret inden for fingregionen, herunder N-terminal transkriptionsaktiveringsdomæne for proteiner, der interagerer, C-terminal sinc-fingerstruktur til DNA-binding og transkriptionsinhiberingssone (Bieker, 2001). KLF4 er involveret i regulering af ekspressionen af mange endogene gener (Shields and Yang, 1998). Der er et meget variabelt transkriptionelt regulatorisk domæne ved amino terminus af KLF4. Aminosyreresterne placeret mellem 91 og 117 aminoen udgør et transkriptionelt aktiveringsdomæne, som er rig på prolin og serin, mens der også findes et transkriptionelt undertrykkelsesdomæne. Derfor har KLF4 to bivirkninger: aktivering og hæmning af gentranskription (endnu et al., 1998; ve et al., 2006).
under den embryonale udvikling var KLF4 højere udtrykt i det sene stadium af embryonal udvikling. I modne væv og organer udtrykkes KLF4 hovedsageligt i mave-tarmkanalen, mundhulen, hudepidermier, vaskulært endotel og nyre og udtrykkes mindre i hjernen (Segre et al., 1999; Ghaleb et al., 2011; Liu et al., 2013; Chen et al., 2015; han et al., 2015; Bin et al., 2016). Det menes at spille en væsentlig rolle i reguleringen af celleproliferation og differentiering. Desuden kan KLF4 også regulere cellecyklus. KLF4 kan aktivere P21 på en p53-afhængig måde (Jang et al., 2000). Derudover blev det fundet, at klf4 (–/–) celler kom ind i senescensfasen tidligere end KLF4 (+/+) celler, hvilket kan forklares med det mindre antioksidante genekspression og højere niveau af reaktive iltarter (ROS) i klf4 (–/–) celler. ROS kan øge p53 og p21 ekspression og efterfølgende fremme DNA-skader (Liu C. Et Al., 2015). Det blev fundet, at PRMT5 kan hæve KLF4-ekspressionen i proteinniveauer. PRMT5 blev rapporteret at øge transkriptionen af p21 og mindske ekspressionen af Baks via inhiberende KLF4 allestedsnærværende (Hu et al., 2015). Desuden har adskillige undersøgelser vist, at KLF4 er involveret i regulering af apoptose af neuroner (Kong et al., 2016; Cui et al., 2017; sang et al., 2018). Fysiologisk regulerende rolle KLF4, som vi har kendt, er stadig lidt, og yderligere undersøgelser er nødvendige.
Klf4 ‘ s rolle i AD
det er veletableret, at AD hovedsageligt er kendetegnet ved hukommelses-og kognitive svækkelser og udøvende dysfunktion (Goedert og Spillantini, 2006). Mange undersøgelser har vist, at neuronal apoptose og synaptisk dysfunktion er patologisk grundlag for nedgangen i kognitiv funktion (Caccamo et al., 2017; Guo et al., 2017; Yoon et al., 2018). Den akkumulerede skade på en kolon-aflejring, oksidativ stress og jernakkumulering kan føre til neuronal dysfunktion og apoptose hos AD-patienter. Flere undersøgelser har vist, at KLF4S regulerende rolle synes at være afgørende i CNS. I betragtning af at KLF4 blev rapporteret at regulere neuronal apoptose, synaptisk regenerering, oksidativ stress og neuroinflammation, kan forholdet mellem KLF4 og patogenesen af AD være et potentielt nyt mål for AD-behandling.
Klf4 ‘ s rolle i Neuroinflammation
mængder af kliniske undersøgelser har vist, at en purpur kan aggregeres og er hovedkomponenten i de ekstracellulære aflejringer i hjernevævet hos AD-patienter, hvilket kan forringe de omgivende synapser og neuroner og føre til neuronal død. Unormal sekretion eller overdreven produktion af en kolon fører til patologiske ændringer af AD, så en kolon-aflejring er kerneforbindelsen til ad (Rajmohan og Reddy, 2017). Derudover har undersøgelser vist, at overdreven a-kur-aflejring kan stimulere gliaceller til at udskille ROS og andre påvirkningsfaktorer, hvilket fører til oksidativ stress. Det var kendt, at oksidativ stress kan stimulere produktionen af en kur. Derfor kan en kronisk stress interagere med hinanden og påvirke progressionen af AD (Cheignon et al., 2018).
KLF4 blev rapporteret som en potentiel modulator og har en stor effekt på inflammation ved mediering af makrofager og endotelceller (Figur 1) (Yoshida et al., 2014; Kapoor et al., 2015; Yang et al., 2018). I CNS kan overdrevne og kroniske inflammatoriske reaktioner forårsage skade på neuron og neurogliocyt. Det blev for nylig demonstreret, at KLF4-ekspressionen positivt korrelerede med en Larp42-induceret neuroinflammation. I mikrogliale BV2-celler kan oligomere a-Larr42 øge klf4-ekspression, som medieres af aktiveret P53 (Li L. et al., 2017). Under inflammatoriske tilstande, såsom en Larrus-akkumulering, kan frigivelsen af proinflammatoriske cytokiner stimuleres i genereringen af AD (Griffin and Barger, 2010). Neurotoksicitetsstyrke og proinflammatorisk styrke af opløselige a-Lol42-oligomerer er relativt højere end uopløselig fiberaflejring (Selkoe, 1991; Veinberg et al., 2018). Silence of KLF4 er i stand til at genoprette en Prip42-medieret neuroinflammation, og overekspression af KLF4 kan forværre en Prip42-medieret neuroinflammation (Li L. et al., 2017). En akkumulation af A. R. A. inducerer aktivering af astrocytter og mikroglia., 2016). Aktiverede astrocytter kan forbedre neuroinflammationen ved at frigive proinflammatoriske faktorer, såsom IL-1, IL-6 og TNF-Kurt (Rubio-Peres og Morillas-Ruis, 2012; Dom-Kurt et al., 2016). Den onde cirkel af inflammatoriske reaktioner fører til sidst til dysfunktion og neuronal apoptose.
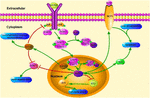
FIGUR 1. Skematicillustration af KLF4-relaterede signalveje. Denne figur fremhæver KLF4 ‘ s rolle i neurobeskyttelse og aksonregenerering. Pilene i figuren angiver aktivering eller forfremmelse, og de lige linjer angiver relateret hæmning. KLF4, Kruppel-lignende faktor 4; STAT3, Signaltransducer og aktivator af transkription 3; JAK, Janus Kinase; SOCS3, Suppressor af cytokinsignalering 3; HCP1, hæmbærerprotein 1; ERK5, mitogenaktiveret proteinkinase 5.
KLF4 spiller en afgørende rolle i reguleringen af proinflammatoriske signaler. I gliaceller øger klf4-aktivering suppressor af cytokinsignal 3 (SOCS3) via PI3-kinase-AKT-vej (Ghosh og Pahan, 2012). Den SiRNA-medierede nedslagning af KLF4 kunne dæmpe niveauet af SOC ‘ er i astroglia og mikroglia hos mus, som efterfølgende kunne påvirke ekspressionen af inflammatorisk gen (Kaushik et al., 2010; Ghosh og Pahan, 2012). Derudover kan SOCS-sletning fremme overlevelsen af skadede neuroner og fremme aksonregenerering (Smith et al., 2009; Sun et al., 2011). Og KLF4 regulerer positivt produktionen af IL-1-kur eller andre proinflammatoriske markører. Det regulerer positivt cyclooksigenase – 2 (koks-2) og negativt regulerer inducerbar nitratoksidsyntase (Inos) (Kaushik et al., 2013). Derudover er KLF4 en vigtig regulerende faktor for monocytdifferentiering og et potentielt mål for immunregulering (Alder et al., 2008). Derfor kan KLF4 fremme neuroinflammation ved at regulere disse negative regulatorer.
det er værd at nævne, at KLF4 i Parkinsons sygdomsmodel kan fremme MPP+-induceret oksidativ stress og neurotoksicitet og derefter øge neuronal apoptose og forsinke celleproliferationen (Chen et al., 2013). Stress er en ubalance mellem antioksidation og antioksidation. Frie radikaler kan forårsage ændringer i forskellige makromolekyler, hvilket fører til celleskader, cellealdring og vævsskade (Parajuli et al., 2013; Nie et al., 2015). Iltning stress kan forværre tidlig inflammation og en kur produktion og derefter forværre AD (Cai et al., 2011). Derfor kan KLF4 være involveret i oksidativ stress i AD.
disse fund indebærer, at KLF4 er en nøglerolle i mediering af neuroinflammation ved aktivering af mikroglia og følgelig frigivelse af proinflammatoriske cytokiner. Det har potentiale til at forbedre neuroinflammation. Indtil videre har mange undersøgelser af patogenesen af AD fokuseret på neuroinflammation. Som et potentielt mål for immunregulering kan KLF4 fremme mikroglias inflammatoriske reaktioner via påvirkning af relaterede negative regulatorer, hvilket har en stor effekt på udviklingen af AD.
Klf4 ‘ s rolle i apoptose
Neurodegenerative ændringer inkluderer gradvist tab af neuroner og synapser i de repræsentative hjerneområder, såsom hjernebarken, hippocampus og andre subkortiske regioner. De funktionelle svækkelser af CNS induceret af neuronalt tab er permanente (Citron, 2010). Vedvarende oksidativ stress kan føre til neuronal apoptose (vu et al., 2010). Et stort antal undersøgelser har bekræftet, at AD er tæt forbundet med oksidativ stress (Lee et al., 2012; Yui et al., 2015). Det blev fundet, at kronisk oksidativ stress kan forbedre ekspressionen af Phospholipase A2-gruppe 3 (Pla2g3) i astrocytter og forstyrre balancen af en Krorus og følgelig føre til udvikling af AD (Yui et al., 2015).
mange undersøgelser har vist, at KLF4 spiller en vigtig rolle i at hæmme udviklingen af oksidativ stress (Shi et al., 2014; Liu C. Et Al., 2015). Det blev fundet, at KLF4 kan fremme cellerne apoptose induceret af H2O2, denne handling er sandsynligvis forårsaget af øget baksekspression og nedsat bcl-2-ekspression (Li et al., 2010). Det kan reducere klf4-ekspression i humane neuroblastom SH-SY5Y-celler og øge ekspressionen af bcl-2/Baks-forholdet. Desuden kan Kvercetin moderere apoptosehastigheden for SH-5ysy-celler og reducere caspase-3-aktivitet (Ksi et al., 2012). En nylig undersøgelse undersøgte den neuroprotektive virkning af mitogenaktiveret protein (MAP) kinase 5 (ERK5) mod oksidativ stress. Aktivering af ERK5 kan delvist reducere H2O2-induceret hippocampusneuroner død og øge NGF – og PC-induceret neurobeskyttelse (Su et al., 2014). Nils et al. brugte en mutant af MEK5 (MEK5D) til at studere den ERK5-aktiverede transkription og funktionelle responser i humane endotelceller, og identificeret KLF4 var et nyt nedstrøms ERK5-mål (Ohnesorge et al., 2010). Det blev fundet, at overekspression af KLF4 kan undertrykke TNF-medierede inflammatoriske reaktioner og reducere leukocytadhæsion og basalcelleapoptose. Disse resultater bekræfter, at KLF4 har antiinflammatoriske og anti-apoptotiske egenskaber (Ohnesorge et al., 2010). Efterfølgende eksperimenter har vist, at forsvinden af cerebral kavernøs misdannelse 1 (CCM1) i endotelceller aktiverer ERK5 via MEKK3-MEK5 signalvej og øger klf4-ekspression (Cuttano et al., 2016). ERK5 spiller en formidlende rolle i forkonditionering (PC) og nervevækstfaktor (NGF) opreguleret ekspressionen af KLF4 (Su et al., 2014). Derudover kan RNAi-medieret nedlukning af KLF4 også reducere NGF-eller PC-induceret neurobeskyttelse. Overekspression af KLF4 fører til højere bcl-2 / Baks-forhold i H2O2-stressede celler (Su et al., 2014). Overudtrykt KLF4 accelererer ændringer i bcl – 2 og Baks ved at kombinere med dens tilsvarende promotor (Li et al., 2010). ERK5 / KLF4-kaskade kan fungere som en omdrejningspunkt i forskellige veje, der beskytter neuroner mod oksidativ stressinduceret død (Su et al., 2014).
Oksidativ stress er blevet anset for at være tæt forbundet med mange degenerative sygdomme. KLF4 spiller en væsentlig rolle i at opretholde genomisk stabilitet i iltnings stress. KLF4 og ERK5 handler sammen for at beskytte neuroner mod oksidativ stress-induceret apoptose. Derfor kan KLF4 fungere som et terapeutisk mål for at virke mod oksidativ stress, når det aktiveres. Det er rapporteret, at statinlægemidler kan aktivere ERK5, hvilket fører til ekspression af KLF4 og dets afhængige gener (Ohnesorge et al., 2010), men mekanismen forbliver uklar, og KLF4-relaterede opstrøms-og nedstrøms målgener er mindre undersøgt i oksidativ stress, er der behov for yderligere undersøgelse.
Klf4 ‘ s rolle i Aksonregenerering
tidligt aksontab er et fælles træk ved neurodegenerative sygdomme. Synaptisk tab og transportnedsættelse i AD kan forårsage kognitive svækkelser., 2011; Coleman, 2013). Den mest almindelige årsag til denne sygdom er, at der er et stort antal mennesker, der lider af denne sygdom. Opløselige a-oligomerer reducerer glutamatoptagelsen og fremmer synaptisk dysfunktion, hvilket forstyrrer synaptisk plasticitet (Li et al., 2009). Derfor er det især vigtigt at studere, hvordan man reparerer aksonerne i CNS. I retinale ganglionceller har aksoner en stærk evne til at vokse og regenerere under tidlig udvikling, men i CNS hos voksne pattedyr mister aksoner deres regenereringskapacitet, og neuronerne kan opgradere til at dø eller atrofi (Goldberg og Barres, 2000; Goldberg et al., 2002).
KLF4 spiller en vigtig rolle i at hæmme aksonvækst. I embryonale RGC ‘ er kan overekspression af KLF4 reducere procentdelen af neuritforlængelse, længden af aksoner og dendritter og neuritforgreningen. Desuden blev det konstateret, at overekspression af KLF4 kan reducere langsigtede postnatale aksonvæksthastigheder, men undlod at reducere kortsigtede aksonvæksthastigheder (Moore et al., 2009; Steketee et al., 2014). Senere undersøgelser har vist, at aksonbundterne af KLF4–CKO-mus var tykkere end kontrolmus (Fang et al., 2016). Derudover kan fjernelse af KLF4-ekspression under udvikling øge reproduktionspotentialet hos voksne RGC ‘ er. Derudover havde KLF4, der manglede det c-terminale DNA-bindingsdomæne, ingen effekt på aksonvæksten. Der var ingen indflydelse på cellernes overlevelse, efter at retinale ganglionceller blev skadet, hvis KLF4 slog ud (Moore et al., 2009).
KLF4 kan også påvirke den aksonale regenerering. En nylig undersøgelse rapporterede, at faldet i klf4-ekspression i voksne retinale ganglionceller fremmede aksonregenerering gennem JAK-STAT3-vej (Kin et al., 2013). KLF4 øgede fosforyleringen af STAT3 og regulerede aksonvæksten via jak-STAT signalering (2012). Under behandling af cytokiner phosphoryleres medlemmer af STAT-familien af proteiner ved carboksy-terminale tyrosin – og serinsteder i cellen for at danne en stabil dimer. Denne modifikation forbedrer transkription af celleassocierede gener (Yuan et al., 2005). Interaktionen mellem KLF4 og STAT3 på cytokininduceret phosphorylering af tyrosin705 hæmmer ekspressionen af STAT3 ved at hæmme bindingen af STAT3 til DNA., 2013). KLF4-nedslag forbedrer naturligvis aksons regenerering i retinale ganglionceller efter skade på synsnerven og forhindrer nerven i skade efter mild hjerneskade. Handlingerne medieres af et fald i p-p53 og en stigning i pstat3-niveauer. KLF4 regulerer positivt neuronal apoptose via p53-og JAK-STAT3-stierne, og KLF4 regulerer negativt aksonal reparation via JAK-STAT3-stien (cui et al., 2017).
Derfor antog vi, at i AD kan aksonal regenerering opnås ved at ændre ekspressionen af KLF4 eller ændre intracellulære relaterede signalveje og kontrollere AD-progression ved at reducere manglende aksoner eller reducere aksonal dysfunktion. Hvordan man bruger KLF4-transkriptionsfaktoren i potentielle terapeutiske midler, har dog stadig brug for yderligere efterforskning.
Klf4 ‘ s rolle i jernakkumulering
jern findes bredt i biologiske systemer, jernrelaterede metalloproteinaser spiller en nøglerolle i transport af ilt, overførsel af elektroner og katalysering af biokemiske reaktioner (Aisen et al., 2001). Imidlertid kan ethvert overskud af jern ud over det normale fysiologiske interval skade menneskers sundhed (Adlard og Bush, 2006). Undersøgelser har vist, at jernindholdet i hippocampus er negativt korreleret med udførelsen af hukommelsestest (ding et al., 2009). Øget jernbelastning i hjernen fremskynder dannelsen af en Kurplakker og hyperphosphorylerede tau-sammenfiltringer, samtidig med at den forbedrer oksidativ stress (Peters et al., 2015). Jern, som har en høj grad af permeabilitet, fremmer nervevækst og celle-til-celle-forbindelser under hjerneudvikling (Dallman og Spirito, 1977).
en nylig undersøgelse viste, at fysiologisk stress forårsagede aktivering af klf4-HCP1 signalvejen og øget hæmoptagelse (Li H. et al., 2017). Heme tegner sig for 95% af det funktionelle jern i menneskekroppen. Det er en af hovedkomponenterne i heme-iltenase (Hooda et al., 2014; Kuruc et al., 2018). Forøgelse af aktiviteten af iltgenase – 1 kan forsinke iltning af den aldrende hjerne (Verdile et al., 2015; Serini og Calviello, 2016; Kurucks et al., 2018). Dette har en lettelse effekt på AD. Fysiologisk stress inducerer stigning i glukokortikoidniveau, glukokortikoid øger hæmbærerprotein 1 (HCP1) ekspression via KLF4, og derefter fremmer HCP1 hæmoptagelse (Li H. et al., 2017). Glukokortikoid og KLF4 regulerer antiinflammatoriske gener sammen, og celler med lavt glukokortikoidindhold kan ikke fuldt ud inducere klf4-ekspression (Sevilla et al., 2015). KLF4-induceret stigning i hæmindtag fører til jernakkumulering i hjernen. Jern fremmer frigivelsen af ROS (Tronel et al., 2013). Jernelement forbedrer hjernens oksidative stress hos rotter under psykologisk stress (Yu et al., 2011). Derfor kan HCP1 reguleres af KLF4 og glukokortikoid sammen. Øget HCP1 øger hæm optagelse, hvilket fører direkte til jern ophobning i hjernen, forværrer iltning, øger apoptose eller dysfunktion og forværrer hjerneskade.
det er almindeligt accepteret, at hukommelse og indlæringsvanskeligheder er de vigtigste symptomer på AD. Et stort antal kliniske data har vist, at en larr-plakbelastning og jernakkumuleringsrespons på udviklingen af læring og kognitiv dysfunktion i AD (van Bergen et al., 2018). For nylig offentliggjorte data har antydet, at højdosis jern øger en kur-aflejring og dæmper læring og hukommelse hos mus (Guo et al., 2013). Kliniske undersøgelser har vist, at jernholdig mikroglia findes i hippocampus hos AD-patienter under magnetisk resonansbilleddannelse (Seineh et al., 2015). Microglia erhverver jern fra overførende eller ikke-overførende, ekstracellulære og intracellulære kilder (McCarthy et al., 2018). Selektiv og vedvarende klf4-ekspression kan induceres i kernen og cytoplasma af iskæmiske hippocampale reaktive astrocytter (Park et al., 2014). Undersøgelser har vist, at KLF4 fungerer som en transkriptionel repressor. Det nedregulerer ekspressionen af ELK-3, og derefter hæmmer ELK-3 ekspressionen af HO-1 (Tsoyi et al., 2015). Hæm iltsenase – 1 (HO-1) er et stressprotein, der nedbryder hæm til bilirubin, frit jern og kulilte. Up-regulering af HO-1 i astrocytter kan føre til unormal jernaflejring og mitokondriel dysfunktion i hjernen, hvilket fører til nedsat kognitiv evne (Schipper, 1999, 2004). Derfor kan KLF4 være involveret i processen med jernakkumulering i astrocytter, hvilket forværrer iltning i AD og forværrer hjerneskade.
konklusion
KLF4 er almindeligt kendt for at spille en central rolle i reguleringen af celleproliferation, apoptose og differentiering. Tidligere undersøgelser har fokuseret på regulering af KLF4 i flere vigtige neurofysiologiske processer, herunder neuroinflammation, neurobeskyttelse og synaptisk regenerering. For nylig har KLF4 vist sig at spille en vigtig rolle i patogenesen af AD. I denne artikel gennemgår vi klf4 ‘ s rolle i neurobeskyttelse og neurogenese i AD.
KLF4 er ikke kun en regulator for regulering af celleproliferation og differentiering, men også et potentielt mål for regulering af immunresponser. KLF4 kan regulere negative inflammatoriske faktorer og fremme inflammatorisk respons og have en stor effekt på ekspressionen af astrocyt nuklear mikroglia. Derudover kan KLF4 og ERK5 handle sammen for at udøve neuroprotektive handlinger. Desuden kan aksonregenerering opnås ved at ændre indholdet af specifikke transkriptionsfaktorer, intracellulære hæmmere eller ændre intracellulære signalveje. At slå KLF4 ud kan forbedre aksonregenerationen og fremskynde aksonvæksthastigheden. Reduktion af klf4-ekspression fremmer aksonregenerering gennem JAK-STAT3-stien, og KLF4 fremmer JAK-STAT3-vejen til yderligere aksonregenerering. Derfor kan KLF4 være involveret i processen med antiinflammatorisk, anti-apoptose, aksonregenerering og jernakkumulering i CNS, som spiller en central rolle i AD-generationen. Disse fund tyder på, at KLF4 repræsenterer et potentielt terapeutisk mål for AD. Imidlertid forbliver de dybe cellulære og molekylære mekanismer for virkningerne af KLF4 på AD uklare, og yderligere undersøgelser er nødvendige.
Forfatterbidrag
YJ skrev manuskriptet. SHG og JYL ændrede rammerne for manuskriptet. BJL og RJC leverede de kritiske revisioner. Alle forfattere godkendte den endelige version af manuskriptet til indsendelse.
finansiering
dette arbejde blev støttet af tilskud fra Kinas Naturvidenskabelige fond (NSFC) (81871070, 31571126, 31471120) og Jilin Science and Technology Agency finansiering (tilskud nr.20180519003jh, 20180414051GH, 20170414034gh og 20180414050gh).
interessekonflikt Erklæring
forfatterne erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.
Cacabelos, R. (2018). Har der været forbedringer i Lægemiddelopdagelsen over de sidste 5 år. Eksp. Opin. Stof Discov. 13, 523–538. doi: 10.1080/17460441.2018.1457645
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
Liu, Y., Shi, J. og Chen (2015). Identifikation af nye mål for sæsonbetinget allergisk rhinitis under og uden for pollensæsonen ved mikroarray-analyse. Acta Otolaryngol. 135, 1330–1336. doi: 10.3109 / 00016489.2015.1067906
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
Serini, S. og Calviello, G. (2016). Reduktion af oksidativ/nitrosativ stress i hjernen og dets involvering i den neuroprotektive virkning af n-3 PUFA ved sygdom. Curr. 13, 123-134. doi: 10.2174/1567205012666150921101147
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar