generisk navn: natriumpolystyrensulfonat
doseringsform: oral, rektal pulver
medicinsk gennemgået af Drugs.com. sidst opdateret den 21. september 2020.
- oversigt
- bivirkninger
- dosering
- professionel
- interaktioner
- mere
- Kaleksat pulver Beskrivelse
- Kaleksatpulver – Klinisk Farmakologi
- indikationer og anvendelse til Kaleksatpulver
- kontraindikationer
- advarsler
- forholdsregler
- lægemiddelinteraktioner
- ammende mødre
- pædiatrisk anvendelse
- bivirkninger
- overdosering
- Kaleksat pulver Dosering og Administration
- hvordan leveres Kaleksatpulver
- PAKKEETIKET.PRINCIPAL DISPLAY PANEL
- mere om Kaleksat (natriumpolystyrensulfonat)
- Forbrugerressourcer
- professionelle ressourcer
- relaterede behandlingsvejledninger
Kaleksat pulver Beskrivelse
Natriumpolystyrensulfonat, USP, er en bencen, diethenylpolymer, med ethenylbencen, sulfoneret, natriumsalt og har følgende strukturformel:
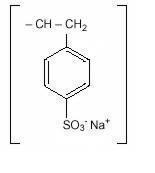
lægemidlet er en creme til lysebrun finmalet, pulveriseret form af natriumpolystyrensulfonat, en kationbytterharpiks fremstillet i natriumfasen med en in vitro-udvekslingskapacitet på cirka 3.1 mekv (in vivo ca. 1 mekv) kalium pr.gram. 100 mg (4,1 mekv) pr. Det kan indgives oralt eller i en enema.
Kaleksatpulver – Klinisk Farmakologi
når harpiksen passerer langs tarmen eller tilbageholdes i tyktarmen efter administration ved lavement, frigives natriumionerne delvist og erstattes af kaliumioner. For det meste forekommer denne handling i tyktarmen, som udskiller kaliumioner i større grad end tyndtarmen. Effektiviteten af denne proces er begrænset og uforudsigeligt variabel. Det tilnærmer sig almindeligvis størrelsesordenen 33 procent, men området er så stort, at de endelige indekser for elektrolytbalance skal overvåges tydeligt.
metaboliske data er ikke tilgængelige.
indikationer og anvendelse til Kaleksatpulver
Natriumpolystyrensulfonat, USP er indiceret til behandling af hyperkalæmi.
kontraindikationer
Natriumpolystyrensulfonat, USP er kontraindiceret under følgende forhold: patienter med hypokalæmi, patienter med en historie med overfølsomhed over for polystyrensulfonatharpikser, obstruktiv tarmsygdom, nyfødte med nedsat tarmmotilitet (postoperativt eller medikamentinduceret) og oral administration hos nyfødte (se forholdsregler).
advarsler
tarmnekrose: tilfælde af tarmnekrose, som kan være dødelig, og andre alvorlige gastrointestinale bivirkninger (blødning, iskæmisk colitis, perforering) er rapporteret i forbindelse med Natriumpolystyrensulfonat, USP-brug. Størstedelen af disse tilfælde rapporterede samtidig brug af sorbitol. Risikofaktorer for gastrointestinale bivirkninger var til stede i mange af tilfældene, herunder for tidlig fødsel, historie med tarmsygdom eller kirurgi, hypovolæmi og nyreinsufficiens og svigt. Samtidig administration af sorbitol anbefales ikke (se forholdsregler, lægemiddelinteraktioner).
• må kun anvendes til patienter med normal tarmfunktion. Undgå brug hos patienter, der ikke har haft afføring efter operationen.
• undgå brug hos patienter, der er i risiko for at udvikle forstoppelse eller påvirkning (inklusive dem med historie med påvirkning, kronisk forstoppelse, inflammatorisk tarmsygdom, iskæmisk colitis, vaskulær tarm aterosklerose, tidligere tarmresektion eller tarmobstruktion).
• afbryd brugen til patienter, der udvikler forstoppelse.
alternativ terapi ved svær hyperkalæmi
siden effektiv sænkning af serumkalium med Natriumpolystyrensulfonat kan USP tage timer til dage, behandling med dette lægemiddel alene kan være utilstrækkelig til hurtigt at korrigere svær hyperkalæmi forbundet med tilstande med hurtig vævsnedbrydning (f.eks. forbrændinger og nyresvigt) eller hyperkalæmi, der er så markeret, at det udgør en medicinsk nødsituation. Derfor bør andre endelige foranstaltninger, herunder dialyse, altid overvejes og kan være bydende nødvendige.
hypokalæmi
alvorlig kaliummangel kan forekomme ved behandling med Natriumpolystyrensulfonat, USP. Effekten skal kontrolleres omhyggeligt ved hyppige serumkaliumbestemmelser inden for hver 24-timers periode. Da intracellulær kaliummangel ikke altid afspejles af serumkaliumniveauer, skal det niveau, hvor behandling med Natriumpolystyrensulfonat, USP seponeres, bestemmes individuelt for hver patient. Vigtige hjælpemidler til at træffe denne bestemmelse er patientens kliniske tilstand og elektrokardiogram. Tidlige kliniske tegn på svær hypokalæmi inkluderer et mønster af irritabel forvirring og forsinkede tankeprocesser.
elektrokardiografisk er alvorlig hypokalæmi ofte forbundet med et forlænget kV-T-interval, udvidelse, udfladning eller inversion af T-bølgen og fremtrædende u-bølger. Der kan også forekomme hjertearytmier, såsom for tidlige atriale, nodale og ventrikulære sammentrækninger og supraventrikulære og ventrikulære takykardier. De toksiske virkninger af digitalis er sandsynligvis overdrevne. Markeret hypokalæmi kan også manifesteres ved svær muskelsvaghed, der til tider strækker sig til ærlig lammelse.
elektrolytforstyrrelser
som alle kationbytterharpikser, Natriumpolystyrensulfonat, er USP ikke helt selektiv (for kalium) i sine handlinger, og små mængder andre kationer såsom magnesium og calcium kan også gå tabt under behandlingen. Derfor bør patienter, der får Natriumpolystyrensulfonat, USP overvåges for alle gældende elektrolytforstyrrelser.
systemisk alkalose
systemisk alkalose er rapporteret, efter at kationbytterharpikser blev administreret oralt i kombination med ikke-absorberbare kationdonerende antacida og afføringsmidler såsom magnesiumhydroksid og aluminiumcarbonat. Magnesium bør ikke administreres sammen med Natriumpolystyrensulfonat, USP. Et tilfælde af grand mal-anfald er rapporteret hos en patient med kronisk hypokalcæmi af nyresvigt, der fik Natriumpolystyrensulfonat, USP med magnesiumhydroksid som afføringsmiddel. (Se forholdsregler, lægemiddelinteraktioner.)
forholdsregler
forsigtighed tilrådes, når Natriumpolystyrensulfonat, USP administreres til patienter, der ikke tåler selv en lille stigning i natriumbelastninger (dvs.svær kongestiv hjertesvigt, svær hypertension eller markeret ødem). I sådanne tilfælde kan kompenserende begrænsning af natriumindtagelse fra andre kilder angives.
i tilfælde af klinisk signifikant forstoppelse, behandling med Natriumpolystyrensulfonat, skal USP seponeres, indtil normal tarmbevægelse genoptages (se advarsler, tarmnekrose).
lægemiddelinteraktioner
antacida
samtidig oral administration af Natriumpolystyrensulfonat, USP med ikke-absorberbar kation-donerende antacida og afføringsmidler kan reducere harpiksens kaliumudvekslingsevne.
ikke-absorberbar kation-donerende antacida og afføringsmidler
systemisk alkalose er rapporteret, efter at kationbytterharpikser blev administreret oralt i kombination med ikke-absorberbar kation-donerende antacida og afføringsmidler såsom magnesiumhydroksid og aluminiumcarbonat. Magnesium bør ikke administreres sammen med Natriumpolystyrensulfonat, USP. Et tilfælde af grand mal-anfald er rapporteret hos en patient med kronisk hypokalcæmi af nyresvigt, der fik Natriumpolystyrensulfonat, USP med magnesiumhydroksid som afføringsmiddel.
Intestinal obstruktion på grund af konkretioner af aluminiumhydroksid, når det anvendes i kombination med Natriumpolystyrensulfonat, er USP rapporteret.
Digitalis
de toksiske virkninger af digitalis på hjertet, især forskellige ventrikulære arytmier og A-V nodal dissociation, vil sandsynligvis blive overdrevet af hypokalæmi, selv i lyset af serumgraoksinkoncentrationer i det “normale interval”. (Se advarsler).
Sorbitol
samtidig brug af Sorbitol med Natriumpolystyrensulfonat, USP er blevet impliceret i tilfælde af tarmnekrose, som kan være dødelig. Samtidig administration anbefales derfor ikke. (Se advarsler).
Lithium
Natriumpolystyrensulfonat, USP kan nedsætte absorptionen af lithium.
Thyroksin
Natriumpolystyrensulfonat, USP kan nedsætte absorptionen af thyroksin.
carcinogenese, mutagenese, nedsat fertilitet
undersøgelser er ikke udført.
graviditetskategori C
dyreproduktionsundersøgelser er ikke udført med Natriumpolystyrensulfonat, USP. Det vides heller ikke, om Natriumpolystyrensulfonat, USP kan forårsage fosterskader, når det administreres til en gravid kvinde eller kan påvirke reproduktionskapaciteten. Natriumpolystyrensulfonat, USP bør kun gives til en gravid kvinde, hvis det er klart nødvendigt.
ammende mødre
det vides ikke, om dette lægemiddel udskilles i modermælk. Fordi mange lægemidler udskilles i modermælk, skal der udvises forsigtighed, når Natriumpolystyrensulfonat, USP administreres til en ammende kvinde.
pædiatrisk anvendelse
effektiviteten af Natriumpolystyrensulfonat, USP hos pædiatriske patienter er ikke fastlagt. Hos nyfødte, Natriumpolystyrensulfonat, bør USP ikke gives oralt. Hos både børn og nyfødte skal der udvises særlig forsigtighed ved rektal administration, da overdreven dosering eller utilstrækkelig fortynding kan resultere i påvirkning af harpiksen.
på grund af risikoen for fordøjelsesblødning eller tarmnekrose, skal der udvises særlig forsigtighed hos premature spædbørn eller spædbørn med lav fødselsvægt.
bivirkninger
Natriumpolystyrensulfonat, USP kan forårsage en vis grad af gastrisk irritation. Anoreksi, kvalme, opkastning og forstoppelse kan forekomme, især hvis der gives høje doser. Der kan også forekomme hypokalæmi, hypokalcæmi, hypomagnesæmi og signifikant natriumretention og deres relaterede kliniske manifestationer (se advarsler). Lejlighedsvis udvikler diarre. Store doser hos ældre kan forårsage fækal påvirkning (se forholdsregler). Sjældne tilfælde af tarmnekrose er blevet rapporteret. Intestinal obstruktion på grund af konkretioner af aluminiumhydroksid, når det anvendes i kombination med Natriumpolystyrensulfonat, USP, er blevet rapporteret.
følgende hændelser er rapporteret fra verdensomspændende erfaring efter markedsføring:
• sjældne tilfælde af akut bronkitis og/eller broncho-lungebetændelse forbundet med indånding af partikler af polystyrensulfonat.
overdosering
overdosering kan medføre elektrolytforstyrrelser, herunder hypokalæmi, hypokalcæmi og hypomagnesæmi .Biokemiske forstyrrelser som følge af overdosering kan give anledning til kliniske tegn og symptomer på hypokalæmi, herunder: irritabilitet, forvirring, forsinkede tankeprocesser, muskelsvaghed, hyporefleksi, som kan udvikle sig til ærlig lammelse og/eller apnø. Tetany kan forekomme. Elektrokardiografiske ændringer kan være i overensstemmelse med hypokalæmi eller hypercalcæmi; hjertearytmier kan forekomme. Der skal træffes passende foranstaltninger for at korrigere serumelektrolytter (kalium, calcium, magnesium), og harpiksen skal fjernes fra fordøjelseskanalen ved passende brug af afføringsmidler eller klyster.
Kaleksat pulver Dosering og Administration
Suspension af dette lægemiddel bør være frisklavet og ikke opbevares ud over 24 timer.
den gennemsnitlige daglige voksne dosis af harpiksen er 15 g til 60 g. Dette tilvejebringes bedst ved indgivelse af 15 g (ca.4 teskefulde) Natriumpolystyrensulfonat, USP en til fire gange dagligt. Et gram Natriumpolystyrensulfonat, USP indeholder 4,1 mekv natrium; en teskefuld indeholder ca. 3,5 g Natriumpolystyrensulfonat, USP og 15 mekv natrium. (En heaping teske kan indeholde så meget som 10 g til 12 g Natriumpolystyrensulfonat, USP.) Da in vivo-effektiviteten af natrium-kaliumbytterharpikser er cirka 33 procent, leveres ca.en tredjedel af harpiksens faktiske natriumindhold til kroppen.
hos mindre børn og spædbørn bør der anvendes lavere doser ved at bruge en hastighed på 1 mekv kalium pr.
hver dosis skal gives som en suspension i en lille mængde vand eller, for større velsmag, i sirup. Mængden af væske varierer normalt fra 20 mL til 100 mL afhængigt af dosis eller kan simpelthen bestemmes ved at tillade 3 mL til 4 mL pr. Sundhedspersonale bør følge de fulde aspirationsforholdsregler ved administration af dette produkt, såsom placering og vedligeholdelse af patienten i opretstående stilling, mens harpiksen administreres.
harpiksen kan indføres i maven gennem et plastrør og om ønsket blandes med en diæt, der er passende for en patient i nyresvigt.
harpiksen kan også gives, skønt med mindre effektive resultater, i en klyster bestående (for voksne) på 30 g til 50 g hver sjette time. Hver dosis administreres som en varm emulsion (ved kropstemperatur) i 100 mL vandigt køretøj. Emulsionen skal omrøres forsigtigt under administration. Enema bør bevares så længe som muligt og efterfølges af en rensende enema.
efter en indledende rensende enema indsættes et blødt, stort (fransk 28) gummirør i endetarmen i en afstand på cirka 20 cm, med spidsen godt ind i sigmoid kolon og tapes på plads. Harpiksen suspenderes derefter i den passende mængde vandigt køretøj ved kropstemperatur og indføres ved tyngdekraften, mens partiklerne holdes i suspension ved omrøring. Suspensionen skylles med 50 mL eller 100 mL væske, hvorefter røret klemmes og efterlades på plads. Hvis der opstår ryglækage, hæves hofterne på puder, eller en knæ-brystposition tages midlertidigt. En noget tykkere suspension kan anvendes, men man skal være opmærksom på, at der ikke dannes nogen pasta, fordi sidstnævnte har en stærkt reduceret udvekslingsoverflade og vil være særlig ineffektiv, hvis den deponeres i den rektale ampulla. Suspensionen opbevares i sigmoid kolon i flere timer, hvis det er muligt. Derefter overrisles tyktarmen med ikke-natriumholdig opløsning ved kropstemperatur for at fjerne harpiksen. To liter skylleopløsning kan være nødvendig. Afkastene drænes konstant gennem en Y-rørforbindelse. Selvom brug af sorbitol ikke anbefales, skal der lægges særlig vægt på denne rensende klyster, hvis sorbitol er blevet brugt
intensiteten og varigheden af behandlingen afhænger af sværhedsgraden og resistensen af hyperkalæmi.
Natriumpolystyrensulfonat, USP bør ikke opvarmes for at gøre det kan ændre harpiksens udvekslingsegenskaber.
hvordan leveres Kaleksatpulver
Natriumpolystyrensulfonat, USP fås som creme til lysebrunt, finmalet pulver i krukker på 1 pund (454 g),
NDC 10702-036-45.
Opbevares ved 20° C til 25°C (68° til 77°F) med udflugter tilladt mellem 15° til 30°C (59° og 86°F) .
kun
fremstillet af:
KVK-TECH INC.
110 Terry Drive
ny by, PA 18940 USA.
vare-ID # 006067/04
producentens kode: 10702 10/13
PAKKEETIKET.PRINCIPAL DISPLAY PANEL
454 g krukke etiket
NDC 10702-036-45
NATRIUMPOLYSTYRENSULFONAT, USP
KATIONBYTTERHARPIKS
454 g
kun rk
gennemsnitlig voksen dosis: 15 g (ca. 4 niveau teskefulde) en til fire gange dagligt i vand. Se fuldstændige ordineringsoplysninger.
effekten skal kontrolleres omhyggeligt ved hyppige serumkaliumbestemmelser inden for hver 24-timers periode. 60 mekv pr. 15 g.
Suspension skal være frisklavet og må ikke opbevares længere end 24 timer. Dispensere i stramme, lysbestandige beholdere som defineret i de officielle kompendier.
Opbevares ved 20° C til 25°C (68° til 77°F) med udflugter tilladt mellem 15° til 30°C (59° og 86°F) .
KVK-TECH, INC.

| KALEXATE sodium polystyrene sulfonate powder |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler-KVK-Tech, Inc. (173360061)
Registrant-KVK-Tech, Inc. (173360061)
| oprettelse | |||
| navn | adresse | ID / FEI | operationer |
| KVK-Tech, Inc. | 173360061 | fremstilling(10702-036) | |
mere om Kaleksat (natriumpolystyrensulfonat)
- bivirkninger
- under graviditet eller amning
- doseringsinformation
- lægemiddelinteraktioner
- prissætning & kuponer
- spansk
- lægemiddelklasse: kationbytterharpikser
- FDA-advarsler (2)
Forbrugerressourcer
- patientinformation
professionelle ressourcer
- ordineringsinformation
- Natriumpolystyrensulfonat Oralt pulver (FDA)
andre mærker Kayeksalat, Kioneks
relaterede behandlingsvejledninger
- hyperkalæmi
medicinsk ansvarsfraskrivelse