doseringsform: aerosol, skum
medicinsk gennemgået af Drugs.com. sidst opdateret den 1. September 2019.
- oversigt
- bivirkninger
- dosering
- professionel
- graviditet
- mere
- indikationer og anvendelse af skum
- Dosering og Administration
- doseringsformer og styrker
- Kontraindikationer
- advarsler og forsigtighedsregler
- Kontaktfølsomhed
- brandfarligt indhold
- systemiske virkninger
- bivirkninger
- kliniske forsøg erfaring
- dermale sikkerhedsundersøgelser
- erfaring efter markedsføring
- anvendelse i specifikke populationer
- graviditet
- amning
- kvinder og mænd med reproduktionspotentiale
- pædiatrisk anvendelse
- geriatrisk anvendelse
- beskrivelse
- Klinisk Farmakologi
- virkningsmekanisme
- farmakodynamik
- farmakokinetik
- Mikrobiologi
- ikke-klinisk Toksikologi
- carcinogenese, mutagenese, nedsat fertilitet
- kliniske studier
- sådan leveres / opbevaring og håndtering
- information om patientrådgivning
- brugsanvisning
- patientinformation
- pakning/etiket HOVEDDISPLAYPANEL – karton
- mere om ketoconasol aktuelt)
- Consumer resources
- Professional resources
- Related treatment guides
indikationer og anvendelse af skum
skum, 2% er indiceret til topisk behandling af seborrheisk dermatitis hos immunkompetente patienter 12 år og ældre.
anvendelsesbegrænsninger
sikkerhed og virkning af Ketoconasolskum, 2% til behandling af svampeinfektioner er ikke fastlagt.
Dosering og Administration
2% skal påføres det eller de berørte områder to gange dagligt i fire uger.
Hold beholderen lodret, og hæld 2% skum i låget på dåsen eller en anden kølig overflade i en mængde, der er tilstrækkelig til at dække det eller de berørte områder. Det anbefales ikke at dispensere direkte på hænderne, da skummet begynder at smelte straks ved kontakt med varm hud. Saml små mængder skum op, 2% med fingerspidserne, og masser forsigtigt ind i det eller de berørte områder, indtil skummet forsvinder. For hårbærende områder skal du dele håret, så 2% kan påføres direkte på huden (snarere end på håret).
undgå kontakt med øjne og andre slimhinder. 2% er ikke til oftalmisk, oral eller intravaginal brug.
doseringsformer og styrker
2% indeholder 20 mg USP pr.gram, leveret i 50 g og 100 g beholdere.
Kontraindikationer
Ingen.
advarsler og forsigtighedsregler
Kontaktfølsomhed
2% kan resultere i kontaktfølsomhed, inklusive fotoallergenicitet.
brandfarligt indhold
indholdet af skum, 2% omfatter alkohol og propan/butan, som er brandfarlige. Undgå brand, flamme og/eller rygning under og umiddelbart efter påføring. Du må ikke punktere og/eller forbrænde beholderne. Beholdere må ikke opvarmes og/eller opbevares ved temperaturer over 120 liter F (49 liter C).
systemiske virkninger
Hepatitis er set ved oral administration (1:10.000 rapporteret incidens). Nedsat testosteron og ACTH–induceret kortikosteroid serumniveauer er set ved høje doser oralt administreret ketoconasol. Disse virkninger er ikke set med topisk.
bivirkninger
kliniske forsøg erfaring
da kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningshastigheder observeret i de kliniske forsøg med et lægemiddel ikke sammenlignes direkte med hyppigheden i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de hastigheder, der er observeret i praksis. Bivirkningsoplysningerne fra kliniske forsøg giver dog grundlag for at identificere de bivirkninger, der synes at være relateret til stofbrug, og for at tilnærme rater.
sikkerhedsdataene i tabel 1 afspejler eksponering for skum, 2% hos 672 personer, 12 år og ældre med seborrheisk dermatitis. Emner anvendt Ketoconasolskum, 2% eller køretøjsskum to gange dagligt i 4 uger til berørte områder i ansigt, hovedbund og/eller bryst. Bivirkninger, der forekommer hos > 1% af forsøgspersonerne, er vist i tabel 1.
tabel 1: Bivirkninger rapporteret af >1% forsøgspersoner i kliniske forsøg
|
bivirkninger |
2% N=672 n (%) |
køretøj skum N=497 n (%) |
|
personer med en bivirkning |
188 (28%) |
122 (25%) |
|
forbrænding på applikationsstedet |
67 (10%) |
49 (10%) |
|
reaktion på applikationsstedet |
41 (6%) |
24 (5%) |
reaktioner på applikationsstedet, som blev rapporteret hos < 1% af forsøgspersonerne, var tørhed, erytem, irritation, paræstesi, kløe, udslæt og varme.
dermale sikkerhedsundersøgelser
i et fotoallergenicitetsstudie havde 9 af 53 forsøgspersoner (17%) reaktioner i udfordringsperioden på både de bestrålede og ikke-bestrålede steder behandlet med Ketoconasolskum, 2%. 2% Kan forårsage kontaktfølsomhed.
erfaring efter markedsføring
følgende bivirkninger er blevet identificeret ved brug af skum efter markedsføring, 2%:
mave-tarm-kanalen: Cheilitis
Almene symptomer og reaktioner på administrationsstedet: smerter på applikationsstedet og forbrænding på applikationsstedet
hud og subkutane væv: Hudforbrændingsfølelse og erytem
da disse hændelser rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng med lægemiddeleksponering.
anvendelse i specifikke populationer
graviditet
Risikosammendrag
der er ingen tilgængelige data om anvendelse hos gravide kvinder til at identificere en lægemiddelassocieret risiko for større fødselsdefekter, spontanabort eller ugunstige maternelle eller føtale resultater. Der er ikke udført reproduktionsundersøgelser hos dyr med 2% skum. I reproduktionsstudier med drægtige mus, rotter og kaniner blev der observeret både embryotoksiske og udviklingsmæssige virkninger (strukturelle abnormaliteter) efter oral dosering af ketoconasol under organogenese. 2% maksimal anbefalet human dosis (MRHD) på 8 gram (svarende til 160 mg), embryotoksiske virkninger blev observeret ved 0,8 til 2,4 gange MRHD og udviklingseffekter blev observeret ved 4.8 gange MRHD .
baggrundsrisikoen for større fødselsdefekter og abort for den angivne population er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekt, tab, eller andre negative resultater. I den amerikanske befolkning er den estimerede baggrundsrisiko for større fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 til 4% og 15 til 20%.
Data
Dyredata
dyremultiplerne af humane eksponeringsberegninger er baseret på sammenligninger af legemsoverfladeareal (BSA) af orale doser administreret til dyr og et Ketoconasolskum, 2% maksimal anbefalet human dosis (MRHD) på 8 gram (svarende til 2, 67 mg ketoconasol/kg/dag for en person på 60 kg eller 98, 8 mg ketoconasol/m2/dag).
Embryofetaludviklingsundersøgelser er blevet udført på mus, rotter og kaniner med oralt administreret ketoconasol. Ved oral administration til mus på gestationsdage 6 til 18 (dækker perioden for organogenese) var embryotoksisk (25 mg/kg og højere; 0,8 gange MRHD baseret på BSA-sammenligninger) med en høj forekomst af resorptioner, øget antal dødfødsler og forsinket fødsel. Forsinkelser i modning blev også observeret. Der var ingen tegn på maternel toksicitet eller misdannelser ved op til 50 mg/kg (1, 5 gange MRHD baseret på BSA-sammenligninger). Der blev ikke observeret behandlingsrelaterede udviklingseffekter ved 10 mg / kg (0, 3 gange MRHD baseret på BSA-sammenligninger).
i nærvær af maternel toksicitet hos rotter var oralt administreret både embryotoksisk (40 mg/kg og højere; 2,4 gange MRHD baseret på BSA-sammenligninger), inklusive øgede resorberede fostre og dødfødsler og teratogen (80 mg/kg og højere; 4,8 gange MRHD baseret på BSA-sammenligninger), inklusive syndactylia, oligodactylia, viftede ribben og ganespalte. Derudover var 100 mg/kg (6 gange MRHD baseret på BSA-sammenligninger) oralt administreret på en enkelt dag under drægtighed (svangerskabsdage 9 til 12) embryotoksisk (øgede resorptioner). Den samme orale dosis givet på drægtighedsdag 12, 13, 14 eller 15 inducerede eksterne misdannelser inklusive ganespalte, mikromeli og digitale anomalier (brachydactyly, ectrodactyly, syndactyly).
hos drægtige kaniner blev der observeret tegn på embryotoksicitet (øget resorption) ved 10 mg/kg (1, 2 gange MRHD baseret på BSA-sammenligninger) og højere, og en øget forekomst af skeletabnormiteter blev observeret ved 40 mg/kg (4, 8 gange MRHD baseret på BSA-sammenligninger).
amning
Risikooversigt
der foreligger ingen oplysninger om forekomsten af ketoconasol i modermælk eller virkningerne på det ammede barn eller virkningerne på mælkeproduktionen efter topisk påføring af Ketoconasolskum, 2% til kvinder, der ammer. I dyreforsøg blev ketoconasol fundet i mælk efter oral administration. De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for Ketoconasolskum, 2% og eventuelle potentielle bivirkninger på det ammede spædbarn fra Ketoconasolskum, 2% eller fra den underliggende maternelle tilstand.
kvinder og mænd med reproduktionspotentiale
infertilitet
i fertilitetsstudier med rotter og hunde resulterede administration af orale doser af ketoconase mellem 3-dages og 3-måneders perioder i infertilitet, der var reversibel .
pædiatrisk anvendelse
sikkerheden og effektiviteten af Ketoconasolskum, 2% hos pædiatriske patienter under 12 år er ikke fastlagt.
af de 672 forsøgspersoner, der blev behandlet med skum, var 2% i de kliniske forsøg 44 (7%) fra 12 til 17 år. .
geriatrisk anvendelse
af de 672 forsøgspersoner, der blev behandlet med Ketoconasolskum, var 2% i de kliniske forsøg 107 (16%) 65 år og derover.
kliniske forsøg med 2% inkluderede ikke tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de responderede anderledes end yngre forsøgspersoner.
beskrivelse
skum, 2% indeholder 2% USP, et antisvampemiddel, i et termolabilt hydroethanolisk skum til topisk påføring.
det kemiske navn er piperasin, 1-acetyl-4-phenyl] -, cis – med molekylformlen C26H28CI2N4O4 og en molekylvægt på 531,43.
følgende er den kemiske struktur:
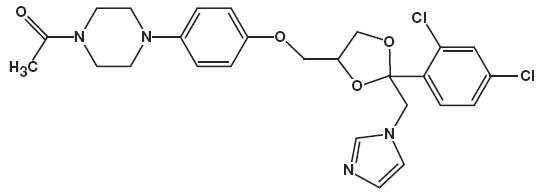
2% indeholder 20 mg hydroethanolskum pr. gram i et termolabilt hydroethanolskumkøretøj bestående af cetylalkohol, citronsyre, ethanol (denatureret med tert-butylalkohol og brucinsulfat) 58%, polysorbat 60, kaliumcitrat, propylenglycol, renset vand og stearylalkohol under tryk med et carbonhydrid (propan/butan) drivmiddel.
Klinisk Farmakologi
virkningsmekanisme
virkningsmekanismen for seborrheic dermatitis er ikke kendt.
farmakodynamik
farmakodynamikken af Ketoconasolskum, 2% er ikke fastlagt.
farmakokinetik
i en biotilgængelighedsundersøgelse påførte 12 personer med moderat til svær seborrheisk dermatitis 3 g Ketoconasolskum, 2% to gange dagligt i 4 uger. 250> 6 ng/mL for et flertal af forsøgspersoner (75%) med et maksimalt niveau på 11 ng/mL observeret hos et individ.
Mikrobiologi
er et antifungalt middel, der hæmmer in vitro-syntesen af ergosterol, en nøglesterol i cellemembranen af malassesia furfur. Den kliniske betydning af antifungal aktivitet i behandlingen af seborrheisk dermatitis er ikke kendt.
ikke-klinisk Toksikologi
carcinogenese, mutagenese, nedsat fertilitet
Langtids dyreforsøg er ikke udført for at evaluere det kræftfremkaldende eller foto-karcinogene potentiale af Ketoconasolskum, 2%.
i karcinogenicitetsstudier med orale mus (18 måneder) og rotter (24 måneder) ved dosisniveauer på 5, 20 og 80 mg/kg/dag var det ikke karcinogent. 2, 4 til 4, 8 gange MRHD baseret på BSA-sammenligninger. I en bakteriel revers mutationsanalyse udtrykte ketoconasol ikke noget mutagent potentiale. I tre In vivo-analyser (søsterkromatidudveksling hos mennesker, dominerende dødelige og mikronukleustest hos mus) udviste ketokonasol ikke noget genotoksisk potentiale.
i fertilitetsstudier hos dyr nedsatte oral ketoconase både fertiliteten hos han-og hunrotter på en dosis-og varighedsafhængig måde. Hos kvinder havde orale doser på op til 40 mg/kg (2, 4 gange MRHD baseret på BSA-sammenligninger) ingen effekt på fertiliteten, mens doser på 75 mg/kg (4, 5 gange MRHD baseret på BSA-sammenligninger) og højere nedsatte graviditetsraten og antallet af implantationssteder. Hos hanrotter nedsatte oral dosering ved 200 mg/kg/dag (12 gange mrhd baseret på BSA-sammenligninger) i tre dage fertiliteten, og 400 mg/kg/dag (24 gange MRHD baseret på BSA-sammenligninger) i tre dage resulterede i et fuldstændigt tab af fertilitet. Ved administration i længere tid (op til 3 måneder) blev nedsat fertilitet hos hanrotter observeret ved doser så lave som 24 mg/kg/dag (1, 4 gange MRHD baseret på BSA-sammenligninger). En oral dosis på 25 mg/kg / dag i op til 4 uger (5.2 gange MRHD baseret på BSA-sammenligninger) resulterede i nedsat sædmotilitet, nedsat sædantal, øget unormal sæd og atrofi af testiklerne. Disse virkninger blev vendt efter seponering af behandlingen.
kliniske studier
sikkerheden og effekten af Ketoconasolskum, 2% blev evalueret i et randomiseret, dobbeltblindt, køretøjskontrolleret forsøg hos forsøgspersoner 12 år og ældre med mild til svær seborrheisk dermatitis. I forsøget modtog 427 forsøgspersoner skum, 2% og 420 forsøgspersoner fik køretøjsskum. Emner anvendt Ketoconasolskum, 2% eller køretøjsskum to gange dagligt i 4 uger til berørte områder i ansigt, hovedbund og/eller bryst. Den samlede sygdommens sværhedsgrad med hensyn til erytem, skalering og induration blev vurderet ved Baseline og uge 4 på en 5-punkts investigators statiske globale vurdering (ISGA) skala.
behandlingssucces blev defineret som opnåelse af en uge 4 (Afslutning af behandlingen) ISGA-score på 0 (klar) eller 1 (størstedelen af læsioner har individuelle score for skalering, erytem og induration, der i gennemsnit er 1 ) og mindst to forbedringsgrader fra baseline. Resultaterne er vist i tabel 2. Databasen var ikke stor nok til at vurdere, om der var forskelle i effekter i alder, køn eller race undergrupper.
tabel 2: Effektresultater
|
antal emner |
2% N = 427 n (%) |
køretøj skum N = 420 n (%) |
|
emner, der opnår behandlingssucces |
239 (56%) |
176 (42%) |
sådan leveres / opbevaring og håndtering
2% indeholder 20 mg USP pr.gram. Det termolabile hydroethanoliske skum fås som følger:
NDC 45802-532-32
50 g aluminiumsbeholder
NDC 45802-532-33
100 g aluminiumsbeholder
opbevares ved 20 liter til 25 liter C (68 Til 77 til f). .
må ikke opbevares i køleskab.
indholdet er brandfarligt. Beholdere må ikke opvarmes og/eller opbevares ved temperaturer over 49 liter C (120 liter F). Må ikke opbevares i direkte sollys.
indhold under tryk. Beholderen må ikke punkteres og/eller forbrændes.
opbevares utilgængeligt for børn.
information om patientrådgivning
se FDA-godkendt patientmærkning (Patientpakningsindsats).
Instruer patienter om korrekt brug af Ketoconasolskum, 2%.
• undgå brand, flamme og/eller rygning under og umiddelbart efter påføring. * Anvend ikke Ketoconasolskum, 2% direkte på hænderne. Dispensere på en kølig overflade, og gælder for de berørte områder ved hjælp af fingerspidserne. 2% Kan forårsage hudirritation (forbrænding på applikationsstedet og/eller reaktioner) • Instruer en patient om at kontakte en sundhedsudbyder, hvis applikationsområdet viser tegn på øget irritation og rapportere tegn på bivirkninger.
Made in Israel
Manufactured By Perrigo
Yeruham, Israel
distribueret af
Perrigo Krit
Allegan, MI 49010
Første Verdenskrig.perrigo.com
Rev 08-18
5k200rcj3
brugsanvisning
skum, 2%
vigtig Information: skum, 2% er kun til brug på huden. Brug ikke skum, 2% i dine øjne, mund eller vagina.
Trin 1: Fjern den klare hætte fra skummet, 2% dåse.
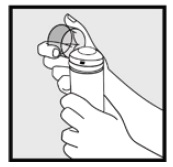
Trin 2: Hold dåsen lodret, og tryk let på dysen for at dispensere skum, 2% i den klare hætte. 2% til at dække hele det eller de berørte områder.
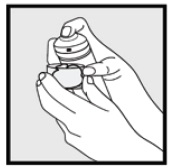
• hvis dåsen virker varm, eller skummet virker løbende, skal du køre dåsen under koldt vand.
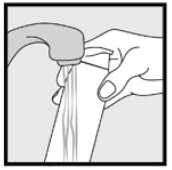
Trin 3: Saml små mængder Ketoconasolskum op, 2% med fingerspidserne, og gnid forsigtigt skummet ind i det eller de berørte områder, indtil skummet forsvinder.
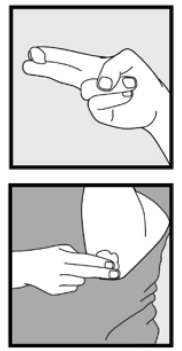
• hvis du behandler områder som din hovedbund, skal du dele håret, så 2% kan påføres direkte på huden.

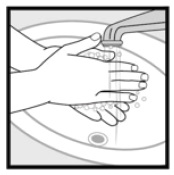
Trin 4: Vask dine hænder efter påføring af Ketoconasolskum, 2%. * Smid noget af den ubrugte medicin, der er tilbage i hætten.
hvordan skal jeg opbevare Ketoconasol skum, 2%?
* Opbevar skum, 2% ved stuetemperatur mellem 68 g F til 77 g F (20 g C til 25 g c). * Opbevar ikke skummet, 2% dåse i køleskabet eller fryseren. * Hold skum, 2% væk fra varmen. Kast aldrig dåsen i brand, selvom dåsen er tom. * Opbevar ikke skum, 2% ved temperaturer over 120 kg F (49 kg C). * Bryd ikke igennem (punktering) Ketoconasolskummet, 2% kan.
Opbevar skum, 2% og al medicin utilgængeligt for børn.
denne brugsanvisning er godkendt af US Food and Drug Administration.
kun
fremstillet i Israel
fremstillet af Perrigo
Yeruham, Israel
distribueret af
Perrigo kar
Allegan, MI 49010
www.perrigo.com
Rev 08-18
patientinformation
2%
vigtig Information: 2% er kun til brug på huden. Brug ikke skum, 2% i dine øjne, mund eller vagina.
hvad er skum, 2%?
2% er en receptpligtig medicin, der anvendes på huden (topisk) til behandling af seborrheisk dermatitis hos mennesker 12 år og ældre med et normalt immunsystem.
det vides ikke, om 2% er sikkert og effektivt, når det bruges til behandling af svampeinfektioner.
det vides ikke, om 2% er sikkert og effektivt hos børn under 12 år.
før du bruger 2%, skal du fortælle din læge om alle dine medicinske tilstande, herunder hvis du:
• er gravid eller planlægger at blive gravid. Det vides ikke, om 2% vil skade dit ufødte barn. * ammer eller planlægger at amme. Det vides ikke, om 2% går over i modermælken. Tal med din sundhedsudbyder om den bedste måde at fodre din baby på under behandling med Ketoconasolskum, 2%.
Fortæl din læge om alle de lægemidler, du tager, herunder receptpligtig og over-the-counter medicin, vitaminer og naturlægemidler kosttilskud.
hvordan skal jeg bruge skum, 2%?
* brug skumplast, 2% nøjagtigt som din læge fortæller dig at bruge det. Se den detaljerede” brugsanvisning ” i slutningen af denne indlægsseddel for instruktioner om, hvordan du påfører Ketoconasolskum, 2% på den rigtige måde. 2% på det eller de berørte hudområder 2 gange hver dag i 4 uger. Du skal anvende nok skum, 2% til at dække hele det eller de berørte områder. * Tal med din læge, hvis din hud ikke forbedres efter 4 ugers behandling med 2%. 2% direkte i hætten. 2% direkte på dine hænder, fordi skummet begynder at smelte ved kontakt med varm hud. * Vask dine hænder efter påføring af Ketoconasolskum, 2%.
hvad skal jeg undgå, når jeg bruger 2% skum?
* 2% er brandfarligt. Undgå brand, flammer eller rygning under og lige efter påføring af skum, 2% på din hud. * Undgå at få 2% skum i eller i nærheden af dine øjne, mund, læber eller vagina. 2% på dine læber eller i dine øjne, mund eller vagina, skylles godt med vand.
hvad er de mulige bivirkninger af Ketoconasolskum, 2%?
2% Kan forårsage alvorlige bivirkninger, herunder:
• hudirritation på applikationsområdet / – områderne, herunder hudreaktioner forårsaget af udsættelse for lys. Fortæl det til din læge, hvis du udvikler hudirritation under behandling med 2%.
de mest almindelige bivirkninger af Ketoconasolskum, 2% omfatter brænding, tørhed, rødme, irritation, følelsesløshed, kløe, udslæt og varme på applikationsstedet.
dette er ikke alle de mulige bivirkninger af Ketoconasolskum, 2%.
ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
hvordan skal jeg opbevare skum, 2%?
* Opbevar skum, 2% ved stuetemperatur mellem 68 g F til 77 g F (20 g C til 25 g c). * Opbevar ikke skummet, 2% dåse i køleskabet eller fryseren. * Hold skum, 2% væk fra varmen. Kast aldrig skummet, 2% dåse i brand, selvom dåsen er tom. * Opbevar ikke skum, 2% ved temperaturer over 120 kg F (49 kg C). * Bryd ikke igennem (punktering) Ketoconasolskummet, 2% kan. Opbevar Ketoconol skum, 2% og al medicin utilgængeligt for børn.
Generelle oplysninger om sikker og effektiv anvendelse af Ketoconasolskum, 2%.
lægemidler ordineres undertiden til andre formål end dem, der er anført i en indlægsseddel. Brug ikke Ketoconasolskum, 2% til en tilstand, som det ikke var ordineret til. Giv ikke skum, 2% til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem. Du kan bede din farmaceut eller sundhedsudbyder om oplysninger om Ketoconasolskum, 2%, der er skrevet til sundhedspersonale.
hvad er ingredienserne i skum, 2%?
aktiv ingrediens: Ketoconasol
inaktive ingredienser: cetylalkohol, citronsyre, ethanol (denatureret med tert-butylalkohol og brucinsulfat) 58%, polysorbat 60, kaliumcitrat, propylenglycol, renset vand og stearylalkohol under tryk med et kulbrinte (propan/butan) drivmiddel
for mere information, ring til Perrigo på 1-866-634-9120
denne indlægsseddel er godkendt af Udvalget for U. S. Food and Drug Administration.
pakning/etiket HOVEDDISPLAYPANEL – karton
kun rk
skum, 2%
kun til topisk brug.
ikke til oftalmisk, Oral eller Intravaginal brug.
100 g

følgende billede er en pladsholder, der repræsenterer produktidentifikatoren, der enten er anbragt eller præget på lægemiddelpakkens etiket under emballagen.

| aerosol, skum | ||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
Labeler-Perrigo Danmark Inc (078846912)
mere om ketoconasol aktuelt)
- bivirkninger
- under graviditet eller amning
- doseringsinformation
- Sammenlign alternativer
- prisfastsættelse & kuponer
- spansk
- 36 anmeldelser
- lægemiddelklasse: topical antifungals
Consumer resources
- Patient Information
- Ketoconazole Topical (Advanced Reading)
Professional resources
- Prescribing Information
- Ketoconazole (Topical) (Professional Patient Advice)
- Ketoconazole Cream (FDA)
- Ketoconazole Shampoo (FDA)
Other brands Nizoral Shampoo, Ketodan, Extina, Xolegel
Related treatment guides
- Seborrheic Dermatitis
- Cutaneous Candidiasis
- Androgenetic Alopecia
- Dandruff
- … + 4 mere
medicinsk ansvarsfraskrivelse