| Autor | Zugehörigkeit |
|---|---|
| Lindsay A. Weiner, MD | Medizinisches Zentrum der Universität von Maryland, Baltimore, Maryland |
| George Willis, MD | Medizinische Fakultät der Universität von Maryland, Abteilung für Notfallmedizin, Baltimore, Maryland |
| Zachary D.W. Dezman, MD, MS, MS | Medizinische Fakultät der Universität von Maryland, Abteilung für Notfallmedizin, Baltimore, Maryland |
| Katrin J. Bontempo, MD, MEd | Medizinische Fakultät der Universität von Maryland, Abteilung für Notfallmedizin, Baltimore, Maryland |
Fall präsentation
Fall diskussion
Fall ergebnis
Resident diskussion
Endgültige diagnose
Schlüssel lehre punkte
FALL PRÄSENTATION
EINE 52-jährige frau kam zu die emergency department (ED) für hämodialyse (HD) aufgrund von end-stage renal disease (ESRD). Sie hatte die vorangegangenen Wochen in einem externen Krankenhaus verbracht, das wegen Lungenentzündung und Bakteriämie mit Daptomycin behandelt wurde. Anschließend verließ sie gegen ärztlichen Rat (AMA), nachdem ihr Dialysezugangskatheter entfernt worden war. Sie stellte sich unserer ED vor, weil sie eine HD-Gefäßzugangsplatzierung und eine erneute Einleitung von Dialysebehandlungen benötigte. Ihre Krankengeschichte umfasste chronische Nierenerkrankungen infolge hypertensiver Nephrosklerose, Anämie, Bluthochdruck, tiefe Venenthrombosen (TVT), systemischer Lupus erythematodes und eine Anfallserkrankung unbekannter Ätiologie.
Der Patient, ein Zeuge Jehovas, lehnte Bluttransfusionen ab; daher wurde ihre Anämie mit intravenöser (IV) Verabreichung von Eisen, Epoetin alfa und Folsäure behandelt. Andere Medikamente enthalten Nifedipin, Clonidin, Metoprolol, Sevelamer und Prednison. Sie war allergisch gegen Amoxicillin, Azithromycin, Hydralazin, Labetolol, Linezolid, Morphin und Vancomycin. Sie berichtete über früheren IV-Heroinkonsum viele Jahre zuvor und vorheriges Zigarettenrauchen. Sie bestritt den Alkoholkonsum oder den aktuellen Drogen- oder Tabakkonsum.
Bei ihrer Ankunft war sie wachsam und in keiner akuten Notlage mit einem Fieber von 38.3 ° Celsius, Herzfrequenz von 87 Schlägen pro Minute (bpm), Blutdruck von 110/65 Millimeter Quecksilber (mmHg), Atemfrequenz von 17 Atemzügen pro Minute und Pulsoximetrie von 99% beim Einatmen von Raumluft. Sie wog 80 Kilogramm und war 5 Füße 6 Zoll groß. Ihr Kopf war normozephal und atraumatisch mit feuchten Schleimhäuten. Die Schüler waren anikterisch, gleich, rund und reagierten auf Licht und Akkommodation. Der Hals war geschmeidig und ohne Lymphadenopathie oder Zärtlichkeit. Ihre Lungen hatten grobe Atemgeräusche mit milden bibasilären Knistern, aber kein Keuchen oder Rhonchi. Es gab keine Retraktionen oder erhöhte Atemarbeit. Ihr Herz war von regelmäßiger Rate und Rhythmus ohne Murmeln, reibt, oder galoppiert. Ihr Bauch war weich mit normalen Darmgeräuschen und ohne Dehnung, Zärtlichkeit, Rückprall oder Bewachung. Es gab keine costovertebrale Winkelempfindlichkeit. Die unteren Extremitäten hatten 1 + Lochfraßödem, 2+ Dorsalis pedis Impulse und waren ohne Empfindlichkeit oder Deformität. Der Patient hatte normale Kraft und Muskeltonus in allen Extremitäten mit intaktem Gefühl. Alte Fisteln waren in den linken und rechten oberen Extremitäten ohne spürbaren Nervenkitzel vorhanden. Sie war wachsam und orientierte sich an Person, Ort und Zeit.
Die anfänglichen Laborwerte des Patienten sind in Tabelle 1 aufgeführt. Diese waren signifikant für eine leichte Leukozytose, Anämie bis 5,3 g / dl, Thrombozytopenie, Hyperkaliämie und ein erhöhtes Kreatinin von 11,9 mg /dl. Ihr erstes Elektrokardiogramm (EKG) zeigte eine Sinustachykardie mit T-Wellen-Inversionen in den Ableitungen I und V6 (Bild 1). Dies war gegenüber einem früheren EKG unverändert. Der Patient wurde in das Medizinteam aufgenommen und mit Daptomycin begonnen. Während des Wartens auf die Platzierung des Bettes wurde ein nicht getunnelter linker Femur-Dialysekatheter von der medizinischen Intensivstation (ICU) zur Einleitung der Huntington-Krankheit eingeführt. Die Platzierung wurde durch den leichten Blutfluss aus allen Ports bestätigt. Während des Zustimmungsprozesses für die Katheterplatzierung wurde dokumentiert, dass die Patientin angab, „lieber zu sterben als Bluttransfusionen zu erhalten.“ Nach der Katheterplatzierung wurde versucht, die Huntington-Krankheit zu starten, aber sie wurde blutdrucksenkend und klagte fast sofort über Schwäche. Ihre Vitalfunktionen während des ersten Huntington-Versuchs waren ein Blutdruck von 85/56 mmHg mit einer Herzfrequenz von 105 Schlägen pro Minute.
| Werte | |
|---|---|
| Vollständige Anzahl der Blutkörperchen | |
| Anzahl der weißen Blutkörperchen | 12,4 K / mcl |
| Hämoglobin | 5,3 g/dl |
| Hämatokrit | 15.8% |
| Platelets | 133 K/mcl |
| Basic metabolic panel | |
| Sodium | 135 mmol/L |
| Potassium | 5.8 mmol/L |
| Chloride | 99 mmol/L |
| Bicarbonate | 27 mmol/L |
| Blood urea nitrogen | 56 mg/dL |
| Creatinine | 11.9 mg/dL |
| Glucose | 189 mg/dL |
| Calcium | 7.2 mg/dl |
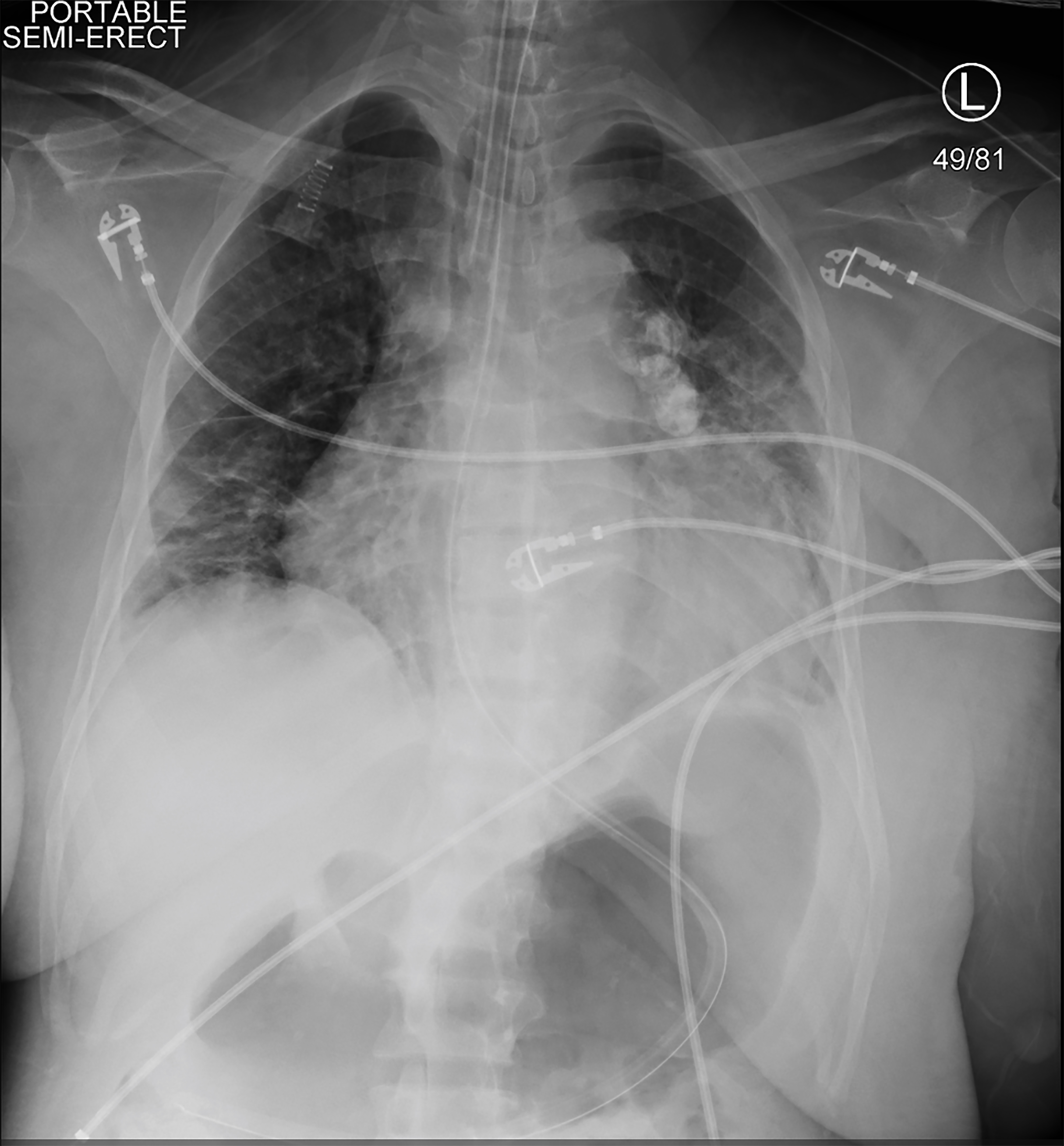
Da der Patient während der Huntington-Krankheit symptomatisch und blutdrucksenkend war, wurde eine kontinuierliche Nierenersatztherapie (CRRT) eingeleitet. Kurz darauf wurde sie blutdrucksenkend, reagierte nicht mehr und hatte einen tonischen klonischen Anfall. Vitalfunktionen zu dieser Zeit waren eine Herzfrequenz von 113 Schlägen pro Minute, ein Blutdruck von 75/48 mmHg, eine Atemfrequenz von 20 Atemzügen pro Minute und eine Sauerstoffsättigung von 78% der Raumluft. Eine kurze, wiederholte körperliche Untersuchung zeigte, dass die Patientin nicht auf schmerzhafte Reize reagierte und ihre Pupillen gleich und reaktiv waren. Sie erhielt 4 mg Lorazepam und intubierte zum Schutz der Atemwege. Eine rechte arterielle Femurlinie und eine rechte femorale dreilumige venöse Mittellinie wurden platziert. Eine Röntgenaufnahme des Brustkorbs bestätigte die Platzierung des Endotrachealtubus (Bild 2). CRRT wurde gestoppt, aber der Patient blieb trotz Bolusinfusionen von Kristalloid unter Schock, so dass Vasopressoren gestartet wurden. Sie erhielt eskalierende Dosen von Vasopressoren, wenn wiederholte Laborwerte ein Hämoglobin von 1,6 g / dl anzeigten (Tabelle 2).
| Values (prior value) | |
|---|---|
| Complete blood cell count | |
| White blood cell count | 13.4 K/mcl (12.4 K/mcl) |
| Hemoglobin | 1.6 g/dL (5.3 g/dL) |
| Hematocrit | 5.7% (15.8%) |
| Platelets | 167 K/mcl (133K/mcl) |
| Complete metabolic panel | |
| Sodium | 131 mmol/L |
| Potassium | 6.7 mmol/L |
| Chloride | 99 mmol/L |
| Bicarbonate | 14 mmol/L |
| Blood urea nitrogen | 56 mg/dL |
| Creatinine | 11.9 mg/dL |
| Glucose | 169 mg/dL |
| Alanine aminotransferase | 23 u/L |
| Aspartate aminotransferase | 31 u/L |
| Alkaline phosphatase | 145 u/L |
| Total bilirubin | 0.4 mg/dl |
| Gesamtprotein | 5,8 g/dl |
| Albumin | 3,2 g/dl |
| Laktat | 15 u/l |
| Arterielles Blutgas | |
| pH-Wert | 7.23 |
| PCO2 | 28 mmHg |
| PO2 | 214 mmHg |
Kurz darauf kam es zu einem Herzstillstand mit einem Rhythmus pulsloser elektrischer Aktivität (PEA). Die Rückkehr der spontanen Zirkulation wurde nach sechs Minuten kardiopulmonaler Reanimation erreicht. Während der Reanimation wurde eine erhöhte Bauchdehnung festgestellt, daher wurde ein drucksensorischer Harnkatheter eingeführt. Ihr maximaler Atemwegs- und Blasendruck wurde bei mehr als 60 cmH2O bzw. 50 mmHg gemessen. Chirurgie wurde dann konsultiert. Ein massives Transfusionsprotokoll wurde eingeleitet, nachdem ihre nächsten Angehörigen zugestimmt hatten, die Transfusion von Blutprodukten zuzulassen. Eine fokussierte Beurteilung mit Sonographie für Trauma (FAST) wurde durchgeführt und zeigte freie Flüssigkeit in Morrisons Beutel. Als die Wiederbelebungsmaßnahmen fortgesetzt wurden, wurde eine zusätzliche Studie durchgeführt und eine Diagnose gestellt.
FALLDISKUSSION
Dieser Fall präsentierte eine einzigartige und umständliche Abfolge von Ereignissen, die sich sehr schnell in eine unglückliche Richtung drehten. Bei Patienten mit vagen oder minimalen Beschwerden ist es Aufgabe der Anbieter, nach Hinweisen zu suchen, um die Diagnose zu erleichtern. Daher begann ich mit der Suche nach den Hinweisen in diesem Fall.
Der Patient zeigte eine Hauptbeschwerde über die Notwendigkeit einer Dialyse. Sie war kürzlich in eine andere Einrichtung wegen Lungenentzündung und Bakteriämie eingeliefert worden und hatte ihren HD-Katheter wegen des Verdachts auf Liniensepsis entfernen lassen. Sie hat AMA von dieser Einrichtung abgemeldet, nachdem sie Daptomycin erhalten hatte. Es ist nicht bekannt, wie lange sie ohne HUNTINGTON war oder ob sie ihren Antibiotikakurs vor ihrer Abreise beendet hatte. Sie ist jedoch im Wesentlichen asymptomatisch.
Ihre vergangenheit medizinische geschichte ist bemerkenswert für anfälle sowie DVTs und anämie. Es gibt keine Erwähnung von Antikoagulanzien oder Antiepileptika, was darauf hindeutet, dass sie sich entweder nicht an die Namen ihrer Medikamente erinnerte oder keine einnahm. Bemerkenswert ist, dass sie Zeugin Jehovas ist und daher alternative Therapien für ihre Anämie erhielt, einschließlich Eisen, Folsäure und Epogen.
Ihre körperliche Untersuchung zeigt, dass sie fieberhaft ist, aber ansonsten stabile Vitalfunktionen aufweist. Ich würde dies erwarten, wenn man bedenkt, dass sie die andere Einrichtung verlassen hatte und wahrscheinlich ihren Antibiotikakurs wegen ihrer Lungenentzündung und Bakteriämie nicht beendet hatte. Andere Möglichkeiten sind eine gegen das Antibiotikum resistente Infektion oder eine neu erworbene nosokomiale Infektion aus ihrem früheren Krankenhausaufenthalt. Sie hat einige grobe Atemgeräusche und bibasilar knistert auf ihrer Lungenuntersuchung, die ihre Lungenentzündung Geschichte bestätigt. Die Lungenentzündung ist höchstwahrscheinlich die Quelle ihres Fiebers sowie der Bakteriämie, die möglicherweise keine Symptome aufweist.
Ihre Laboruntersuchungen ergaben einige relevante Befunde. Sie war sowohl anämisch als auch hyperkaliämisch. Sie war auch hypokalzämisch und hyperphosphatämisch. Sie hatte auch eine leichte Urämie. Die meisten dieser Befunde wären bei einem ESRD-Patienten etwas zu erwarten. Die Anämie kann das Ergebnis einer Nierenerkrankung sein. Andere Möglichkeiten zur Differentialdiagnose von Anämie sind Blutungen, Eisenmangel und Folatmangel. Sie klagt weder über Blutverlust noch über die Indizes der roten Blutkörperchen wie das mittlere Korpuskularvolumen, um diese alternativen Diagnosen an dieser Stelle stellen zu können. Ihre Hyperkaliämie ist höchstwahrscheinlich auf ihren Mangel an HD zurückzuführen. Ihre Hyperphosphatämie ist höchstwahrscheinlich auch auf einen Mangel an HD zurückzuführen; Daptomycin kann jedoch auch Hyperphosphatämie verursachen.
Während sie auf die Bettenplatzierung wartet, hat sie die Huntington-Krankheit begonnen, bei der sie sich über ein schwaches Gefühl beschwert und blutdrucksenkend und tachykard wird. Sie hat dann CRRT initiiert und bleibt blutdrucksenkend, wird hypoxisch, reagiert nicht und hat einen tonisch-klonischen Anfall, der Intubation und Vasopressorinitiierung erfordert. Die Untersuchung zeigt gleiche und reaktive Pupillen bei einem Patienten, der nicht auf schmerzhafte Reize reagiert. Laboruntersuchungen zeigen eine sich stark verschlechternde Anämie, eine sich verschlechternde Hyperkaliämie und die Entwicklung einer Laktatazidose. Sie geht dann in einen Herzstillstand und lässt sich nach erfolgreicher Rückkehr des spontanen Kreislaufs Blut transfundieren. Sie ist jedoch trotz Intubation immer noch blutdrucksenkend und hypoxisch. Sie hat auch einen aufgeblähten Bauch und einen maximalen Atemwegsdruck von mehr als 60 cmH2O. Eine SCHNELLE Untersuchung zeigt freie Flüssigkeit in Morrisons Beutel.
Eine solch tiefgreifende Statusänderung nach einem therapeutischen Eingriff erfordert ernsthafte Überlegungen. Beginnen wir mit der Hypotonie und Tachykardie während der Huntington-Krankheit und der anschließenden CRRT. Hypotonie während der HD ist sicherlich mit höheren Flussraten möglich. CRRT hat jedoch viel langsamere Flussraten und Hypotonie ist weniger häufig, wenn CRRT verwendet wird. Warum ist diese Person unter Schock und benötigt Vasopressoren nach Beginn der Huntington-Krankheit?
Bei der Annäherung an Patienten mit Schock kommt mir der mnemonische SCHOCK (septisch / spinal; hypovolämisch; obstruktiv; kardiogen; anaphylaktisch – K wie in Milchsäure) in den Sinn. Sepsis ist sicherlich möglich, angesichts ihrer Geschichte der Bakteriämie. Es ist jedoch weniger wahrscheinlich, dass es die Ursache für eine so tiefgreifende Dekompensation ist, insbesondere bei einem akuten Beginn im Rahmen der Einleitung der Huntington-Krankheit. Hypovolämischer oder hämorrhagischer Schock ist eine andere Möglichkeit. Sie hat Risikofaktoren für beide, wie sie auf Antikoagulation mit ihrer Geschichte von DVT sein kann, sowie möglicherweise urämische Thrombozytenfunktionsstörung. Dies muss weiter untersucht werden. Obstruktiver Schock wie bei Lungenembolie oder Tamponade ist eine andere Möglichkeit. Sie hat sicherlich Risikofaktoren für diese mit ihrer Geschichte von DVT und unbekannten Antikoagulationsstatus. Sie ist auch hypoxisch, was nicht durch die Lungenentzündung erklärt wird, da ihre ursprünglichen Sättigungen über 95% lagen. Sie hätte auch eine Tamponade aus einer urämischen Perikarditis entwickeln können, obwohl dies weniger wahrscheinlich ist, da ihr Blutharnstoffstickstoff (BUN) nicht signifikant erhöht ist und sie keine Beschwerden über Perikarditis-Symptome hatte. Eine weitere mögliche Ursache für einen hämodynamischen Kollaps, der zu einem obstruktiven Schock führt, ist eine Luftembolie durch den neuen HD-Katheter und die anschließende Einleitung der HD durch ihn. Da dies möglich ist, müssen wir dies auch ein wenig mehr herausarbeiten.
Ein kardiogener Schock ist weniger wahrscheinlich, da es unwahrscheinlich ist, dass sie einen schmerzlosen Myokardinfarkt entwickelt hat, der so schwerwiegend ist, dass sie in einen kardiogenen Schock geriet. Anaphylaktische und endokrine Probleme sind weitere mögliche Ursachen für einen Schock. Es wurden jedoch keine Medikamente verabreicht oder Hautausschläge oder Atemwegserkrankungen erwähnt, die auf eine Anaphylaxie als Ursache hindeuteten. Ein endokriner Schock sollte in Betracht gezogen werden, da sie Prednison einnimmt, was eine Nebenniereninsuffizienz zu einer möglichen Ursache macht. Die Hyperkaliämie und Hyponatriämie, die Sie bei Nebenniereninsuffizienz erwarten würden, sind vorhanden; es gibt jedoch keine Erwähnung der Nichteinhaltung oder des Erbrechens der Steroide, was diese Möglichkeit weniger wahrscheinlich macht.
Anfall während der Huntington-Krankheit ist eine weitere Entität, die in diesem Fall vorhanden ist. Sie hat eine Geschichte von Anfällen, und kein Antiepileptikum ist auf ihrer Medikamentenliste. Ihr Anfall könnte also sicherlich auf Nichteinhaltung zurückzuführen sein. Die urämische Enzephalopathie kann sich zu jedem Zeitpunkt als Krampfanfälle darstellen; Das BRÖTCHEN ist jedoch nur leicht erhöht, was dies unwahrscheinlich macht. Das Dialyseungleichgewichtssyndrom ist eine weitere Ursache für Krampfanfälle während der Huntington-Krankheit. Es tritt jedoch normalerweise während der allerersten HUNTINGTON-Sitzung auf und ist mit einem schnellen Abfall des Brötchens verbunden. Dieser Patient hat die HUNTINGTON-Krankheit seit einiger Zeit und das BUN ist nicht deutlich erhöht, was diese Diagnose unwahrscheinlich macht. Schließlich kann eine verminderte Durchblutung des Gehirns durch Hypotonie während der Huntington-Krankheit Anfälle auslösen. Der Patient wurde während der Huntington-Krankheit blutdrucksenkend, was aufgrund höherer Flussraten passieren kann. Sie wurde dann auf CRRT gelegt, die eine langsamere Flussrate verwendet und eine viel geringere Inzidenz von Hypotonie aufweist; Sie wurde jedoch blutdrucksenkender. Dies deutet darauf hin, dass es höchstwahrscheinlich einen anderen Grund für die Hypotonie gibt als nur die Huntington-Krankheit.
Sie hat auch freie Flüssigkeit auf ihrer SCHNELLEN Prüfung und hat jetzt einen aufgeblähten Bauch. In Verbindung mit der sich stark verschlechternden Anämie muss ich davon ausgehen, dass sie in ihren Bauch blutet. Es gibt nichts anderes als Blutungen und Hämolyse, die einen so starken Abfall ihres Hämoglobins erklären könnten, und es gibt keine Hinweise darauf, dass Hämolyse in ihrer Anamnese, körperlichen Untersuchung oder Nebenstudien verdächtig ist.
Der Patient hat auch einen erhöhten Atemwegsdruck am Beatmungsgerät. Es gibt mehrere Gründe, warum ihr Atemwegsdruck erhöht sein könnte; Aber im Rahmen eines aufgeblähten Abdomens und einer Hypotonie tritt das Abdominalkompartmentsyndrom (ACS) in den Vordergrund meiner Differentialdiagnosen. Daher muss ich davon ausgehen, dass dies eine relativ lebhafte Blutung ist, da sie ihr Hämoglobin signifikant gesenkt hat, in Herzstillstand gegangen ist, sich mit Bluttransfusionen verbessert hat und mehrere Vasopressoren benötigt, um ihren Blutdruck aufrechtzuerhalten. Aber warum blutet sie in ihrem Bauch? Sie hat kein Trauma an ihrem Bauch erlebt, es sei denn, es geschah während des Anfalls im Krankenhaus; Wenn dies jedoch der Fall gewesen wäre, würde ich davon ausgehen, dass diese Geschichte gegeben worden wäre. Sie hätte sicherlich eine Art Aortenkatastrophe wie ein gebrochenes Bauchaortenaneurysma erleben können, aber es wäre sehr seltsam, wenn dies während der Huntington-Krankheit passiert wäre.
Jetzt musste ich einen Schritt zurücktreten und die diagnostischen Hinweise als Ganzes betrachten und diese Puzzleteile zusammensetzen. Bei der Betrachtung dieser gesamten Patientenpräsentation, Ein gemeinsames Thema entsteht in fast jedem Aspekt ihrer Abfolge von Ereignissen. Blutung. Anämie? Blutung. Ihre Anämie verschlechtert sich? Definitiv Blutung. Hypotonie? Blutung. Beschlagnahme? Hypoperfusion aufgrund von Hypotonie aufgrund von Blutungen. Hypoxie? Tiefe Anämie, die von Blutungen herrührt. ACS? Blutung. Laktatazidose? Hypotonie und Anämie durch Blutung.
Jetzt müssen wir nur noch herausfinden, woher diese Blutung kommt. Als die Patientin sich zum ersten Mal vorstellte, schien sie bemerkenswert stabil zu sein. Sie hatte keine Beschwerden und ihre Vitalfunktionen, außer ihrem Fieber, waren innerhalb normaler Grenzen. Sie hatte einen HD-Katheter ohne Erwähnung von Komplikationen platziert. Sie beginnt mit der Huntington-Krankheit und ihr Blutdruck sinkt, ihre Herzfrequenz steigt und sie wird fast sofort symptomatisch. Ich könnte die HUNTINGTON-Krankheit leicht als Ursache dafür verantwortlich machen; allerdings initiieren ihre Anbieter CRRT und ihre Hypotonie verschlechtert sich, wodurch die HUNTINGTON-Krankheit weniger wahrscheinlich die Ursache ist. Daher ist etwas vor dem Beginn der Huntington-Krankheit passiert, da sie bis zum Beginn der Huntington-Krankheit stabil war. Das einzige, was vor der Einleitung der Huntington-Krankheit geschah, war die Platzierung des Huntington-Katheters. Es gibt keine Erwähnung von Komplikationen oder signifikantem Blutverlust während der Platzierung. Es ist jedoch das einzige Ereignis zwischen dem Patienten, der stabil und instabil ist.
Was hätte passieren können, wenn eine offensichtliche Komplikation nicht erwähnt worden wäre? Denken Sie daran, dass die vermutete Quelle der Blutung im Bauchraum liegt. Der HD-Katheter wurde in die Leiste gelegt, die nicht weit vom Bauch und dem retroperitonealen Raum entfernt ist. Wenn der Anbieter, der die Leitung platziert, die andere Seite der Gefäßwand durchdrungen hätte, hätte er den HD-Katheter leicht so platzieren können, dass sich seine Spitze im Retroperitoneum befindet. Wäre dies der Fall, würde der Patient Blut in den retroperitonealen Raum extravasieren, was zu Hypotonie, verminderter Perfusion, Laktatazidose und schwerer Anämie führen würde. Sobald der retroperitoneale Raum gefüllt ist, würde es zu einem erhöhten intraabdominalen Druck kommen, der schließlich zu ACS führt. Eine Überprüfung der Literatur zeigt einen Fallbericht dieser Art von Komplikation.1
Daher ist die diagnostische Studie, die ich durchführen würde, ein Computertomographie (CT) -Angiogramm des Abdomens und des Beckens. Dies würde zeigen, wo der HD-Katheter platziert wurde, und das Retroperitoneum auf Anzeichen einer aktiven Blutung untersuchen.
ERGEBNIS DES FALLS
Die diagnostische Studie war ein CT-Angiogramm des Abdomens und des Beckens. Der linke Femur-HD-Katheter hatte die linke Vena iliaca communis des Patienten durchstochen und ein rechtsseitiges retroperitoneales Hämatom gebildet. Das Operationsteam beurteilte die Patientin und führte eine vorübergehende Laparotomie am Krankenbett durch, um ihr akutes ACS zu behandeln. Dies zeigte ein großes, rechtsseitiges retroperitoneales Hämatom und eine große Menge an Aszites. Die Hämodynamik der Patientin stabilisierte sich nach diesem Eingriff und sie konnte alle Vasopressoren ablösen. Sie wurde dann direkt in den Operationssaal mit dem Gefäßchirurgie-Team für eine emergente Reparatur ihrer linken Vena iliaca communis transportiert.
Während der Reparatur erhielt sie weiterhin mehrere Bluttransfusionen. Danach wurde sie mit offenem Bauch auf die chirurgische Intensivstation gebracht, die anschließend repariert wurde. Die Patientin wachte neurologisch völlig intakt auf und wurde fünf Wochen nach ihrer Verletzung nach Hause entlassen.
RESIDENT DISCUSSION
ACS ist der Endpunkt eines Spektrums, das mit intraabdominaler Hypertonie (IAH) beginnt und endet, wenn der intraabdominale Druck 20 mmHg überschreitet und von einer Endorgan-Dysfunktion begleitet wird.2 Der normale Bauchdruck sollte auch bei kritisch kranken Patienten <12 mmHg betragen. IAH, die stufenweise abgestuft werden kann, ist definiert als ein Druck von 12-25 mmHg ohne Vorliegen einer Organfunktionsstörung.
Es gibt verschiedene Arten von ACS. Primäres ACS tritt bei Traumata oder chirurgischen Katastrophen auf, die zu einem großen hämorrhagischen Ereignis führen, wie im vorliegenden Fall.3 Sekundäres ACS tritt auf, wenn Intensivpatienten mit großen Mengen Kristalloiden aggressiv wiederbelebt werden.4,5 Weniger häufige sekundäre Ursachen sind große, raumgreifende Läsionen, darm- oder retroperitoneale Ödeme und Pankreatitis. Sekundäres ACS ist heimtückisch und wird häufig nach einer Verzögerung diagnostiziert, was eine bereits hohe Mortalität weiter erschwert.4,5
Die Letalität von ACS ist auf eine beeinträchtigte Organperfusion und späteres Organversagen zurückzuführen. In den Nieren führt eine verminderte Nierenperfusion zu Stauung und Oligurie, während ein erhöhter Kompartmentdruck eine direkte Kompression des Organs verursacht.6,7 Ein erhöhter splanchnischer Gefäßwiderstand führt zu Darmödemen, Translokation von Darmbakterien, Hyperlaktämie und Sepsis.6,7 Die kardiale Vorlast kann aufgrund der Kompression der Vena cava inferior verringert sein, was zu einer Verringerung des Herzzeitvolumens führt, während die rechtsventrikuläre Nachlast zunimmt.7 Die Sauerstoffversorgung wird beeinträchtigt, wenn das Zwerchfell nach vorne gedrückt wird und die funktionelle Restkapazität abnimmt.7 Der intrakranielle Druck steigt auch infolge der Jugularvenenkompression, die den venösen Rückfluss beeinträchtigt. Klinisch wird der Patient mit Hypotonie, Hypoxie, akuter Nierenschädigung, verändertem mentalen Status, Krampfanfällen oder Unempfindlichkeit auftreten; Schließlich erfährt der Patient einen totalen kardiovaskulären Kollaps.6-8
Der Goldstandard für die Diagnose von ACS ist die Messung des Blasendrucks indirekt mit einem Harnkatheter.9 Um einen genauen Druck zu messen, muss sich der Patient in Rückenlage befinden und die Messung am Ende des Ausatmens durchgeführt werden, wobei der Wandler auf Null gesetzt ist und mit dem Beckenkamm übereinstimmt. Es wurde gezeigt, dass diese Messung mit dem direkt gemessenen intraabdominalen Druck korreliert.10 Die Messung des Blasendrucks alle 4-6 Stunden ist bei kritisch kranken Patienten mit einem Risiko für die Entwicklung eines ACS ausreichend.
Die Hauptstütze der Behandlung von ACS ist die dekompressive Laparotomie, bei der der Patient normalerweise postoperativ mit offenem Bauch zurückgelassen werden muss.11 Weitere sekundäre temporäre Maßnahmen umfassen Sedierung und Analgesie, neuromuskuläre Lähmung, Dekompression des Darminhalts mit einer Nasen- oder Magensonde, Diuretika und CRRT.11,12
Die Mortalität von ACS bleibt trotz medizinischer Intervention hoch. Während die dekompressive Laparotomie den intraabdominalen Druck effektiv sofort reduziert, ist dieses Verfahren mit mehreren medizinischen Komorbiditäten verbunden, deren Mortalität immer noch bei bis zu 50% liegt.13 Dies kann darauf zurückzuführen sein, dass die Patienten zum Zeitpunkt der dekompressiven Laparotomie kritisch krank sind und das Verfahren als letzter Ausweg angesehen wird.
Ein zweites wichtiges Diskussionsthema in diesem Fall ist das ethische Dilemma der Anbieter, die sich um diese kritisch kranke Patientin kümmern, deren religiöse Überzeugungen der Standardbehandlung (Bluttransfusion) für ihre Krankheit widersprachen. Die Patientin hatte in ihrem Diagramm eine erste Dokumentation des Arzt-Patienten-Gesprächs, in der sie ihre bewusste Ablehnung von Blutprodukten feststellte. Sie hatte jedoch keine schriftliche, unterschriebene Dokumentation der Blutprodukttransfusionsverweigerung in der Tabelle. Während die Patientin bewusstlos und in Extremis war, machte ihr Ehemann, der kein praktizierender Zeuge Jehovas ist, ihre Entscheidung rückgängig, um ihr Leben zu retten. Wo liegt diese Entscheidung im Gleichgewicht zwischen Autonomie und der Macht der nächsten Angehörigen, zu entscheiden, welche medizinischen Eingriffe ein Patient erhalten soll? Was passiert, wenn die nächsten Angehörigen eine Entscheidung treffen, die gegen die Wahl des Patienten verstößt? In Leben-oder-Tod-Situationen mit ethischen Dilemmata, in denen eine schnelle Entscheidungsfindung über das Ergebnis entscheidet, wie kann diese Belastung den Angehörigen auferlegt werden?
Das ethische Dilemma liegt daher in der Idee, dass die Transfusion zwar den Wert der Autonomie verletzt, aber gleichzeitig das ethische Konzept der Wohltätigkeit erfüllt. Im Allgemeinen sollten persönliche Anweisungen des Patienten Vorrang vor Entscheidungen des medizinischen Vertreters haben. Die Entscheidung der Familie, im Namen des bewusstlosen Patienten zu transfundieren, wie im vorliegenden Fall zu sehen, ist jedoch rechtlich angemessen, obwohl sie die Autonomie des Patienten verletzt.
Die Ethikkommission wurde konsultiert, nachdem der Patient bereits eine massive Transfusion von Blutprodukten erhalten hatte und weiterhin weitere Transfusionen von roten Blutkörperchen erhielt. Der Ausschuss empfahl, dass der Patient trotz Zustimmung der nächsten Angehörigen keine Blutprodukttransfusionen mehr erhält. Der Patient wachte neurologisch völlig intakt auf und wurde über die Bluttransfusionen informiert. Sie entschied, dass sie in Zukunft nur noch Blutbankplasma und von der Familie gespendete rote Blutkörperchen während eines akuten Ereignisses akzeptieren würde. Die Patientin wurde fünf Wochen nach ihrer iatrogenen Verletzung nach Hause entlassen.
ENDGÜLTIGE DIAGNOSE
Iatrogene Perforation der linken Vena iliaca communis mit daraus resultierendem Abdominalkompartmentsyndrom.
WICHTIGE LEHRPUNKTE
ACS tritt auf, wenn der intraabdominale Druck über 20 mmHg liegt und eine Endorganschädigung vorliegt.
Primäres ACS wird durch Trauma oder Operation verursacht, aber achten Sie auf sekundäres ACS, das bei massiver Wiederbelebung, insbesondere auf Intensivstationen, auftritt.
Der Goldstandard der ACS-Diagnose ist ein gemessener Blasendruck.
Die Behandlung ist eine Laparotomie sowie vorübergehende Maßnahmen wie Evakuierung des Darminhalts und / oder Sedierung und Lähmung.
Die dokumentierte Einwilligung des Patienten nach Aufklärung und / oder die Genehmigung des Institutional Review Board wurde eingeholt und zur Veröffentlichung dieses Fallberichts eingereicht.
Fußnoten
Abschnittsredakteur: Rick A. McPheeters, DO
Volltext verfügbar über Open Access unter http://escholarship.org/uc/uciem_cpcem
Korrespondenzadresse: Laura J. Bontempo, MD, MEd, University of Maryland, Abteilung für Notfallmedizin, 110 S Paca Street, 6th Floor, Suite 200, Baltimore, MD 21201. E-Mail: [email protected]. 2:103 – 108
Einreichungshistorie: Überarbeitung eingegangen am 22. Januar 2018; Eingereicht am 19.März 2018; Akzeptiert am 21. März 2018
Interessenkonflikte: Gemäß der CPC-EM-Vereinbarung zur Einreichung von Artikeln sind alle Autoren verpflichtet, alle Zugehörigkeiten, Finanzierungsquellen und Finanz- oder Managementbeziehungen offenzulegen, die als potenzielle Quellen für Voreingenommenheit wahrgenommen werden könnten. Die Autoren offenbarten keine.
1. Pafitanis G, Spyridon K, Theodorakopoulou E, et al. Ein Fallbericht über das abdominale Kompartmentsyndrom, das durch eine Fehlstellung eines femoralen Venenkatheters verursacht wird. Int J Surg Fall Rep. 2015;12: 84-6.
2. Maluso P, Olson J, Sarani B. Abdominale Kompartmenthypertonie und abdominales Kompartmentsyndrom. Crit Pflege Clin. 2016;32(2):213-22.
3. In: Morken J, West MA. Abdominalkompartmentsyndrom auf der Intensivstation. In: Curr Opin Crit Care. 2001;7(4):268-74.
4. Biffl, WL, Moore, EE, Burch, JM, et al. Das sekundäre Abdominalkompartmentsyndrom ist ein sehr tödliches Ereignis. Am Jr Surg. 2001;182(6):645-8.
5. Burrows R, Edington J, Robbs JV. Ein Wolf im Wolfspelz: das Abdominalkompartmentsyndrom. S Afr Med J. 1995;85(1):46-8.
6. Caldwell CB, Ricotta JJ. Veränderungen des viszeralen Blutflusses mit erhöhtem intraabdominalen Druck. J Surg Res. 1987;43(1):14-20.
7. Balogh Z, McKinley BA, Cox CS, et al. Abdominalkompartmentsyndrom: die Ursache oder Wirkung von postinjury Multiple Organversagen. Schock. 2003;20(6):483-92.
8. Vidal MG, Ruiz Weisser J, Gonzalez F, et al. Inzidenz und klinische Auswirkungen der intraabdominalen Hypertonie bei kritisch kranken Patienten. In: Crit Care Med. 2008;36(6):1823-31.
9. Kron IL, Harman PK, Nolan SP. Die Messung des intraabdominalen Drucks als Kriterium für die Reexploration des Abdomens. Ann Surg. 1984;199(1):28-30.
10. Saggi BH, Sugerman HJ, Ivatury RR, et al. Abdominales Kompartmentsyndrom. J Trauma. 1998;45(3):597-609.
11. Kirpatrick AW, Roberts DJ, De Waele JD, et al. Intraabdominale Hypertonie und das Abdominalkompartmentsyndrom: Aktualisierte Concensus-Definitionen und Richtlinien für die klinische Praxis der Weltgesellschaft für das Abdominalkompartmentsyndrom. Intensivmedizin Med. 2013;39(7):1190-206.
12. Ouellet JF, Leppaniemi A, Ball CG, et al. Alternativen zur formellen abdominalen Dekompression. Am Surg. 2011;77(Sl):S51-7.
13. Von Waele JJ, Hoste EA, Malbrain ML. Dekompressive Laparotomie für das Abdominalkompartmentsyndrom–eine kritische Analyse. Crit Pflege. 2006;10(2):R51.