Einführung
Die adaptive Strahlung von Insekten in verschiedenen Klimazonen wurde teilweise durch die wiederholte Entwicklung der Diapause erleichtert, ein antizipatorischer Entwicklungsstillstand vor ungünstigen Bedingungen (z. B. Winter, Trockenzeit; Waterhouse und Norris, 1980; Tauber et al.)., 1986; Danks, 1987; Hodkova und Hodek, 2004). Die Diapause wird typischerweise als Reaktion auf einen bestimmten Umwelteinfluss (z., saisonale Veränderung der Photoperiode), für einen genetisch bestimmten Zeitraum aufrechterhalten und dann beendet, nachdem günstige Bedingungen zurückgekehrt sind. So ermöglicht die Diapause Insekten, ihr Wachstum und ihre Fortpflanzung an lokalen saisonalen Zyklen auszurichten (Tauber et al., 1986; Danks, 1987). Die Diapause ist für viele Insektenbestäuber ein Schlüsselregulator für die Lebensgeschichte, die geografische Reichweite und die saisonale Häufigkeit (z. B. Kemp und Bosch, 2005; Fründ et al., 2013), landwirtschaftliche Schädlinge (z.B. Pullin et al., 1991; Li et al., 2012; Köhler et al., 2015) und Krankheitsvektoren (z.B. Denlinger und Armbruster, 2014; Gray et al., 2016). Darüber hinaus ruft die Diapause weit verbreitete physiologische Modifikationen hervor, einschließlich Akkumulation von Nährstoffreserven, Unterdrückung der Stoffwechselaktivität, erhöhter anaerober Katabolismus, Zellzyklusstillstand, Veränderungen der Wnt-Signalgebung und Hochregulierung verschiedener Stresstoleranzmechanismen (Denlinger, 2002; Hahn und Denlinger, 2007, 2011; King und MacRae, 2015; Ragland und Keep, 2017). Das Verständnis der Regulationsmechanismen, die der Diapause zugrunde liegen, ist ein langjähriges Problem in der Organismusbiologie und wird die Entwicklung neuer Managementansätze für Schlüsselarten erleichtern.
Ecdysteroide und juvenile Hormone regulieren eine Vielzahl physiologischer und entwicklungsbezogener Prozesse bei Insekten (Gruntenko und Rauschenbach, 2008; Jindra et al., 2013; Palli, 2016), einschließlich Diapause (Denlinger, 1985; Denlinger et al., 2012). Das spezifische hormonelle Signal, das die Diapause reguliert, variiert tendenziell je nach Stadium, in dem ein Entwicklungsstillstand auftritt (Denlinger et al., 2012). Zum Beispiel wird der Entwicklungsstillstand während der Larven- oder Pupendiapause typischerweise durch Veränderungen der Ecdysteroidhäufigkeit reguliert (z. B. Ohtaki und Takahashi, 1972; Bowen et al., 1984; Richard et al., 1987). Im Gegensatz dazu wird der Entwicklungsstillstand während der erwachsenen Diapause häufig durch Veränderungen der juvenilen Hormonhäufigkeit reguliert (z. B. Spielman, 1974; Schooneveld et al., 1977; Saunders et al., 1990 und siehe Review in Denlinger et al., 2012).
Eine große Lücke besteht in unserem Verständnis der hormonellen Regulation der embryonalen Diapause, die bei Lepidoptera, Orthoptera, Hemiptera und Diptera weit verbreitet ist. Frühere Forschungen haben die endokrine Regulation der embryonalen Diapause bei der Seidenraupenmotte (Bombyx mori) durch das Diapausenhormon (Hasegawa, 1963) ausführlich dokumentiert; Yamashita und Hasegawa, 1966; Yamashita, 1996). Diese regulatorische Rolle für das Diapausenhormon scheint jedoch einzigartig für B. mori zu sein und hat daher wenig Einblick in die hormonellen Grundlagen der embryonalen Diapause bei anderen Arten gegeben (Denlinger et al., 2012). Über B. mori hinaus wurde die hormonelle Regulation der embryonalen Diapause bei nur drei Arten nachgewiesen. Die Zigeunermotte (Lymantria dispar) erfährt einen Entwicklungsstillstand, der durch eine höhere Häufigkeit von Ecdysteroiden initiiert und aufrechterhalten wird (Lee et al., 1997; Lee und Denlinger, 1997), während eine niedrige Ecdysteroid-Häufigkeit die Diapause bei zwei Heuschrecken reguliert (Chortoicetes termifera, Locusta migratoria; Gregg et al., 1987; Tawfik et al., 2002).
Bisher hat keine Studie die Hormonhäufigkeit während der embryonalen Diapause einer Diptera-Spezies charakterisiert. Hier, Wir adressieren diese Lücke, indem wir die hormonelle Regulation der embryonalen Diapause bei der asiatischen Tigermücke untersuchen, Aedes albopictus. In den letzten 30 Jahren wurde dieser medizinisch wichtige Vektor (Paupy et al., 2009) ist weltweit erfolgreich in gemäßigte Regionen eingedrungen (Benedict et al., 2007), teilweise aufgrund einer embryonalen Diapause, die das Überleben während des Ferntransports erleichtert hat (Juliano und Lounibos, 2005; Diniz et al., 2017) und entwickelte sich schnell, um den Zeitpunkt des Entwicklungsstillstands an die lokalen klimatischen Bedingungen anzupassen (Urbanski et al., 2012). Gemäßigte Populationen von Ae. albopictus tritt in eine maternal regulierte, photoperiodische Diapause ein. Unter kurzen, herbstlichen Tageslängen produzieren Weibchen Eier, die die Embryonalentwicklung abschließen, aber bis zum folgenden Frühjahr als Larven im Chorion des Eies gegen Schlüpfreize resistent bleiben. In den letzten zehn Jahren die Transkriptionsregulation der embryonalen Diapause bei Ae. albopictus wurde umfassend charakterisiert (Urbanski et al., 2010; Poelchau et al., 2011, 2013a,b; Huang X. et al., 2015; Batz et al., 2017), aber die hormonelle Regulation dieser entscheidenden Anpassung bleibt unbekannt. Wir quantifizierten 20-Hydroxyecdyson (20HE) und juveniles Hormon III (JH3) in diapausing und nicht-diapausing Eier zu drei Zeitpunkten, die Schlüsselstadien der Embryonalentwicklung Bracket und interpretierten unsere Ergebnisse im Zusammenhang mit zuvor gesammelten RNAseq (Poelchau et al., 2013a,b) und manipulative Daten (Suman et al., 2015).
Materialien und Methoden
Eisammlung
Alle Messungen verwendeten F11-Eier aus einer Laborkolonie von Ae. albopictus wurde im August 2015 aus über 200 Larven in Manassas, VA, USA, gewonnen. Vor diesem Experiment wurde die Population unter zuvor beschriebenen Bedingungen aufrechterhalten . Um Eiproben für dieses Experiment zu erzeugen, wurden F10-Larven in 5,5 L Sterlitbehältern mit einer Dichte von ungefähr 250 Larven pro 2 gehalten.5 L entionisiertes (DI) Wasser mit 5 ml Lebensmittelaufschlämmung (Armbruster und Conn, 2006) unter LD-Photoperiode bei 21 °C und 80% RF. Jeden Montag-Mittwoch-Freitag wurden die Larven durch ein feinmaschiges Netz gefiltert und dann in einen sauberen 5,5 L Sterlitbehälter überführt; Puppen wurden in adulte Käfige verteilt, die entweder unter einer diapausenabweisenden LD-Photoperiode oder einer diapauseninduzierenden, kurztägigen Photoperiode (SD, 8: 16 L: D) gehalten wurden.
Erwachsene Weibchen erhielten wöchentliche Blutmahlzeiten und einen Eiablagebecher, der mit ungebleichtem Papiertuch ausgekleidet und zur Hälfte mit DI-Wasser gefüllt war, bis die Eiablage aufhörte. Die Eier wurden täglich gesammelt, 48 h lang auf einem feuchten Papiertuch aufbewahrt, dann an der Luft getrocknet und unter hygienischen Bedingungen in Behältern gelagert. 5, 7 und 11 Tage nach der Eiablage (dpov) wurden die gesammelten Eier auf die nächsten 1 µg (Mittelwert: 11,460 mg, Bereich: 9,1-19,5 mg) auf einer MX5–Mikrowaage (Mettler-Toledo, Columbia, OH, USA) gewogen, in 1,5-ml-Röhrchen gegeben, zwischen 11 und 12 Uhr (Zeitgeberzeit 3-4 h) in flüssigem Stickstoff eingefroren und bei -80 ° C gelagert. Eine Teilmenge von Eiern wurde beibehalten, um zu bestätigen, dass LD- und SD-Photoperiodenbedingungen die Produktion von Nicht-Diapause- bzw., 2012).
Wir haben Eier bei 5, 7 und 11 dpov aus zwei Gründen probiert. Zuerst Ae. albopictus initiiert die Diapause (sensu Koštál, 2006; Koštál et al., 2017) nach Abschluss der Embryonalentwicklung (Mori et al., 1981). Unter den in unseren Experimenten verwendeten Bedingungen, Ae. albopictus-Embryonen werden bei etwa 5 dpov segmentiert, und Nicht-Diapause-Embryonen schlüpfen bei etwa 7 dpov (Poelchau et al., 2013a). Durch 11 dpov ist der Entwicklungsstillstand in Diapausenembryonen fest etabliert (Poelchau et al., 2013b). Daher haben wir uns entschieden, Diapause- und Nicht-Diapause-Embryonen zu Zeitpunkten zu vergleichen, die den Zeitraum der Schlüpfkompetenz einschließen, einschließlich der Feststellung eines Entwicklungsstillstands während der Diapause. Zweitens wählten wir Zeitpunkte, die denen für frühere RNAseq-Experimente von Embryonen ähnlich waren (Poelchau et al., 2013a, b), damit diese Daten zur Interpretation unserer aktuellen Ergebnisse genutzt werden können. Es wurde zuvor festgestellt, dass diese RNAseq-Ergebnisse gut mit den Ergebnissen der Genexpression korrelieren, die über qRT-PCR erhalten wurden (Poelchau et al., 2013a).
Ecdysteroid-Quantifizierung
Zur Extraktion von Ecdysteroiden wurden Eiproben in ein 0,5 ml konisches Micro Tissue Grinder-Röhrchen aus Borosilikatglas (Wheaton, Millville, NJ, USA) gegeben, wobei 1 µg Farnesol (Sigma-Aldrich, St. Louis, MO, USA) als interner Standard hinzugefügt wurde. Die Eier wurden dreimal manuell mit einem Teflonstößel in 300 µL gekühltem MeOH in HPLC-Qualität homogenisiert und dann bei 12.000 RCF für 10 min in einer gekühlten (4 ° C) Zentrifuge gesponnen. Der resultierende Überstand wurde gepoolt und dann zweimal mit gekühltem 90%igen MeOH und einmal mit MeOH über Aluminiumoxidsäulen eluiert. Die Proben wurden in einer gekühlten (4 °C) Vakuumzentrifuge getrocknet, in 20 µL MeOH resuspendiert und bis zur Analyse bei -80 °C gelagert. Positivkontrollen wurden durch Zugabe von je 1 µg 20HE (Sigma-Aldrich) und Farnesol zu Leerröhrchen hergestellt, die ansonsten identisch verarbeitet wurden. Die Probenanalyse der Ecdysteroidkonzentration wurde mit einem Micromass Quattro Micro LC-MS/MS (Waters Co., Milford, MA, Vereinigte Staaten). Die Injektionsvolumina betrugen 5,0 µL, wobei Trennungen unter Verwendung von ACQUITY UPLC BEH C18 2,1 mm x 50 mm Säulen mit einer 1,7 µm stationären Phase (Waters Co.). Betriebsbedingungen für FK-Läufe waren eine Fließgeschwindigkeit der mobilen Phase von 0,37 ml min-1 mit einer binären mobilen Phase von 0,1% Ameisensäure in Acetonitril und 0,1% Ameisensäure in Wasser. Ausgangsbedingungen waren 1:99 Acetonitril:Wasser, gefolgt von isokratischem Fluss für 0,3 min. Bei 0,3 min ein linearer Gradient von 1:99 bis 99:1 Acetonitril:Wasser wurde über 4,2 min aufgetragen, gefolgt von 1,0 min isokratischer Strömung bei 99:1 Acetonitril:Wasser, wonach die mobile Phase auf 1:99 Acetonitril:Wasser zurückkehrte. Die Einstellungen des Massenspektrometers waren Elektrospray-positiv mit einer Desolvationstemperatur von 350 ° C. 20HE und Farnesol eluierten bei 2,89 bzw. 4,97 min und wurden unter Verwendung einer Mehrfachreaktionsüberwachung charakteristischer Übergänge quantifiziert: 481,22 (m / z) > 445,24 (m / z) bzw. 205,41 (m / z) > 121,09 (m / z). Die Nachweisgrenze des Assays liegt bei ca. 5 pg.
Quantifizierung des juvenilen Hormons
Jede Eiprobe wurde in ein 0,5 ml konisches Mikrogewebeschleiferröhrchen aus Borosilikatglas (Wheaton) mit 1 µg Farnesol (Sigma-Aldrich) gegeben als interner Standard. Die Eier wurden dreimal manuell mit einem Teflonstößel in 500 µL gekühltem Hexan in HPLC-Qualität homogenisiert und dann bei 12.000 RCF für 10 min in einer gekühlten (4 ° C) Zentrifuge gesponnen. Die Hexanfraktionen wurden in einem sauberen Borosilikatglas-Fläschchen rekombiniert und durch Vakuumzentrifugation getrocknet. JH wurde mittels Gaschromatographie/Massenspektrometrie wie zuvor beschrieben quantifiziert (Brent und Vargo, 2003). Der Rückstand wurde kurzzeitig mit drei Spülungen Hexan aus den Fläschchen ausgewaschen und in mit Aluminiumoxid gefüllte Borosilikatglassäulen gegeben. Um Verunreinigungen herauszufiltern, wurden Proben nacheinander mit Hexan, 10% Ethylether-Hexan und 30% Ethylether-Hexan durch die Säulen eluiert. Nach dem Trocknen wurden die Proben durch Erhitzen auf 60°C für 20 min in einer Lösung von Methyl-d-Alkohol (Sigma-Aldrich) und Trifluoressigsäure (Sigma-Aldrich) derivatisiert. Die Proben wurden getrocknet, in Hexan resuspendiert und erneut über Aluminiumoxidsäulen eluiert. Nicht derivatisierte Komponenten wurden mit 30%igem Ethylether entfernt. Das JH-Derivat wurde durch Zugabe von 50% Ethyl-Acetat–hexan in neue Fläschchen gesammelt. Nach dem Trocknen wurden die Proben in Hexan resuspendiert und anschließend mit einem GC der HP 7890A-Serie (Agilent Technologies, Santa Clara, CA, USA) analysiert, der mit einer 30 m × 0,25 mm Zebron ZB-WAX-Säule (Phenomenex, Torrance, CA, USA) ausgestattet war und mit einem inerten massenselektiven Detektor HP 5975C gekoppelt war. Helium wurde als Trägergas verwendet. Die JH-Form wurde bestätigt, indem zuerst Testproben im SCAN-Modus auf bekannte Signaturen von JH ausgeführt wurden 0, JH I, JH II, JH3, und JH3 Ethyl; JH3 wurde als primäre endogene Form in dieser Spezies bestätigt. Nachfolgende Proben wurden unter Verwendung des MS-SIM-Modus analysiert, wobei bei m / z 76 und 225 überwacht wurde, um die Spezifität für das d3-Methoxyhydrinderivat von JH3 sicherzustellen. Die Gesamthäufigkeit wurde anhand einer Standardkurve von derivatisiertem JH quantifiziert3 und für die Startmasse der Eier angepasst. Die Nachweisgrenze des Assays liegt bei ca. 1 pg.
Statistische Analysen
Analysen wurden in R durchgeführt (R Core Team, 2019). Die JH3-Häufigkeit wurde log-transformiert und mit ANOVA analysiert, um die Auswirkungen von Diapausenstatus, Alter und deren Interaktion zu testen. 20DIE Häufigkeit war nichtlinear und passte mit zwei polynomialen Regressionsmodellen an: einem vollständigen Modell mit Alter und Entwicklungsstatus (Diapause, Nicht-Diapause) und einem reduzierten Modell, das nur das Alter enthielt. Die Modelle wurden unter Verwendung von ANOVA verglichen, um festzustellen, ob der Entwicklungsstatus die Erklärungskraft signifikant verbesserte.
Transkriptionsanalysen verwendeten zuvor gesammelte RNAseq-Daten aus Diapause und Nicht-Diapause Ae. albopictus-Eier (Ergänzungsdatensatz 1; Poelchau et al., 2013a, b). Differentiell exprimierte Gene bei 3, 6 und 11 dpov wurden durch Gensatzanreicherungsanalysen untersucht (Mootha et al., 2003) mit dem Piano-Paket (Väremo et al., 2013) auf Standardparameter eingestellt, gefolgt von einer FDR-Korrektur. Ein Referenzgensatz wurde mit den auf VectorBase zugeordneten biologischen Prozess-GO-Termen annotiert (Giraldo-Calderón et al., 2015). JH3- und Ecdysteroid-Syntheseweg-Gene sowie JH3-Rezeptoren und Abbaugene wurden entsprechend der bisherigen Literatur manuell annotiert (Bai et al., 2007; Li et al., 2011; Nouzova et al., 2011; Niwa und Niwa, 2014; Matthews et al., 2016). Zusätzlich kommentierten wir JH3- und Ecdysteroid-induzierende Gene basierend auf Genbeschreibungen in VectorBase (Giraldo-Calderón et al., 2015). Eine vollständige Übersicht über diese Gensätze finden Sie im ergänzenden Datensatz 1.
Ergebnisse
Die mittlere Inzidenz der Diapause betrug 95,9% (Bereich: 90,5–100%) unter SD-Photoperiode und 5.4% (Bereich: 1,8–9,5%) unter LD-Photoperiode (ergänzender Datensatz 2); Somit induzierten unsere photoperiodischen Behandlungen die erwarteten Diapausenreaktionen. 20ER erreichte sowohl unter Diapausen- als auch Nicht-Diapausen-Bedingungen bei 7 dpov einen Höhepunkt, aber die Einbeziehung des Diapausenstatus als Faktor in ein quadratisches Modell für die Häufigkeit von 20ER verbesserte die Erklärungskraft des Modells nicht (Abbildung 1A und ergänzender Datensatz 3; F3, 43 = 0,21, p = 0,890). Diese Ergebnisse zeigen, dass der Diapausenstatus die Variation des 20HE-Titers nicht signifikant erklärt. Die Signalweganalyse von RNAseq zeigte, dass weder der 20HE-Syntheseweg noch die 20HE-induzierbaren Gene unter diapausalen vs. nicht-diapausalen Bedingungen bei 3, 6 oder 11 dpov signifikant verändert waren (Tabelle 1).

Tabelle 1. Ergebnisse der Gensatzanreicherungsanalyse, siehe Ergänzender Datensatz 1 für eine vollständige Zusammenfassung dieser Gensätze.
Es wurde bestätigt, dass JH3 die primäre Form des juvenilen Hormons bei dieser Spezies ist. Die JH3-Häufigkeit war bei Diapausenembryonen signifikant reduziert (Abbildung 1B und ergänzender Datensatz 3; F1,64 = 5,08, p = 0,028). Das Alter (F2,64 = 0,66, p = 0,518) und die Wechselwirkung von Diapausenstatus und Alter (F2,64 = 0,13, p = 0,883) hatten jedoch keinen Einfluss auf die JH3-Spiegel. Die Signalweganalyse der RNAseq-Daten zeigte, dass der JH3-Syntheseweg bei 3 dpov signifikant und JH-induzierbare Gene bei 6 dpov signifikant unterdrückt waren (Abbildung 2 und Tabelle 1).
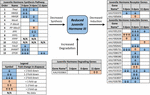
Abbildung 2. Zusammenfassung der differentiellen Expression von Genen, die an der Synthese, dem Abbau und der Induktion von JH3 für Ae beteiligt sind. albopictus (Poelchau et al., 2013a, b). Signifikante diapauseninduzierte Reduktionen (blau) oder Erhöhungen (orange) werden durch schattierte Zellen angezeigt. Die Differenzgröße wird durch Pfeile angezeigt, wie in der Legende unten links beschrieben. ∗Gene ohne gebräuchliche Namen werden durch die VektorBase-ID-Nummer identifiziert.
Diskussion
Die Diapause ist eine weit verbreitete Anpassung, die es Insekten ermöglicht, ihr Wachstum und ihre Fortpflanzung an saisonal günstige Bedingungen anzupassen (Tauber et al., 1986; Danks, 1987). Das Verständnis der hormonellen Veränderungen, durch die Insekten die Wahrnehmung äußerer, diapauseninduzierender Signale mit den physiologischen Mechanismen koordinieren, die zu einem Entwicklungsstillstand führen, ist ein langjähriges Ziel in der Biologie (Lees, 1956; Denlinger, 2002). Jahrzehntelange Forschung hat zur Identifizierung gemeinsamer hormoneller Strategien für die Diapause im Larven-, Puppen- und Erwachsenenstadium geführt; Die hormonelle Regulation der embryonalen Diapause ist jedoch insbesondere bei Dipteren weitgehend unbekannt (Denlinger, 1985, 2002; Denlinger et al., 2012). In dieser Studie wird unsere direkte Messung der reduzierten JH3-Häufigkeit in der Diapause durch frühere Genexpressionsprofile bestätigt (Poelchau et al., 2013a, b) und manipulative Experimente (Suman et al., 2015) unterstützen die Hypothese, dass JH3 die embryonale Diapause bei dieser Spezies reguliert.
Ecdysteroide
In der vorliegenden Studie haben wir die Ecdysteroidhäufigkeit zu drei Zeitpunkten unter diapausalen und nicht-diapausalen Bedingungen in Embryonen der Mücke Ae direkt gemessen. albopictus. In Übereinstimmung mit früheren Ergebnissen von Toxorhynchites amboinensis (Russo und Westbrook, 1986) erreichten die 20HE-Spiegel nahe dem Ende der Embryonalentwicklung ihren Höhepunkt (7 dpov; Abbildung 1A). Der 20HE-Titer unterschied sich jedoch nicht signifikant zwischen Diapause- und Nicht-Diapause-Eiern. Darüber hinaus zeigten weder der 20HE-Syntheseweg noch 20HE-induzierbare Gene signifikante, koordinierte Veränderungen der Genexpression (Tabelle 1). Wir schließen daraus, dass im Gegensatz zu zuvor untersuchten embryonalen Diapausen bei Lepidopteren und Orthopteren (Hasegawa, 1963; Yamashita und Hasegawa, 1966; Gregg et al., 1987; Yamashita, 1996; Lee und Denlinger, 1997; Lee et al., 1997; Tawfik et al., 2002), 20ER reguliert die Einleitung der Diapause bei Ae nicht. albopictus.
Juveniles Hormon
Im Gegensatz dazu beobachteten wir eine etwa zweifach niedrigere JH3-Häufigkeit in Diapause-Embryonen (Abbildung 1B). Während kleiner in der Größe als Unterschiede in JH3 Fülle unter Diapause vs. Nicht-Diapause Bedingungen bei Insekten, die in anderen Lebensphasen Diapause (zB Yin und Chippendale, 1979; Walker und Denlinger, 1980; Readio et al., 1999) werden unsere direkten Messungen durch Transkriptionsnachweise bestätigt (Abbildung 2). Zum Beispiel wird der JH3-Syntheseweg während der frühen Diapausenvorbereitung (3 dpov) signifikant unterdrückt. Zur Unterstützung unserer Interpretation dieser Ergebnisse haben frühere Studien gezeigt, dass eine reduzierte Expression von Genen entlang des JH3-Synthesewegs stark mit einer geringeren JH3-Häufigkeit in beiden Aedes aegypti korreliert (Nouzova et al., 2011; Rivera-Perez et al., 2014) und Diploptera punctata (Huang J. et al., 2015). JH-induzierbare Gene werden auch während der späten Diapausenvorbereitung signifikant unterdrückt (6 dpov; Tabelle 1), was darauf hindeutet, dass für die Diapause bestimmte Embryonen eine begrenzte Fähigkeit haben, auf die JH3-Signalisierung in der Nähe der Zeit zu reagieren, in der nicht-diapausale Embryonen schlüpfen können. Darüber hinaus ist die Genexpression für ein JH3-abbauendes Enzym (JH-Esterase) in der frühen Diapausenerhaltung (11 dpov; Abbildung 2) sowie später in der Diapausenerhaltung (21 und 40 dpov; Poelchau et al., 2013b), was darauf hindeutet, dass JH3 während der gesamten Diapause bei dieser Art in geringer Häufigkeit verbleiben kann.
Eine reduzierte JH3-Häufigkeit während des Entwicklungsstillstands ist etwas kontraintuitiv, da ein niedriger Juvenilhormontiter typischerweise mit fortschreitenden Häutungen assoziiert ist, insbesondere vom Larven- zum Puppenstadium (Palli, 2016). Anwendung eines JH3-Analogons (Pyriproxyfen) auf Diapause Ae. albopictus-Eier beschleunigen die Rate des Abbruchs der Diapause dosisabhängig (Suman et al., 2015). Bei der wirksamsten Dosierung beenden etwa 80% der Pyriproxyfen-exponierten Eier die Diapause um 30 dpov, verglichen mit nur 1% Diapausenabbruch um 80 dpov für Kontrolleier (Suman et al., 2015). Veränderungen der JH3-Häufigkeit können auch bei anderen Arten einen embryonalen diapausenähnlichen Phänotyp erzeugen. Zum Beispiel in B. mori, die experimentelle Reduktion der JH3-Synthese durch JHAMT-Knockout führt zu voll entwickelten Pharatlarven, die auf Schlupfreize nicht ansprechen; Dieser Phänotyp kann dosisabhängig durch Anwendung von entweder extrahiertem JH3 oder Methopren, einem JH3-Analogon, gerettet werden (Nakao et al., 2015). In ähnlicher Weise erzeugt die experimentelle Supplementierung eines anderen juvenilen Hormonanalogs (RO-20-3600) mit neu abgelagerten Drosophila melanogaster-Eiern Larven, die innerhalb des Eies beweglich sind, aber nicht schlüpfen (Smith und Arking, 1975). Zusammengenommen deuten diese Daten darauf hin, dass die Häufigkeit von Juvenilhormonen wahrscheinlich zur Regulierung der Brutreaktionen bei verschiedenen Insekten beiträgt. Embryonale Diapause im pharaten Larvenstadium wird durch ein Versagen definiert, auf Schlupfreize zu reagieren, Änderungen des juvenilen Hormonhaushalts können eine übliche hormonelle Strategie zur Regulierung dieser Form der Diapause darstellen.
In Übereinstimmung mit früheren Transkriptions- und Manipulationsdaten deuten unsere Ergebnisse stark auf eine reduzierte JH3-Häufigkeit als wahrscheinlichen Regulator der embryonalen Diapause bei Ae hin. albopictus. Diese Forschung ist die erste direkte Quantifizierung der Hormonhäufigkeit während der embryonalen Diapause bei jeder Diptera-Spezies und stellt einen wichtigen Schritt zur Klärung der hormonellen Regulation dieser entscheidenden Anpassung an widrige Umgebungen dar. Die Charakterisierung der Verbindung zwischen äußeren Reizen und Entwicklungsstillstand über hormonelle Signalwege bleibt eine große Herausforderung (Denlinger, 1985; Denlinger et al., 2012). Die Aufklärung dieser Pfade in einer Vielzahl von Arten wird kritische Einblicke in grundlegende und angewandte Probleme liefern, einschließlich des Verständnisses der molekularen und physiologischen Grundlagen der Evolution der Lebensgeschichte, der Vorhersage der Reaktionen der Arten auf den Klimawandel und der Identifizierung neuer Ziele für das Management von Schädlings- und Vektorarten (Denlinger, 2008).
Datenverfügbarkeitserklärung
Alle für diese Studie generierten Datensätze sind im Artikel / Ergänzungsmaterial enthalten.
Autorenbeiträge
ZB, CB und PA trugen zur Konzeption und Gestaltung der Studie bei und bereiteten den ersten Entwurf des Manuskripts vor. ZB, MM und JS führten die Tierhaltung durch und sammelten die Eiproben. CB führte die LC-MS/MS- und GC-MS-Analysen durch. ZB führte die statistischen Analysen durch. Alle Autoren haben zur Überarbeitung des Manuskripts beigetragen und die eingereichte Version genehmigt.
Finanzierung
Diese Arbeit wurde von den National Institutes of Health (1R15A | 111328-01) und der Davis Family Endowment to PA unterstützt.
Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Wir danken Allan Knopf und Dan Langhorst für die Unterstützung bei der Messung der Hormontiter. Wir danken auch David Denlinger für hilfreiche Kommentare zu früheren Versionen des Manuskripts. Die Verwendung von Handelsnamen oder kommerziellen Produkten in diesem Artikel dient ausschließlich der Bereitstellung spezifischer Informationen und impliziert keine Empfehlung oder Billigung durch das Landwirtschaftsministerium der Vereinigten Staaten. USDA ist ein Anbieter von Chancengleichheit und Arbeitgeber.
Ergänzendes Material
R Kernteam (2019). R: Eine Sprache und Umgebung für statistisches Rechnen. Wien: R Kernteam.
Google Scholar
Väremo, L., Nielsen, J. und Nookaew, I. (2013). Anreicherung des Gensatzes Analyse genomweiter Daten durch Einbeziehung der Direktionalität der Genexpression und Kombination statistischer Hypothesen und Methoden. Nukleinsäuren Res. 41, 4378-4391. doi: 10.1093/nar/gkt111
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar