Generischer Name: Natriumpolystyrolsulfonat
Darreichungsform: oral, rektal Pulver
Medizinisch überprüft von Drugs.com . Zuletzt aktualisiert am September 21, 2020.
- Übersicht
- Nebenwirkungen
- Dosierung
- Fachmann
- Wechselwirkungen
- Mehr
- Kalexatpulver Beschreibung
- Kalexatpulver – Klinische Pharmakologie
- Indikationen und Verwendung für Kalexatpulver
- Kontraindikationen
- Warnungen
- Vorsichtsmaßnahmen
- Arzneimittelwechselwirkungen
- Stillende Mütter
- Pädiatrische Anwendung
- Nebenwirkungen
- Überdosierung
- Kalexatpulver Dosierung und Verabreichung
- Wie wird Kalexatpulver geliefert
- PAKET LABEL.PRINCIPAL DISPLAY PANEL
- Mehr über Kalexat (Natriumpolystyrolsulfonat)
- Verbraucher ressourcen
- Professionelle ressourcen
- Verwandte behandlung guides
Kalexatpulver Beschreibung
Natriumpolystyrolsulfonat, USP, ist ein Benzol, Diethenyl-Polymer, mit Ethenylbenzol, sulfoniert, Natriumsalz und hat die folgende Strukturformel:
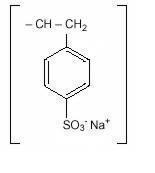
Das Arzneimittel ist eine cremefarbene bis hellbraune, fein gemahlene Pulverform von Natriumpolystyrolsulfonat, einem in der Natriumphase hergestellten Kationenaustauscherharz mit einer In-vitro-Austauschkapazität von ungefähr 3.1 mEq (in vivo ungefähr 1 mEq) Kalium pro Gramm. Der Natriumgehalt beträgt ungefähr 100 mg (4,1 mEq) pro Gramm des Arzneimittels. Es kann oral oder in einem Einlauf verabreicht werden.
Kalexatpulver – Klinische Pharmakologie
Wenn das Harz nach Verabreichung durch Einlauf den Darm passiert oder im Dickdarm zurückgehalten wird, werden die Natriumionen teilweise freigesetzt und durch Kaliumionen ersetzt. Zum größten Teil tritt diese Wirkung im Dickdarm auf, der Kaliumionen stärker ausscheidet als der Dünndarm. Die Effizienz dieses Prozesses ist begrenzt und unvorhersehbar variabel. Es nähert sich üblicherweise der Größenordnung von 33 Prozent, aber der Bereich ist so groß, dass endgültige Indizes des Elektrolythaushalts klar überwacht werden müssen.
Metabolische Daten sind nicht verfügbar.
Indikationen und Verwendung für Kalexatpulver
Natriumpolystyrolsulfonat, USP ist zur Behandlung von Hyperkaliämie indiziert.
Kontraindikationen
Natriumpolystyrolsulfonat, USP ist unter folgenden Bedingungen kontraindiziert: patienten mit Hypokaliämie, Patienten mit Überempfindlichkeit gegen Polystyrolsulfonatharze in der Vorgeschichte, obstruktive Darmerkrankungen, Neugeborene mit eingeschränkter Darmmotilität (postoperativ oder arzneimittelinduziert) und orale Verabreichung bei Neugeborenen (siehe VORSICHTSMAßNAHMEN).
Warnungen
Darmnekrose: Fälle von Darmnekrose, die tödlich sein können, und andere schwerwiegende gastrointestinale unerwünschte Ereignisse (Blutungen, ischämische Kolitis, Perforation) wurden in Verbindung mit Natriumpolystyrolsulfonat, USP, berichtet. In der Mehrzahl dieser Fälle wurde über die gleichzeitige Anwendung von Sorbit berichtet. Risikofaktoren für gastrointestinale unerwünschte Ereignisse waren in vielen Fällen vorhanden, einschließlich Frühgeburtlichkeit, Vorgeschichte von Darmerkrankungen oder Operationen, Hypovolämie sowie Niereninsuffizienz und -versagen. Die gleichzeitige Anwendung von Sorbit wird nicht empfohlen (siehe VORSICHTSMAßNAHMEN, Wechselwirkungen mit anderen Arzneimitteln).
* Nur bei Patienten mit normaler Darmfunktion anwenden. Vermeiden Sie die Anwendung bei Patienten, die nach der Operation keinen Stuhlgang hatten.
* Vermeiden Sie die Anwendung bei Patienten, bei denen ein Risiko für Verstopfung oder Impaktion besteht (einschließlich Patienten mit Impaktion in der Vorgeschichte, chronischer Verstopfung, entzündlicher Darmerkrankung, ischämischer Kolitis, vaskulärer intestinaler Atherosklerose, vorheriger Darmresektion oder Darmverschluss).
* Beenden Sie die Anwendung bei Patienten, die Verstopfung entwickeln.
Alternative Therapie bei schwerer Hyperkaliämie
Da eine wirksame Senkung des Serumkaliums mit Natriumpolystyrolsulfonat, USP, Stunden bis Tage dauern kann, kann die Behandlung mit diesem Medikament allein nicht ausreichen, um eine schwere Hyperkaliämie, die mit Zuständen eines schnellen Gewebeabbaus (z. B. Verbrennungen und Nierenversagen) oder einer Hyperkaliämie einhergeht, die so ausgeprägt ist, dass sie einen medizinischen Notfall darstellt, schnell zu korrigieren. Daher sollten andere endgültige Maßnahmen, einschließlich der Dialyse, immer in Betracht gezogen werden und können zwingend erforderlich sein.
Hypokaliämie
Bei der Therapie mit Natriumpolystyrolsulfonat, USP, kann ein schwerwiegender Kaliummangel auftreten. Die Wirkung muss sorgfältig durch häufige Serumkaliumbestimmungen innerhalb jedes Zeitraums von 24 Stunden kontrolliert werden. Da intrazellulärer Kaliummangel nicht immer durch Serumkaliumspiegel reflektiert wird, muss das Niveau, bei dem die Behandlung mit Natriumpolystyrolsulfonat, USP, abgebrochen werden sollte, für jeden Patienten individuell bestimmt werden. Wichtige Hilfsmittel bei dieser Bestimmung sind der klinische Zustand des Patienten und das Elektrokardiogramm. Frühe klinische Anzeichen einer schweren Hypokaliämie sind ein Muster von reizbarer Verwirrung und verzögerten Denkprozessen.
Elektrokardiographisch ist eine schwere Hypokaliämie häufig mit einem verlängerten Q-T-Intervall, einer Erweiterung, Abflachung oder Inversion der T-Welle und prominenten U-Wellen verbunden. Es können auch Herzrhythmusstörungen auftreten, wie vorzeitige atriale, nodale und ventrikuläre Kontraktionen sowie supraventrikuläre und ventrikuläre Tachykardien. Die toxischen Wirkungen von Digitalis sind wahrscheinlich übertrieben. Eine ausgeprägte Hypokaliämie kann sich auch in einer schweren Muskelschwäche manifestieren, die sich manchmal bis zu einer offenen Lähmung erstreckt.
Elektrolytstörungen
Wie alle Kationenaustauscherharze ist Natriumpolystyrolsulfonat, USP, in seinen Wirkungen nicht vollständig selektiv (für Kalium), und kleine Mengen anderer Kationen wie Magnesium und Calcium können auch während der Behandlung verloren gehen. Dementsprechend sollten Patienten, die Natriumpolystyrolsulfonat, USP, erhalten, auf alle anwendbaren Elektrolytstörungen überwacht werden.
Systemische Alkalose
Systemische Alkalose wurde berichtet, nachdem Kationenaustauscherharze oral in Kombination mit nicht resorbierbaren kationenspendenden Antazida und Abführmitteln wie Magnesiumhydroxid und Aluminiumcarbonat verabreicht wurden. Magnesiumhydroxid sollte nicht mit Natriumpolystyrolsulfonat, USP, verabreicht werden. Ein Fall von Grand-Mal-Anfall wurde bei einem Patienten mit chronischer Hypokalzämie des Nierenversagens berichtet, der Natriumpolystyrolsulfonat, USP, mit Magnesiumhydroxid als Abführmittel erhielt. (Siehe VORSICHTSMAßNAHMEN, Wechselwirkungen mit anderen Arzneimitteln.)
Vorsichtsmaßnahmen
Vorsicht ist geboten, wenn Natriumpolystyrolsulfonat, USP, Patienten verabreicht wird, die nicht einmal einen geringen Anstieg der Natriumbelastung tolerieren können (d. H. Schwere Herzinsuffizienz, schwere Hypertonie oder ausgeprägtes Ödem). In solchen Fällen kann eine kompensatorische Einschränkung der Natriumaufnahme aus anderen Quellen angezeigt sein.
Bei klinisch signifikanter Obstipation sollte die Behandlung mit Natriumpolystyrolsulfonat, USP, abgebrochen werden, bis der normale Stuhlgang wieder aufgenommen ist (siehe WARNHINWEISE, Darmnekrose).
Arzneimittelwechselwirkungen
Antazida
Die gleichzeitige orale Verabreichung von Natriumpolystyrolsulfonat, USP, mit nicht resorbierbaren kationenspendenden Antazida und Abführmitteln kann die Kaliumaustauschfähigkeit des Harzes verringern.
Nicht resorbierbare kationenspendende Antazida und Abführmittel
Systemische Alkalose wurde berichtet, nachdem Kationenaustauscherharze oral in Kombination mit nicht resorbierbaren kationenspendenden Antazida und Abführmitteln wie Magnesiumhydroxid und Aluminiumcarbonat verabreicht wurden. Magnesiumhydroxid sollte nicht mit Natriumpolystyrolsulfonat, USP, verabreicht werden. Ein Fall von Grand-Mal-Anfall wurde bei einem Patienten mit chronischer Hypokalzämie des Nierenversagens berichtet, der Natriumpolystyrolsulfonat, USP, mit Magnesiumhydroxid als Abführmittel erhielt.
Darmverschluss aufgrund von Konkretionen von Aluminiumhydroxid in Kombination mit Natriumpolystyrolsulfonat, USP wurde berichtet.
Digitalis
Die toxischen Wirkungen von Digitalis auf das Herz, insbesondere verschiedene ventrikuläre Arrhythmien und A-V-Knotendissoziation, werden wahrscheinlich durch Hypokaliämie übertrieben, selbst angesichts von Serumdigoxinkonzentrationen im „normalen Bereich“. (Siehe WARNHINWEISE).
Sorbitol
Die gleichzeitige Anwendung von Sorbitol mit Natriumpolystyrolsulfonat, USP, wurde mit Fällen von Darmnekrose in Verbindung gebracht, die tödlich sein können. Daher wird die gleichzeitige Anwendung nicht empfohlen. (Siehe WARNHINWEISE).
Lithium
Natriumpolystyrolsulfonat, USP kann die Absorption von Lithium verringern.
Thyroxin
Natriumpolystyrolsulfonat, USP kann die Absorption von Thyroxin verringern.
Karzinogenese, Mutagenese, Beeinträchtigung der Fertilität
Es wurden keine Studien durchgeführt.
Schwangerschaftskategorie C
Mit Natriumpolystyrolsulfonat, USP, wurden keine Reproduktionsstudien an Tieren durchgeführt. Es ist auch nicht bekannt, ob Natriumpolystyrolsulfonat, USP, bei Verabreichung an eine schwangere Frau fetale Schäden verursachen oder die Fortpflanzungsfähigkeit beeinträchtigen kann. Natriumpolystyrolsulfonat, USP sollte einer schwangeren Frau nur verabreicht werden, wenn dies eindeutig erforderlich ist.
Stillende Mütter
Es ist nicht bekannt, ob dieses Arzneimittel in die Muttermilch übergeht. Da viele Medikamente in die Muttermilch übergehen, ist Vorsicht geboten, wenn Natriumpolystyrolsulfonat, USP, einer stillenden Frau verabreicht wird.
Pädiatrische Anwendung
Die Wirksamkeit von Natriumpolystyrolsulfonat, USP bei pädiatrischen Patienten wurde nicht nachgewiesen. Bei Neugeborenen sollte Natriumpolystyrolsulfonat, USP, nicht oral verabreicht werden. Sowohl bei Kindern als auch bei Neugeborenen ist bei rektaler Verabreichung besondere Vorsicht geboten, da eine übermäßige Dosierung oder unzureichende Verdünnung zu einer Impaktion des Harzes führen kann.
Aufgrund des Risikos von Verdauungsblutungen oder Darmnekrosen ist bei Frühgeborenen oder Säuglingen mit niedrigem Geburtsgewicht besondere Vorsicht geboten.
Nebenwirkungen
Natriumpolystyrolsulfonat, USP kann zu Magenreizungen führen. Anorexie, Übelkeit, Erbrechen und Verstopfung können auftreten, insbesondere wenn hohe Dosen verabreicht werden. Außerdem können Hypokaliämie, Hypokalzämie, Hypomagnesiämie und signifikante Natriumretention sowie die damit verbundenen klinischen Manifestationen auftreten (siehe WARNHINWEISE). Gelegentlich entwickelt sich Durchfall. Hohe Dosen bei älteren Personen können fäkale Impaktion verursachen (siehe VORSICHTSMAßNAHMEN). Seltene Fälle von Darmnekrose wurden berichtet. Darmverschluss aufgrund von Konkretionen von Aluminiumhydroxid, wenn es in Kombination mit Natriumpolystyrolsulfonat, USP, verwendet wird, wurde berichtet.
Die folgenden Ereignisse wurden aus weltweiten Erfahrungen nach Markteinführung berichtet:
* Fäkale Impaktion nach rektaler Verabreichung, insbesondere bei Kindern;
* Gastrointestinale Konkretionen (Bezoare) nach oraler Verabreichung;
* Ischämische Kolitis, Ulzerationen oder Nekrosen des Gastrointestinaltrakts, die zu einer Darmperforation führen können; und
* Seltene Fälle von akuter Bronchitis und / oder Bronchopneumonie im Zusammenhang mit Inhalation von Partikeln aus Polystyrolsulfonat.
Überdosierung
Überdosierung kann zu Elektrolytstörungen einschließlich Hypokaliämie, Hypokalzämie und Hypomagnesiämie führen .Biochemische Störungen, die aus einer Überdosierung resultieren, können zu klinischen Anzeichen und Symptomen einer Hypokaliämie führen, einschließlich: Reizbarkeit, Verwirrtheit, verzögerte Denkprozesse, Muskelschwäche, Hyporeflexie, die zu Hirnlähmung und / oder Apnoe führen kann. Tetanie kann auftreten. Elektrokardiographische Veränderungen können mit Hypokaliämie oder Hyperkalzämie übereinstimmen, Herzrhythmusstörungen können auftreten. Es sollten geeignete Maßnahmen ergriffen werden, um die Serumelektrolyte (Kalium, Kalzium, Magnesium) zu korrigieren, und das Harz sollte durch geeignete Verwendung von Abführmitteln oder Einläufen aus dem Verdauungstrakt entfernt werden.
Kalexatpulver Dosierung und Verabreichung
Die Suspension dieses Arzneimittels sollte frisch zubereitet und nicht länger als 24 Stunden gelagert werden.
Die durchschnittliche tägliche Erwachsenendosis des Harzes beträgt 15 g bis 60 g. Dies wird am besten durch die Verabreichung von 15 g (ungefähr 40 Teelöffel) Natriumpolystyrolsulfonat, USP, ein- bis viermal täglich erreicht. Ein Gramm Natriumpolystyrolsulfonat, USP enthält 4,1 mEq Natrium; Ein Teelöffel enthält ungefähr 3,5 g Natriumpolystyrolsulfonat, USP und 15 mEq Natrium. (Ein gehäufter Teelöffel kann bis zu 10 g bis 12 g Natriumpolystyrolsulfonat, USP.) Da die In vivo-Effizienz von Natrium-Kalium-Austauscherharzen etwa 33 Prozent beträgt, wird etwa ein Drittel des tatsächlichen Natriumgehalts des Harzes an den Körper abgegeben.
Bei kleineren Kindern und Säuglingen sollten niedrigere Dosen angewendet werden, wobei eine Rate von 1 mEq Kalium pro Gramm Harz als Berechnungsgrundlage zugrunde gelegt wird.
Jede Dosis sollte als Suspension in einer kleinen Menge Wasser oder, für eine bessere Schmackhaftigkeit, in Sirup verabreicht werden. Die Flüssigkeitsmenge reicht normalerweise von 20 ml bis 100 ml, abhängig von der Dosis, oder kann einfach bestimmt werden, indem 3 ml bis 4 ml pro Gramm Harz zugelassen werden. Angehörige der Gesundheitsberufe sollten bei der Verabreichung dieses Produkts die vollständigen Aspirationsvorkehrungen beachten, z. B. das Aufstellen und Halten des Patienten in einer aufrechten Position, während das Harz verabreicht wird.
Das Harz kann durch einen Kunststoffschlauch in den Magen eingeführt und, falls gewünscht, mit einer Diät gemischt werden, die für einen Patienten mit Nierenversagen geeignet ist.
Das Harz kann auch, wenn auch mit weniger wirksamen Ergebnissen, in einem Einlauf verabreicht werden, der (für Erwachsene) alle sechs Stunden aus 30 g bis 50 g besteht. Jede Dosis wird als warme Emulsion (bei Körpertemperatur) in 100 ml wässriger Lösung verabreicht. Die Emulsion sollte während der Verabreichung vorsichtig gerührt werden. Der Einlauf sollte so lange wie möglich aufbewahrt werden, gefolgt von einem reinigenden Einlauf.
Nach einem anfänglichen Reinigungseinlauf wird ein weicher, großer (Französisch 28) Gummischlauch in einem Abstand von etwa 20 cm in das Rektum eingeführt, wobei die Spitze gut in das Sigma eindringt, und an Ort und Stelle geklebt. Das Harz wird dann in der entsprechenden Menge wässriger Trägersubstanz bei Körpertemperatur suspendiert und durch Schwerkraft eingebracht, während die Partikel durch Rühren in Suspension gehalten werden. Die Suspension wird mit 50 ml oder 100 ml Flüssigkeit gespült, wonach das Röhrchen festgeklemmt und an Ort und Stelle belassen wird. Wenn eine Rückenleckage auftritt, werden die Hüften auf Kissen angehoben oder eine Knie-Brust-Position wird vorübergehend eingenommen. Es kann eine etwas dickere Suspension verwendet werden, wobei jedoch darauf zu achten ist, daß sich keine Paste bildet, da letztere eine stark verminderte Austauschfläche aufweist und insbesondere bei Ablagerung in der Rektalampulle unwirksam ist. Die Suspension wird, wenn möglich, mehrere Stunden im Sigma aufbewahrt. Dann wird der Dickdarm bei Körpertemperatur mit einer nicht natriumhaltigen Lösung gespült, um das Harz zu entfernen. Zwei Liter Spüllösung können erforderlich sein. Die Rückläufe werden ständig durch eine Y-Rohrverbindung abgelassen. Während die Verwendung von Sorbit nicht empfohlen wird, sollte diesem Reinigungseinlauf besondere Aufmerksamkeit geschenkt werden, wenn Sorbit verwendet wurde
Die Intensität und Dauer der Therapie hängen von der Schwere und Resistenz der Hyperkaliämie ab.
Natriumpolystyrolsulfonat, USP sollte nicht erhitzt werden, da dies die Austauscheigenschaften des Harzes verändern kann.
Wie wird Kalexatpulver geliefert
Natriumpolystyrolsulfonat, USP ist als Creme bis hellbraunes, fein gemahlenes Pulver in Gläsern von 1 Pfund (454 g) erhältlich,
NDC 10702-036-45.
Bei 20° bis 25°C (68° bis 77°F) lagern, wobei Auslenkungen zwischen 15° bis 30°C (59° bis 86°F) zulässig sind.
Nur Rx
Hergestellt von:
KVK-TECH INC.
110 Terry Antrieb
Newtown, PA 18940 USA.
Artikel ID # 006067/04
Hersteller der Code: 10702 10/13
PAKET LABEL.PRINCIPAL DISPLAY PANEL
454 g Glasetikett
NDC 10702-036-45
NATRIUMPOLYSTYROLSULFONAT, USP
KATIONENAUSTAUSCHERHARZ
454 g
Nur Rx
Durchschnitt dosis für Erwachsene: 15 g (ca. 40 Teelöffel) ein- bis viermal täglich in Wasser auflösen. Siehe vollständige Verschreibungsinformationen.
Die Wirkung muss sorgfältig durch häufige Serumkaliumbestimmungen innerhalb eines Zeitraums von jeweils 24 Stunden kontrolliert werden. 60 mEq pro 15 g.
Suspension sollte frisch zubereitet und nicht länger als 24 Stunden gelagert werden. In dichten, lichtbeständigen Behältern gemäß der Definition im offiziellen Kompendium dosieren.
Bei 20° bis 25°C (68° bis 77°F) lagern, wobei Auslenkungen zwischen 15° bis 30°C (59° bis 86°F) zulässig sind.
KVK-TECH, INC.

| KALEXATE sodium polystyrene sulfonate powder |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Etikettierer – KVK-Tech, Inc. (173360061)
Registrant –
| Niederlassung | |||
| Name | Adresse | ID/FEI | Vorgänge |
| KVK-Tech, Inc. | 173360061 | HERSTELLUNG(10702-036) | |
Mehr über Kalexat (Natriumpolystyrolsulfonat)
- Nebenwirkungen
- Während der Schwangerschaft oder Stillzeit
- Dosierungsinformationen
- Wechselwirkungen mit anderen Arzneimitteln
- Preis & Gutscheine
- Spanisch
- Arzneimittelklasse: kationenaustauscherharze
- FDA-Warnungen (2)
Verbraucher ressourcen
- Patienten Informationen
Professionelle ressourcen
- Verschreibung Informationen
- Natrium Polystyrol Sulfonat Oral Pulver (FDA)
Andere marken Kayexalate, Kionex
Verwandte behandlung guides
- Hyperkaliämie
Medizinischer Haftungsausschluss