Darreichungsform: Aerosol, Schaum
Medizinisch überprüft von Drugs.com . Zuletzt aktualisiert am 1. September 2019.
- Übersicht
- Nebenwirkungen
- Dosierung
- Professional
- Schwangerschaft
- Mehr
- Indikationen und Verwendung für Ketoconazolschaum
- Dosierung und Anwendung von Ketoconazolschaum
- Dosierungsformen und Stärken
- Gegenanzeigen
- Warnhinweise und Vorsichtsmaßnahmen
- Kontaktsensibilisierung
- Brennbarer Inhalt
- Systemische Wirkungen
- Nebenwirkungen
- Klinische Studienerfahrung
- Dermale Sicherheitsstudien
- Erfahrungen nach Markteinführung
- ANWENDUNG IN BESTIMMTEN BEVÖLKERUNGSGRUPPEN
- Schwangerschaft
- Stillzeit
- Frauen und Männer mit Reproduktionspotenzial
- Pädiatrische Anwendung
- Geriatrische Anwendung
- Ketoconazolschaum Beschreibung
- Ketoconazolschaum – Klinische Pharmakologie
- Wirkungsmechanismus
- Pharmakodynamik
- Pharmakokinetik
- Mikrobiologie
- Nichtklinische Toxikologie
- Karzinogenese, Mutagenese, Beeinträchtigung der Fertilität
- Klinische Studien
- Wie geliefert / Lagerung und Handhabung
- Informationen zur Patientenberatung
- Gebrauchsanweisung
- PATIENTENINFORMATION
- VERPACKUNG /ETIKETT – ANZEIGETAFEL – KARTON
- Mehr über Ketoconazol topisch)
- Consumer resources
- Professional resources
- Related treatment guides
Indikationen und Verwendung für Ketoconazolschaum
Ketoconazolschaum, 2% ist angegeben zur topischen Behandlung von seborrhoischer Dermatitis bei immunkompetenten Patienten ab 12 Jahren.
Anwendungsbeschränkungen
Sicherheit und Wirksamkeit von Ketoconazolschaum, 2% zur Behandlung von Pilzinfektionen wurden nicht nachgewiesen.
Dosierung und Anwendung von Ketoconazolschaum
Ketoconazolschaum, 2% sollte vier Wochen lang zweimal täglich auf die betroffenen Stellen aufgetragen werden.
Halten Sie den Behälter aufrecht und geben Sie 2% Ketoconazolschaum in die Kappe der Dose oder eine andere kühle Oberfläche in einer Menge, die ausreicht, um die betroffenen Bereiche abzudecken. Das direkte Auftragen auf die Hände wird nicht empfohlen, da der Schaum bei Kontakt mit warmer Haut sofort zu schmelzen beginnt. Nehmen Sie kleine Mengen Ketoconazolschaum (2%) mit den Fingerspitzen auf und massieren Sie ihn sanft in die betroffenen Stellen ein, bis der Schaum verschwindet. Für haar-lager bereichen, teil die haar, so dass Ketoconazol Schaum, 2% kann angewendet werden direkt auf die haut (eher als auf die haar).
Kontakt mit den Augen und anderen Schleimhäuten vermeiden. Ketoconazolschaum, 2% ist nicht zur ophthalmischen, oralen oder intravaginalen Anwendung bestimmt.
Dosierungsformen und Stärken
Ketoconazolschaum, 2% enthält 20 mg Ketoconazol, USP pro Gramm, geliefert in 50 g und 100 g Behältern.
Gegenanzeigen
Keine.
Warnhinweise und Vorsichtsmaßnahmen
Kontaktsensibilisierung
Ketoconazolschaum, 2% kann zu Kontaktsensibilisierung, einschließlich Photoallergenität, führen.
Brennbarer Inhalt
Der Inhalt von Ketoconazolschaum, 2%, umfasst Alkohol und Propan / Butan, die brennbar sind. Vermeiden Sie Feuer, Flammen und/oder Rauchen während und unmittelbar nach der Anwendung. Die Behälter nicht durchstechen und/oder verbrennen. Behälter keiner Hitze aussetzen und / oder bei Temperaturen über 49 ° C (120 ° F) lagern.
Systemische Wirkungen
Bei oral verabreichtem Ketoconazol wurde Hepatitis beobachtet (1:10.000 gemeldete Inzidenz). Bei hohen Dosen von oral verabreichtem Ketoconazol wurden niedrigere Testosteron– und ACTH-induzierte Corticosteroid-Serumspiegel beobachtet. Diese Effekte wurden bei topischem Ketoconazol nicht beobachtet.
Nebenwirkungen
Klinische Studienerfahrung
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in klinischen Studien mit einem Arzneimittel beobachteten Nebenwirkungsraten nicht direkt mit den in klinischen Studien mit einem anderen Arzneimittel beobachteten Raten verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider. Die Informationen über Nebenwirkungen aus klinischen Studien liefern jedoch eine Grundlage für die Identifizierung der Nebenwirkungen, die mit dem Drogenkonsum in Zusammenhang zu stehen scheinen, und für die Annäherung der Raten.
Die Sicherheitsdaten in Tabelle 1 spiegeln die Exposition gegenüber Ketoconazolschaum wider, 2% bei 672 Probanden ab 12 Jahren mit seborrhoischer Dermatitis. Die Probanden applizierten 4 Wochen lang zweimal täglich Ketoconazolschaum, 2% oder Vehikelschaum auf die betroffenen Stellen im Gesicht, auf der Kopfhaut und / oder auf der Brust. Nebenwirkungen, die bei > 1% der Probanden auftraten, sind in Tabelle 1 aufgeführt.
Tabelle 1: Nebenwirkungen berichtet von >1% Probanden in klinischen Studien
|
Nebenwirkungen |
Ketoconazolschaum, 2% N=672 n (%) |
Fahrzeug Schaum N=497 n (%) |
|
Probanden mit einer Nebenwirkung |
188 (28%) |
122 (25%) |
|
Anwendung website brennen |
67 (10%) |
49 (10%) |
|
Reaktion an der Applikationsstelle |
41 (6%) |
24 (5%) |
Reaktionen an der Applikationsstelle, die bei < 1% der Probanden berichtet wurden, waren Trockenheit, Erythem, Reizung, Parästhesie, Pruritus, Hautausschlag und Wärme.
Dermale Sicherheitsstudien
In einer Photoallergenitätsstudie hatten 9 von 53 Probanden (17%) während des Challenge-Zeitraums Reaktionen sowohl an bestrahlten als auch an nicht bestrahlten Stellen, die mit Ketoconazolschaum behandelt wurden, 2%. Ketoconazolschaum, 2% kann Kontaktsensibilisierung verursachen.
Erfahrungen nach Markteinführung
Die folgenden unerwünschten Ereignisse wurden während der Anwendung von Ketoconazol nach Markteinführung festgestellt:, 2%:
Gastrointestinale Erkrankungen: Cheilitis
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort: Schmerzen an der Applikationsstelle und Verbrennungen an der Applikationsstelle
Erkrankungen der Haut und des Unterhautzellgewebes: Brennen und Erythem der Haut
Da diese Ereignisse freiwillig aus einer Population unsicherer Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
ANWENDUNG IN BESTIMMTEN BEVÖLKERUNGSGRUPPEN
Schwangerschaft
Risikozusammenfassung
Es liegen keine Daten zur Anwendung von Ketoconazol 1, 2% bei Schwangeren vor, um ein arzneimittelassoziiertes Risiko für schwere Geburtsfehler, Fehlgeburten oder nachteilige Ergebnisse bei Mutter und Kind zu identifizieren. Es wurden keine Reproduktionsstudien an Tieren mit Ketoconazolschaum, 2%, durchgeführt. In tierexperimentellen Reproduktionsstudien mit trächtigen Mäusen, Ratten und Kaninchen wurden nach oraler Gabe von Ketoconazol während der Organogenese sowohl embryotoxische als auch entwicklungsbedingte Wirkungen (strukturelle Anomalien) beobachtet. Unter der Annahme einer äquivalenten systemischen Resorption von topischen und oralen Ketoconazoldosen und einer Ketoconazoldosis von 2% der empfohlenen maximalen Humandosis (MRHD) von 8 g (entsprechend 160 mg Ketoconazol) wurden embryotoxische Wirkungen beim 0, 8- bis 2, 4-fachen der MRHD beobachtet und Entwicklungseffekte wurden bei 4 beobachtet.8 mal die MRHD .
Das Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere nachteilige Folgen. In der US-amerikanischen Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften bei 2 bis 4% bzw. 15 bis 20%.
Daten
Tierdaten
Die Tiervervielfachen der Expositionsberechnungen für den Menschen basieren auf Vergleichen der Körperoberfläche (BSA) der oralen Dosen, die Tieren verabreicht wurden, und einer Ketoconazol-Schaum, 2% maximale empfohlene Humandosis (MRHD) von 8 Gramm (entspricht 2,67 mg Ketoconazol / kg / Tag für eine 60 kg schwere Person oder 98,8 mg Ketoconazol / m2 / Tag).
Studien zur embryofetalen Entwicklung wurden an Mäusen, Ratten und Kaninchen mit oral verabreichtem Ketoconazol durchgeführt. Bei oraler Verabreichung an Mäuse an den Gestationstagen 6 bis 18 (über den Zeitraum der Organogenese) war Ketoconazol embryotoxisch (25 mg / kg und höher; 0, 8-fache der MRHD basierend auf BSA-Vergleichen) mit einer hohen Inzidenz von Resorptionen, einer erhöhten Anzahl von Totgeburten und einer verzögerten Geburt. Verzögerungen in der Reifung wurden ebenfalls beobachtet. Es gab keine Hinweise auf maternale Toxizität oder Missbildungen bei bis zu 50 mg / kg (1,5-fache der MRHD basierend auf BSA-Vergleichen). Bei 10 mg / kg (0, 3-fache der MRHD basierend auf BSA-Vergleichen) wurden keine behandlungsbedingten Entwicklungseffekte beobachtet.
Bei Vorliegen einer maternalen Toxizität bei Ratten war oral verabreichtes Ketoconazol sowohl embryotoxisch (40 mg / kg und höher; 2,4-fache der MRHD basierend auf BSA-Vergleichen), einschließlich erhöhter resorbierter Föten und Totgeburten, als auch teratogen (80 mg / kg und höher; 4,8-fache der MRHD basierend auf BSA-Vergleichen), einschließlich Syndaktylien, Oligodaktylien, Wellenrippen und Gaumenspalte. Zusätzlich waren 100 mg / kg (6-fache MRHD basierend auf BSA-Vergleichen) Ketoconazol, das an einem einzigen Tag während der Trächtigkeit (Schwangerschaftstage 9 bis 12) oral verabreicht wurde, embryotoxisch (erhöhte Resorptionen). Dieselbe orale Dosis, die am 12., 13., 14. oder 15. Schwangerschaftstag verabreicht wurde, verursachte äußere Missbildungen einschließlich Gaumenspalte, Mikromelie und digitale Anomalien (Brachydaktylie, Ektrodaktylie, Syndaktylie).
Bei trächtigen Kaninchen, denen Ketoconazol oral verabreicht wurde, wurden Hinweise auf Embryotoxizität (erhöhte Resorptionen) bei 10 mg / kg (1,2-fache der MRHD basierend auf BSA-Vergleichen) und höher beobachtet, und eine erhöhte Inzidenz von Skelettanomalien wurde bei 40 mg / kg (4,8-fache der MRHD basierend auf BSA-Vergleichen) beobachtet.
Stillzeit
Risikoübersicht
Es liegen keine Informationen über das Vorhandensein von Ketoconazol in der Muttermilch oder die Auswirkungen auf das gestillte Kind oder die Auswirkungen auf die Milchproduktion nach topischer Anwendung von Ketoconazolschaum vor, 2% bei stillenden Frauen. In tierexperimentellen Studien wurde Ketoconazol nach oraler Verabreichung in der Milch gefunden. Die entwicklungs- und gesundheitlichen Vorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an Ketoconazolschaum 2% und möglichen nachteiligen Auswirkungen von Ketoconazolschaum 2% oder der zugrunde liegenden Erkrankung der Mutter auf das gestillte Kind berücksichtigt werden.
Frauen und Männer mit Reproduktionspotenzial
Unfruchtbarkeit
In tierexperimentellen Fertilitätsstudien an Ratten und Hunden führte die Verabreichung oraler Dosen von Ketoconazol zwischen 3 Tagen und 3 Monaten zu einer Unfruchtbarkeit, die reversibel war .
Pädiatrische Anwendung
Die Sicherheit und Wirksamkeit von Ketoconazolschaum, 2% bei pädiatrischen Patienten unter 12 Jahren, wurde nicht nachgewiesen.
Von den 672 mit Ketoconazolschaum behandelten Probanden, 2% in den klinischen Studien, waren 44 (7%) zwischen 12 und 17 Jahre alt. .
Geriatrische Anwendung
Von den 672 mit Ketoconazolschaum behandelten Probanden, 2% in den klinischen Studien, waren 107 (16%) 65 Jahre und älter.
Klinische Studien mit Ketoconazol schlossen bei 2% keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie anders ansprechen als jüngere Probanden.
Ketoconazolschaum Beschreibung
Ketoconazolschaum, 2% enthält 2% Ketoconazol USP, ein Antimykotikum, in einem thermolabilen hydroethanolischen Schaum zur topischen Anwendung.
Die chemische Bezeichnung für Ketoconazol lautet Piperazin, 1-Acetyl-4-methoxy]phenyl]-, cis- mit der Summenformel C26H28CI2N4O4 und einem Molekulargewicht von 531,43.
Die folgenden ist die chemische struktur:
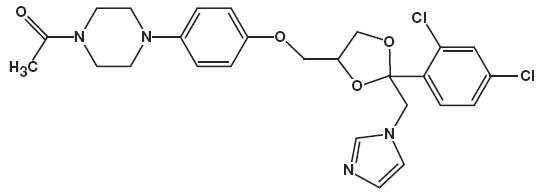
Ketoconazolschaum, 2% enthält 20 mg Ketoconazol pro Gramm in einem thermolabilen hydroethanolischen Schaumvehikel, bestehend aus Cetylalkohol, Zitronensäure, Ethanol (denaturiert mit Tert.-Butylalkohol und Brucinsulfat) 58%, Polysorbat 60, Kaliumcitrat, Propylenglykol, gereinigtes Wasser und Stearylalkohol unter Druck mit einem Kohlenwasserstoff (Propan / Butan) Treibmittel.
Ketoconazolschaum – Klinische Pharmakologie
Wirkungsmechanismus
Der Wirkungsmechanismus von Ketoconazol bei der Behandlung von seborrhoischer Dermatitis ist nicht bekannt.
Pharmakodynamik
Die Pharmakodynamik von Ketoconazolschaum, 2%, wurde nicht nachgewiesen.
Pharmakokinetik
In einer Bioverfügbarkeitsstudie applizierten 12 Probanden mit mittelschwerer bis schwerer seborrhoischer Dermatitis 4 Wochen lang zweimal täglich 3 g Ketoconazolschaum, 2%. Die zirkulierenden Plasmaspiegel von Ketoconazol betrugen bei der Mehrzahl der Probanden (75%) < 6 ng / ml, wobei bei einem Probanden ein Höchstwert von 11 ng / ml beobachtet wurde.
Mikrobiologie
Ketoconazol ist ein Antimykotikum, das die In-vitro-Synthese von Ergosterol, einem wichtigen Sterol in der Zellmembran von Malassezia furfur, hemmt. Die klinische Bedeutung der antimykotischen Aktivität bei der Behandlung von seborrhoischer Dermatitis ist nicht bekannt.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fertilität
Es wurden keine Langzeitstudien an Tieren durchgeführt, um das karzinogene oder photokarzinogene Potenzial von Ketoconazolschaum, 2%, zu bewerten.
In oralen Karzinogenitätsstudien an Mäusen (18 Monate) und Ratten (24 Monate) war Ketoconazol bei Dosierungen von 5, 20 und 80 mg/kg/Tag nicht karzinogen. Die hohe Dosis in diesen Studien betrug ungefähr das 2,4- bis 4,8-fache der MRHD, basierend auf BSA-Vergleichen. In einem bakteriellen Reverse-Mutation-Assay exprimierte Ketoconazol kein mutagenes Potenzial. In drei In-vivo-Tests (Schwesterchromatidenaustausch beim Menschen, Dominant Letal- und Mikronukleustests bei Mäusen) zeigte Ketoconazol kein genotoxisches Potenzial.
In tierexperimentellen Fertilitätsstudien beeinträchtigte orales Ketoconazol sowohl die männliche als auch die weibliche Fertilität bei Ratten in dosis- und dauerabhängiger Weise. Bei Frauen hatten orale Dosen von bis zu 40 mg / kg (das 2,4-fache der MRHD basierend auf BSA-Vergleichen) keinen Einfluss auf die Fertilität, während Dosen von 75 mg / kg (das 4,5-fache der MRHD basierend auf BSA-Vergleichen) und höher die Schwangerschaftsrate und die Anzahl der Implantationsstellen verringerten. Bei männlichen Ratten verringerte die orale Gabe von 200 mg / kg / Tag (12-fache der MRHD basierend auf BSA-Vergleichen) über drei Tage die Fertilität und 400 mg / kg / Tag (24-fache der MRHD basierend auf BSA-Vergleichen) über drei Tage führte zu einem vollständigen Verlust der Fertilität. Bei längerer Verabreichung (bis zu 3 Monate) wurde bei männlichen Ratten eine verminderte Fertilität bei Dosen von nur 24 mg / kg / Tag beobachtet (1, 4-fache der MRHD basierend auf BSA-Vergleichen). Bei männlichen Beagle-Hunden wurde eine orale Dosis von 25 mg/kg/Tag Ketoconazol für bis zu 4 Wochen (5.2-fache der MRHD basierend auf BSA-Vergleichen) führte zu einer verminderten Spermienmotilität, einer verringerten Spermienzahl, einer erhöhten abnormalen Spermienzahl und einer Atrophie der Hoden. Diese Effekte wurden nach Absetzen der Behandlung umgekehrt.
Klinische Studien
Die Sicherheit und Wirksamkeit von Ketoconazolschaum, 2%, wurde in einer randomisierten, doppelblinden, vehikelkontrollierten Studie bei Probanden ab 12 Jahren mit leichter bis schwerer seborrhoischer Dermatitis bewertet. In der Studie erhielten 427 Probanden Ketoconazolschaum, 2% und 420 Probanden Vehikelschaum. Die Probanden applizierten 4 Wochen lang zweimal täglich Ketoconazolschaum, 2% oder Vehikelschaum auf die betroffenen Stellen im Gesicht, auf der Kopfhaut und / oder auf der Brust. Der Gesamtschweregrad der Erkrankung in Bezug auf Erythem, Skalierung und Verhärtung wurde zu Studienbeginn und in Woche 4 auf einer 5-Punkte-ISGA-Skala (Static Global Assessment) des Prüfarztes bewertet.
Der Behandlungserfolg wurde definiert als das Erreichen eines ISGA-Scores in Woche 4 (Ende der Behandlung) von 0 (klar) oder 1 (die Mehrheit der Läsionen hat individuelle Scores für Skalierung, Erythem und Verhärtung, die im Durchschnitt 1 betragen) und mindestens zwei Grade der Verbesserung gegenüber dem Ausgangswert. Die Ergebnisse sind in Tabelle 2 dargestellt. Die Datenbank war nicht groß genug, um zu beurteilen, ob es Unterschiede in den Auswirkungen in Alter, Geschlecht oder Rasse Untergruppen.
Tabelle 2: Wirksamkeitsergebnisse
|
Anzahl der Probanden |
Ketoconazolschaum, 2% N = 427 n (%) |
Fahrzeug Schaum N = 420 n (%) |
|
Probanden erzielen Behandlungserfolg |
239 (56%) |
176 (42%) |
Wie geliefert / Lagerung und Handhabung
Ketoconazolschaum, 2% enthält 20 mg Ketoconazol, USP pro Gramm. Der thermolabile hydroethanolische Schaum ist wie folgt erhältlich:
NDC 45802-532-32
50 g Aluminiumdose
NDC 45802-532-33
100 g Aluminiumdose
Bei 20° bis 25°C lagern 68° bis 77°F). .
Nicht gekühlt lagern.
Der Inhalt ist entflammbar. Behälter keiner Hitze aussetzen und/oder bei Temperaturen über 49°C (120°F) lagern. Nicht in direktem Sonnenlicht lagern.
Inhalt unter Druck. Behälter nicht durchstechen und/oder verbrennen.
Darf nicht in die Hände von Kindern gelangen.
Informationen zur Patientenberatung
Siehe FDA-zugelassene Patientenetikettierung (Patientenpackungsbeilage).
Instruieren Sie die Patienten über die richtige Anwendung von Ketoconazolschaum, 2%.
* Vermeiden Sie Feuer, Flammen und/oder Rauchen während und unmittelbar nach der Anwendung. * Ketoconazolschaum, 2% nicht direkt auf die Hände auftragen. Auf eine kühle Oberfläche geben und mit den Fingerspitzen auf die betroffenen Stellen auftragen. * Waschen Sie sich nach der Anwendung die Hände • Ketoconazolschaum, 2% kann Hautreizungen verursachen (Brennen und / oder Reaktionen an der Applikationsstelle) • Weisen Sie einen Patienten an, sich an einen Arzt zu wenden, wenn der Anwendungsbereich Anzeichen einer erhöhten Reizung aufweist, und melden Sie Anzeichen von Nebenwirkungen.
Hergestellt in Israel
Hergestellt von Perrigo
Yeruham, Israel
Vertrieben von
Perrigo®
Allegan, MI 49010
www.perrigo.com
Rev 08-18
5K200RCJ3
Gebrauchsanweisung
Ketoconazolschaum, 2%
Wichtige Informationen: Ketoconazolschaum, 2% ist nur zur Anwendung auf der Haut bestimmt. Verwenden Sie keinen Ketoconazolschaum, 2% in Ihren Augen, Mund oder Vagina.
Schritt 1: Entfernen Sie die klare Kappe vom Ketoconazolschaum, 2% Dose.
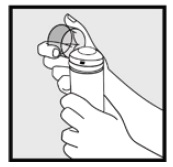
Schritt 2: Halten Sie die Dose aufrecht und drücken Sie die Düse fest, um Ketoconazolschaum, 2%, in die klare Kappe zu geben. * Geben Sie genügend Ketoconazolschaum (2%) ab, um den gesamten betroffenen Bereich abzudecken.
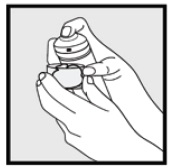
• Wenn die Dose warm oder der Schaum flüssig erscheint, lassen Sie die Dose unter kaltem Wasser laufen.
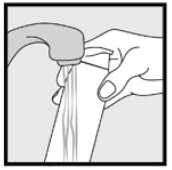
Schritt 3: Nehmen Sie kleine Mengen Ketoconazolschaum, 2%, mit den Fingerspitzen auf und reiben Sie den Schaum vorsichtig in die betroffenen Stellen, bis der Schaum verschwindet.
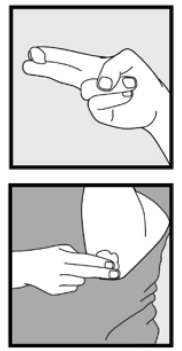
• Wenn Sie Bereiche wie Ihre Kopfhaut behandeln, teilen Sie das Haar so, dass Ketoconazolschaum, 2%, direkt auf die Haut aufgetragen werden kann.

Schritt 4: Waschen Sie Ihre Hände nach dem Auftragen von Ketoconazolschaum, 2%. * Werfen Sie unbenutzte Arzneimittel, die sich noch in der Verschlusskappe befinden, weg.
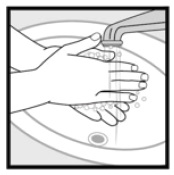
Wie soll ich Ketoconazolschaum, 2% lagern?
* Lagern Sie Ketoconazol Foam, 2% bei Raumtemperatur zwischen 68 ° F und 77 °F (20 ° C bis 25 ° C). * Lagern Sie den Ketoconazolschaum nicht, 2% Dose im Kühlschrank oder Gefrierschrank. * Halten Sie Ketoconazolschaum, 2% weg von Hitze. Werfen Sie die Dose niemals ins Feuer, auch wenn die Dose leer ist. * Lagern Sie Ketoconazol Foam, 2% nicht bei Temperaturen über 49 ° C (120 ° F). * Den Ketoconazolschaum nicht durchbrechen (punktieren), 2% Dose.
Ketoconazolschaum, 2% und alle Arzneimittel außerhalb der Reichweite von Kindern aufbewahren.
Diese Gebrauchsanweisung wurde von der U.S. Food and Drug Administration genehmigt.
Nur Rx
Hergestellt in Israel
Hergestellt von Perrigo
Yeruham, Israel
Vertrieben von
Perrigo®
Allegan, MI 49010
www.perrigo.com
Rev 08-18
PATIENTENINFORMATION
Ketoconazolschaum, 2%
Wichtige Information: Ketoconazolschaum, 2% ist nur zur Anwendung auf der Haut bestimmt. Verwenden Sie keinen Ketoconazolschaum, 2% in Ihren Augen, Mund oder Vagina.
Was ist Ketoconazolschaum, 2%?
Ketoconazolschaum, 2% ist ein verschreibungspflichtiges Arzneimittel, das auf der Haut (topisch) zur Behandlung von seborrhoischer Dermatitis bei Personen ab 12 Jahren mit normalem Immunsystem angewendet wird.
Es ist nicht bekannt, ob Ketoconazolschaum, 2%, bei der Behandlung von Pilzinfektionen sicher und wirksam ist.
Es ist nicht bekannt, ob Ketoconazolschaum 2% bei Kindern unter 12 Jahren sicher und wirksam ist.
Informieren Sie vor der Anwendung von Ketoconazolschaum, 2%, Ihren Arzt über alle Ihre Erkrankungen, auch wenn Sie:
• schwanger sind oder eine Schwangerschaft planen. Es ist nicht bekannt, ob Ketoconazolschaum, 2%, Ihrem ungeborenen Kind schadet. * stillen oder planen zu stillen. Es ist nicht bekannt, ob Ketoconazolschaum, 2% in Ihre Muttermilch übergeht. Sprechen Sie mit Ihrem Arzt darüber, wie Sie Ihr Baby während der Behandlung mit Ketoconazolschaum, 2%, am besten füttern können.
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und pflanzlicher Nahrungsergänzungsmittel.
Wie soll ich Ketoconazolschaum, 2% verwenden?
* Verwenden Sie Ketoconazolschaum, 2% genau so, wie Ihr Arzt es Ihnen sagt. In der detaillierten „Gebrauchsanweisung“ am Ende dieser Packungsbeilage finden Sie Anweisungen zum richtigen Auftragen von Ketoconazolschaum, 2%. * Tragen Sie Ketoconazol-Schaum, 2% auf die betroffene(n) Hautstelle (n) 2 mal täglich für 4 Wochen auf. Sie sollten genügend Ketoconazolschaum (2%) auftragen, um den gesamten betroffenen Bereich abzudecken. * Sprechen Sie mit Ihrem Arzt, wenn sich Ihre Haut nach 4-wöchiger Behandlung mit Ketoconazolschaum, 2%, nicht bessert. * Geben Sie Ketoconazolschaum, 2% direkt in die Kappe. Geben Sie Ketoconazolschaum 2% nicht direkt auf Ihre Hände, da der Schaum bei Kontakt mit warmer Haut zu schmelzen beginnt. * Waschen Sie Ihre Hände nach dem Auftragen von Ketoconazolschaum, 2%.
Was sollte ich bei der Anwendung von Ketoconazolschaum, 2% vermeiden?
* Ketoconazolschaum, 2% ist entflammbar. Vermeiden Sie Feuer, Flammen oder Rauchen während und direkt nach dem Auftragen von Ketoconazol Foam, 2% auf Ihre Haut. * Vermeiden Sie Ketoconazolschaum, 2% in oder in der Nähe von Augen, Mund, Lippen oder Vagina. Wenn Sie Ketoconazolschaum, 2%, auf Ihre Lippen oder in Ihre Augen, Ihren Mund oder Ihre Vagina bekommen, spülen Sie ihn gut mit Wasser aus.
Was sind die möglichen Nebenwirkungen von Ketoconazolschaum, 2%?
Ketoconazolschaum, 2% kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
* Hautreizungen an der/den Applikationsstelle(n), einschließlich Hautreaktionen durch Lichteinwirkung. Informieren Sie Ihren Arzt, wenn Sie während der Behandlung mit Ketoconazolschaum, 2%, Hautreizungen entwickeln.
Zu den häufigsten Nebenwirkungen von Ketoconazolschaum, 2% gehören Brennen, Trockenheit, Rötung, Reizung, Taubheitsgefühl, Juckreiz, Hautausschlag und Wärme an der Applikationsstelle.
Dies sind nicht alle möglichen Nebenwirkungen von Ketoconazolschaum, 2%.
Rufen Sie Ihren Arzt an, um ärztlichen Rat zu Nebenwirkungen zu erhalten. Sie können Nebenwirkungen bei der FDA unter 1-800-FDA-1088 melden.
Wie sollte ich Ketoconazolschaum, 2% lagern?
* Lagern Sie Ketoconazol Foam, 2% bei Raumtemperatur zwischen 68 ° F und 77 °F (20 ° C bis 25 ° C). * Lagern Sie den Ketoconazolschaum nicht, 2% Dose im Kühlschrank oder Gefrierschrank. * Halten Sie Ketoconazolschaum, 2% weg von Hitze. Werfen Sie niemals den Ketoconazolschaum, 2% Dose in ein Feuer, auch wenn die Dose leer ist. * Lagern Sie Ketoconazol Foam, 2% nicht bei Temperaturen über 49 ° C (120 ° F). * Den Ketoconazolschaum nicht durchbrechen (punktieren), 2% Dose. Bewahren Sie Ketoconazolschaum, 2% und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von Ketoconazolschaum, 2%.
Arzneimittel werden manchmal zu anderen als den in der Packungsbeilage aufgeführten Zwecken verschrieben. Verwenden Sie keinen Ketoconazolschaum, 2% für einen Zustand, für den es nicht verschrieben wurde. Geben Sie Ketoconazol 1, 2% nicht an andere Personen weiter, auch wenn diese die gleichen Symptome haben wie Sie. Es kann ihnen schaden. Sie können Ihren Apotheker oder Gesundheitsdienstleister nach Informationen zu Ketoconazolschaum, 2%, fragen, die für Angehörige der Gesundheitsberufe bestimmt sind.
Was sind die Inhaltsstoffe von Ketoconazol Foam, 2%?
Wirkstoff: Ketoconazol
Inaktive Bestandteile: cetylalkohol, Zitronensäure, Ethanol (denaturiert mit Tert-Butylalkohol und Brucinsulfat) 58%, Polysorbat 60, Kaliumcitrat, Propylenglykol, gereinigtes Wasser und Stearylalkohol unter Druck mit einem Kohlenwasserstoff (Propan/Butan) -Treibmittel
Weitere Informationen erhalten Sie bei Perrigo unter 1-866-634-9120
Diese Packungsbeilage wurde von der US-amerikanischen Food and Drug Administration (FDA) und Drug Administration.
VERPACKUNG /ETIKETT – ANZEIGETAFEL – KARTON
Nur Rx
Ketoconazolschaum, 2%
Nur zur topischen Anwendung.
Nicht zur ophthalmischen, oralen oder intravaginalen Anwendung bestimmt.
100 g

Das folgende Bild ist ein Platzhalter, der die Produktidentifikation darstellt, die während des Verpackungsvorgangs entweder auf dem Etikett der Arzneimittelverpackung angebracht oder aufgedruckt wird.

| KETOCONAZOL Ketoconazol Aerosol, Schaum |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
Etikettierer – Perrigo New York Inc (078846912)
Mehr über Ketoconazol topisch)
- Nebenwirkungen
- Während der Schwangerschaft oder Stillzeit
- Dosierungsinformationen
- Alternativen vergleichen
- Preise & Gutscheine
- Spanisch
- 36 Bewertungen
- Medikamentenklasse: topical antifungals
Consumer resources
- Patient Information
- Ketoconazole Topical (Advanced Reading)
Professional resources
- Prescribing Information
- Ketoconazole (Topical) (Professional Patient Advice)
- Ketoconazole Cream (FDA)
- Ketoconazole Shampoo (FDA)
Other brands Nizoral Shampoo, Ketodan, Extina, Xolegel
Related treatment guides
- Seborrheic Dermatitis
- Cutaneous Candidiasis
- Androgenetic Alopecia
- Dandruff
- … +4 mehr
Medizinischer Haftungsausschluss