Weitere Informationen
Literatur
Verwandte Reaktionen
Acetessigestersynthese
Malonsäureestersynthese

Die Kondensation von Kohlenstoffsäureverbindungen mit Aldehyden zu α,β-ungesättigten Verbindungen.
Die in Gegenwart von Carbonsäuregruppen mögliche Doebner-Modifikation schließt eine Pyridin-induzierte Decarboxylierung ein.
Mechanismus der Knoevenagel-Kondensation
Es entsteht zunächst ein Enol-Intermediat:

Dieses Enol reagiert mit dem Aldehyd, und das resultierende Aldol erfährt eine nachfolgende baseninduzierte Elimination:

Eine vernünftige Variation des Mechanismus, bei dem Piperidin als Aminokatalysator wirkt, beinhaltet das entsprechende Iminium-Intermediat als Akzeptor:
Die Doebner-Modifikation im Rückflußpyridin bewirkt konzertierte Decarboxylierung und Elimination:

Aktuelle Literatur

Synthese von Acrylamiden über die Doebner-Knoevenagel-Kondensation
M. J. Zacuto, J. Org. Chem., 2019, 84, 6465-6474.

Einfache und hoch stereoselektive Eintopfsynthese von entweder (E)- oder (Z)-Nitroalkenen
S. Fioravanti, L. Pellacani, P. A. Tardella, M. C. Vergari, Org. Lett., 2008,10, 1449-1451.

Phosphan-katalysierte Knoevenagel-Kondensation: Eine einfache Synthese von α-Cyanacrylaten und α-Cyanacrylnitrilen
J. S. Yadav, B. S. S. Reddy, A. K. Basak, B. Visali, A. V. Narsaiah, K. Nagaiah, Eur. J. Org. Chem., 2004, 546-551.

Rekonstruiertes Hydrotalcit als hochaktiver heterogener Basiskatalysator für Kohlenstoff-Kohlenstoff-Bindungsbildungen in Gegenwart von Wasser
K. Ebitani, K. Motokura, K. Mori, T. Mizugaki, K. Kaneda, J. Org. Chem., 2006, 71, 5440-5447.

Indium(III)-katalysierte Knoevenagel-Kondensation von Aldehyden und aktivierten Methylenen unter Verwendung von Essigsäureanhydrid als Promotor
Y. Ogiwara, K. Takahashi, T. Kitazawa, N. Sakai, J. Org. Chem., 2015,80, 3101-3110.

Die ionische Flüssigkeit 1-Butyl-3-methylimidazoniumtetrafluoroborat BF4 wurde für die ethylendiammoniumdiacetat (EDDA) -katalysierte Knoevenagel-Kondensation zwischen Aldehyden oder Ketonen mit aktiven Methylenverbindungen verwendet. Katalysator und Lösungsmittel können recycelt werden.
C. Su, Z.-C. Chen, Q.-G. Zhen, Synthese, 2003, 555-559.

Ionische Flüssigkeit als Katalysator und Reaktionsmedium – Ein einfaches, effizientes und umweltfreundliches Verfahren zur Knoevenagel-Kondensation von aliphatischen und aromatischen Carbonylverbindungen unter Verwendung einer aufgabenspezifischen basischen ionischen Flüssigkeit
B. C. Ranu, R. Jana, Eur. J. Organisierungstafel. Chem., 2006, 3767-3770.

Organokatalytische Knoevenagel-Kondensationen mittels Carbamidsäure-Ammoniumsalzen
N. Mase, T. Horibe, Org. Lett., 2013,15, 1854-1857.

gem-Dibrommethylarene: Ein bequemer Ersatz für nichtkommerzielle Aldehyde in der Knoevenagel-Doebner-Reaktion zur Synthese von α,β-ungesättigten Carbonsäuren
J. K. Augustine, Y. A. Naik, A. B. Mandal, N. Chowdappa, V. B. Praveen, J. Org. Chem., 2007,72, 9854-9856.
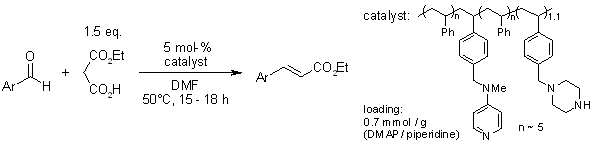
Organokatalytische decarboxylative Doebner-Knoevenagel-Reaktionen zwischen Arylaldehyden und Monoethylmalonat vermittelt durch einen bifunktionellen polymeren Katalysator
J. Lu, P. H. Toy, Synlett, 2011, 1723-1726.

Basisch geförderter Kaskadenansatz zur Herstellung reduzierter Knoevenagel-Addukte unter Verwendung von Hantzsch-Estern als Reduktionsmittel in Wasser
T. He, R. Shi, Y. Gong, G. Jiang, M. Liu, S. Qian, Z. Wang, Synlett, 2016, 27, 1864-1869.

Ein praktisches und bequemes Protokoll für die Synthese von (E)-α,β-ungesättigten Säuren
A. R. Mohite, R. G. Bhat, Org. Lett., 2013,15, 4564-4567.

Ionische Flüssigkeit als Katalysator und Reaktionsmedium – Ein einfaches, effizientes und umweltfreundliches Verfahren zur Knoevenagel-Kondensation von aliphatischen und aromatischen Carbonylverbindungen unter Verwendung einer aufgabenspezifischen basischen ionischen Flüssigkeit
B. C. Ranu, R. Jana, Eur. J. Org. Chem., 2006, 3767-3770.