El glaucoma juvenil de ángulo abierto puede ser una enfermedad difícil de detectar a tiempo y tratar adecuadamente, debido a la naturaleza de la enfermedad en sí, así como a las características de algunos de sus pacientes más jóvenes. Sin embargo, si sabe qué buscar y responde con un tratamiento rápido y eficaz, puede ayudar a salvar la visión del paciente de JOAG. En este artículo, compartiremos nuestros consejos para diagnosticar JOAG y cómo realizar un procedimiento quirúrgico que ofrezca a los pacientes las mejores posibilidades de un resultado exitoso.
JOAG: Lo que sabemos
El glaucoma juvenil de ángulo abierto se considera un subconjunto del glaucoma primario de ángulo abierto, que afecta a aproximadamente 1 de cada 50.000 personas (hombres y mujeres por igual). La definición ha sido controvertida, pero en general tiene en cuenta la edad de aparición. La Sociedad Europea de Glaucoma define JOAG como glaucoma de ángulo abierto con inicio entre las edades de 10 y 35 años.
JOAG demuestra un patrón de herencia autosómico dominante, y la investigación ha encontrado asociaciones entre JOAG y mutaciones genéticas en el cromosoma 1-1q21-q23. Este locus se conoce como GLC1A, y contiene el gen TIGR (respuesta glucocorticoide inducida por malla trabecular) o MYOC,1,2 que codifica para la proteína miocilina. Actualmente se desconoce la función exacta de esta proteína y su implicación en el glaucoma. Se han identificado cuarenta mutaciones del gen TIGR/MIOC en glaucoma de ángulo abierto juvenil y adulto, y los análisis genéticos han revelado que entre el 8 y el 63 por ciento de los pacientes con JOAG tienen una mutación TIGR/MIOC. Los hallazgos comunes entre los pacientes con GAO incluyen el inicio temprano de la enfermedad, una PIO muy alta y un fuerte historial familiar de glaucoma.3,4 El estudio histopatológico de la malla trabecular en pacientes con JOAG realizado por Akihito Tawara, MD de la Universidad de Kyushu, y Hajime Inomata, MD, reveló una malla trabecular anormalmente compacta con una acumulación de material extracelular en los espacios trabeculares.5
Hallazgos clínicos
El glaucoma juvenil de ángulo abierto generalmente es asintomático en sus primeras etapas. A diferencia del glaucoma infantil primario, los signos como el agrandamiento de la córnea y el globo terráqueo, las roturas en la membrana de Descemet, el edema corneal, la epífora y la fotofobia no están presentes en pacientes con el inicio del glaucoma de ángulo abierto en la infancia o la adolescencia posteriores. Los síntomas son poco frecuentes, pero pueden incluir visión borrosa y dolor ocular por presión intraocular elevada. La pérdida visual acompaña a las últimas etapas de la enfermedad y, a menudo, lleva a los pacientes a buscar una evaluación oftálmica. La miopía axial se ha asociado con JOAG. Los signos clínicos incluyen elevación grave de la PIO, a menudo en el rango de 40 a 50 mmHg. Dada la falta de síntomas tempranos, la presentación a menudo es tardía, y la ventosa avanzada del nervio óptico a menudo se nota en la evaluación inicial. Las características gonioscópicas incluyen un ángulo de cámara anterior abierta con inserción de iris alta y procesos de iris prominentes.1 Sin embargo, los discos ópticos y los ángulos de apariencia normal no descartan el diagnóstico de JOAG.
El diagnóstico de JOAG puede ser sencillo en el entorno de una PIO marcadamente elevada y ventosas glaucomatosas del disco óptico. Los casos más difíciles son aquellos adolescentes que presentan una elevación modesta de la PIO y un disco de apariencia saludable. Para ayudar a diagnosticar estos casos más difíciles, tenga en cuenta que los factores de riesgo para la GAO incluyen el género masculino, la miopía y los antecedentes familiares de glaucoma.1 Vigile de cerca a los adolescentes con hipertensión ocular con una evaluación periódica de la PIO, los discos ópticos y los campos visuales. En el momento de la evaluación inicial, obtenga campos visuales de referencia, fotografías estéreo del disco óptico y una evaluación del grosor de la capa de fibra nerviosa retiniana con tomografía de coherencia óptica. A pesar de los limitados datos normativos, las mediciones de OCT son beneficiosas para la evaluación longitudinal y la identificación de la progresión temprana.
Excluir las causas secundarias de glaucoma de ángulo abierto al evaluar a pacientes jóvenes con sospecha de JOAG. Tenga en cuenta que el síndrome de dispersión de pigmentos, la uveítis, el trauma ocular y el uso de esteroides pueden resultar en una PIO elevada y glaucoma, y un buen examen clínico y revisión de los sistemas es importante para descartar cualquier evidencia de estas afecciones.
Tratamiento
Aunque hasta el 83 por ciento de los pacientes con GAO eventualmente requieren intervención quirúrgica7, la terapia médica puede actuar como puente hacia un tratamiento quirúrgico más definitivo. La terapia tópica de primera línea incluye betabloqueantes, análogos de prostaglandinas e inhibidores de la anhidrasa carbónica. Use agonistas alfa con precaución, o evítelos por completo, en pacientes jóvenes con JOAG, ya que se han notificado reacciones adversas potenciales en lactantes y niños pequeños, como bradicardia, hipotensión, hipotermia, hipotonía, apnea y letargo.8
Cuando los medicamentos no logran controlar la PIO, el médico tiene que recurrir a la cirugía. He aquí un vistazo a sus opciones:
* Procedimientos de ángulo. Los procedimientos quirúrgicos basados en ángulos generalmente se realizan primero, y a menudo son efectivos para reducir la PIO y minimizar las posibles complicaciones a corto y largo plazo. La elección entre goniotomía y trabeculotomía depende de la preferencia y experiencia del cirujano.
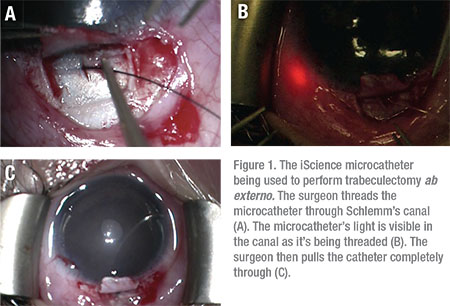
Se ha notificado que la trabeculotomía, a través de un enfoque ab externo, tiene una tasa de éxito de hasta el 86 por ciento en el tratamiento de la GAO, con un 14 por ciento de pacientes que requieren intervención quirúrgica adicional para controlar la PIO.9 La trabeculotomía ab externa se puede utilizar para cortar la malla trabecular a más de 360 grados utilizando una sutura o el microcatéter iScience. (Ver Figura 1)
Se han desarrollado nuevas técnicas quirúrgicas, como la trabeculotomía transluminal asistida por gonioscopia, que también han resultado útiles en esta población de pacientes. Al realizar el procedimiento GATT, el cirujano hace una pequeña goniotomía nasal inicial de 1 a 2 mm y avanza un microcatéter circunferencialmente a través del canal de Schlemm. El catéter se extrae para crear una hendidura de 360 grados. El principal beneficio de los procedimientos de ab interno, como la goniotomía, el GATT y el trabectoma, es que se realizan completamente a través de una incisión corneal, evitando las incisiones conjuntivales y esclerales, y las cicatrices posteriores, por completo.
En los casos en que la cirugía de ángulo no logra controlar la PIO, otras opciones quirúrgicas incluyen procedimientos de drenaje externo, como la trabeculectomía con mitomicina-C y la cirugía de implante de drenaje de glaucoma, así como procedimientos ciclodestructivos.
* Trabeculectomía. Los investigadores han informado tasas de éxito con trabeculectomía que oscilan entre el 50 y el 87 por ciento en pacientes con JOAG.11-14 Obtener y luego mantener un blanqueamiento filtrante que funcione bien en un niño puede ser difícil, ya que los pacientes más jóvenes tienen una respuesta de curación más sólida, lo que a menudo resulta en fibrosis subconjuntival y episcleral progresiva. El manejo postoperatorio, que incluye el cumplimiento de los regímenes de gotas oculares y manipulaciones como la lisis con láser de las suturas de colgajo, es complicado en los niños muy pequeños debido a su incapacidad para cooperar plenamente.
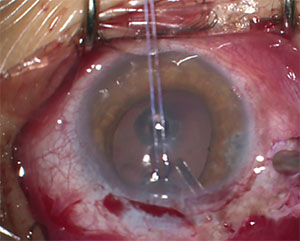
Figura 2. Este niño de 13 años con JOAG requirió la colocación de un dispositivo de drenaje de glaucoma para controlar su PIO.
Algunos médicos han utilizado terapia antifibrosis con MMC para reducir la cantidad de cicatrices en pacientes jóvenes, y este enfoque puede resultar en una PIO más baja después de la trabeculectomía en pacientes con JOAG.11 Sin embargo, el uso de MMC también se ha asociado con un mayor riesgo de complicaciones que ponen en peligro la visión, incluyendo maculopatía por hipotonía e infección relacionada con la bleb. Se ha informado que la tasa de maculopatía por hipotonía es de hasta el 20 por ciento, lo que puede deberse al aumento de la incidencia de miopía axial en estos pacientes.11 Un estudio encontró una incidencia del 17 por ciento de infecciones relacionadas con la bleb en niños con bleb funcionales.12 En vista de estos hallazgos, tenga cuidado al realizar trabeculectomía con MMC en niños más pequeños.
• Implantes de drenaje de glaucoma. Debido a la mayor probabilidad de cicatrización conjuntival en los pacientes con JOAG y al mayor riesgo de complicaciones que ponen en peligro la vista con la trabeculectomía (en pacientes más jóvenes), la cirugía de IDG es una alternativa razonable. Los GDIs más utilizados son la válvula de glaucoma Ahmed (New World Medical, Rancho Cucamonga, California).) e implante de glaucoma Baerveldt (Abbott Medical Optics, Santa Ana, California.). Estudios previos con al menos un año de seguimiento han documentado tasas de éxito después de la cirugía pediátrica de IDG que oscilan entre el 31 y el 97 por ciento.15 Sin embargo, los datos a largo plazo sobre el uso de IDG en niños y adultos jóvenes son limitados.
Otro problema potencial con el IDG en niños es que el posicionamiento adecuado del tubo en la cámara anterior puede ser particularmente difícil. La rigidez escleral reducida en estos pacientes hace que la migración anterior y la rotación de la punta del tubo proximal sean más comunes que en los adultos.16 La migración del tubo puede resultar en contacto directo o proximidad de la punta del tubo a la superficie corneal posterior y puede contribuir a la pérdida de células endoteliales y eventualmente a la descompensación corneal. Se prefiere el posicionamiento del tubo como se muestra en la Figura 2; tenga en cuenta la longitud más larga y la forma en que está en ángulo lejos del endotelio corneal.
Dado que los pacientes con JOAG son jóvenes y a menudo tienen una PIO muy elevada con daño avanzado del disco, nuestra preferencia es utilizar un implante de Baerveldt de 350 mm2. Utilizamos una sutura de poliglactina 7-0 para ligar temporalmente el tubo de este dispositivo sin válvulas y permitir de tres a cuatro semanas que se forme una cápsula alrededor del explante escleral.
Para niños pequeños, realizamos la liberación planificada de ligaduras en el quirófano entre las semanas tres y cuatro del postoperatorio utilizando una lente Hoskins y un láser de diodo verde.17 Facilitamos la visualización de la ligadura para la lisis láser con el uso de tejido corneal como material de injerto de parche. La elevación fluida de la conjuntiva que recubre la placa escleral y el profundo ablandamiento del globo ayudan a confirmar la liberación de la ligadura. Si no está seguro de si se ha liberado la ligadura, puede usar la ecografía de modo B para demostrar la presencia de líquido alrededor de la placa de drenaje.
Para reemplazar el volumen perdido y proporcionar una mayor resistencia al flujo a través del tubo, puede inyectar hialuronato de sodio (10 mg/ml) en la cámara anterior inmediatamente después de la liberación de la ligadura. Esto limita la duración y magnitud de la hipotonía y evita el colapso de la cámara anterior. Para los niños más pequeños, a menudo permitimos que la ligadura se libere espontáneamente, pero los monitorizaremos más de cerca después de las primeras semanas postoperatorias. Para niños mayores y adultos cooperativos, puede realizar la liberación planificada de ligaduras mediante lisis láser seguida de una inyección de hialuronato de sodio en la cámara anterior (10 mg/ml) en el consultorio. Preferimos mantener a los pacientes con atropina al 1% y reducir el número de medicamentos supresores acuosos siempre que sea posible después de la tercera semana postoperatoria en previsión de la apertura del tubo. Estas técnicas pueden ayudar a prevenir períodos prolongados de hipotonía y sus complicaciones secundarias después de la liberación de ligaduras.
Aunque la cirugía de IGD y la trabeculectomía han evolucionado a lo largo de los años con avances en la técnica quirúrgica y mejores formas de modular la cicatrización de heridas, existen desafíos únicos en los pacientes jóvenes con JOAG en comparación con los adultos mayores. La cuidadosa evaluación preoperatoria y el monitoreo posoperatorio, con un seguimiento frecuente y atención a la detección temprana y el manejo de los eventos adversos, pueden mejorar los resultados a largo plazo. REVISIÓN
El Dr. Menezes es médico residente en la Enfermería de Ojos y Oídos de Nueva York del Monte Sinaí. Dr. Panarelli es profesor asistente de oftalmología y director asociado del programa de residencia en la Enfermería de Ojos y Oídos de Nueva York del Monte Sinaí. No tienen ningún interés financiero en ninguno de los productos mencionados.
1. Albert DM, Miller JW, Azar DT, Blodi BA, Cohan JE, Perkins T. Glaucoma Juvenil de Ángulo Abierto. En: Albert & Principios de Jakobiec & Práctica de Oftalmología. 3rd ed. Filadelfia: Elsevier 2008.
2. Bruttini M, Longo I, Frezzotti P, et al. Mutaciones en el gen de la miocilina en familias con glaucoma primario de ángulo abierto y glaucoma juvenil de ángulo abierto. Arch Ophthalmol 2003;121:7:1034-8.
3. Wiggs JL, Allingham RR, Vollrath D, et al. Prevalencia de mutaciones en TIGR/Miocilina en pacientes con glaucoma primario de ángulo abierto adulto y juvenil. Am J Hum Genet 1998; 63:5: 1549-52.
4. Adam MF, Belmouden A, Binisti P, et al. Mutación recurrente en un solo exón que codifica el dominio de homología olfatomedina evolutivamente conservado de TIGR en glaucoma familiar de ángulo abierto. Hum Mol Genet 1997;6:12:2091-7.
5. Tawara A, Inomata H. Developmental immaturity of the trabecular meshwork in juvenile glaucoma. Am J Ophthalmol 1984;15: 98: 82-97.
6. Ko YC, Liu CJ, Chou JC, et al. Comparaciones de factores de riesgo y cambios en el campo visual entre glaucoma de ángulo abierto primario de inicio juvenil y de inicio tardío. Ophthalmologica 2002;216:1:27.
7. Wiggs JL, DelBono EA, Schuman JS, et al. Características clínicas de cinco pedigríes genéticamente vinculados al locus juvenil de glaucoma en el cromosoma 1q21-q31. Ophthalmology 1995; 102: 1782-9.
8. Carlsen JO, Zabriskie NA, Kwon YH, et al. Depresión aparente del sistema nervioso central en bebés después del uso de brimonidina tópica. Am J Ophthalmol 1999; 128: 255-256.
9. Ikeda H, Ishigooka H, Muto T, et al. Resultado a largo plazo de la trabeculotomía para el tratamiento del glaucoma del desarrollo. Arch Ophthalmol 2004; 122: 1122-8.
10. Grover DS, Smith O, Fellman RL, et al. Trabeculotomía transluminal asistida por gonioscopia: Trabeculotomía circunferencial interna ab para el tratamiento del glaucoma congénito primario y el glaucoma juvenil de ángulo abierto. Br J Ophthalmol 2015;99:8:1092-6.
11. Tsai JC, Chang HW, Kao CN, et al. Trabeculectomía con mitomicina C versus trabeculectomía sola para glaucoma de ángulo abierto primario juvenil. Ophthalmologica 2003;217:1:24-30.
12. Sidoti PA, Belmonte SJ, Liebmann JM, Ritch R. Trabeculectomía con mitomicina-c en el tratamiento de glaucomas pediátricos. Oftalmología 2000;107:422-9
13. Groh MJ, Behrens A, Handel A, Kuchle M. Resultados a medio y largo plazo después de la trabeculectomía en pacientes con glaucoma de ángulo abierto juvenil y juvenil tardío. Klin Monatsbl Augenheilkd 2000;217:71-76
14. Aponte EP, Diehl N, Mohney BG. Medical and surgical outcomes in childhood glaucoma: A population-based study (en inglés). J AAPOS 2011; 15: 3: 263-7.
15. Chen TC, Chen PP, Francis BA, et al. Cirugía de glaucoma pediátrico: Un informe de la AAO. Oftalmología 2014:121: 11: 2107.
16. Netland PA. Walton DS. Implantes de drenaje de glaucoma en pacientes pediátricos. Ophthalmic Surg 1993; 24: 723-729.
17. Sidoti PA, Panarelli, JF, Huruta-Dias R, Jardim J, Leon-Rosen J, Rosen RB. Liberación de ligaduras de tubo láser después de la implantación de derivación acuosa en niños pequeños. Ophthalmic Surg Lasers Imaging 2011;42:2:168-9.