Forma de dosificación: aerosol, espuma
Revisado médicamente por Drugs.com. Última actualización el 1 de septiembre de 2019.
- Descripción general
- Efectos secundarios
- Dosis
- Profesional
- Embarazo
- Más
- Indicaciones y uso de Espuma de Ketoconazol
- Dosis y Administración de espuma de Ketoconazol
- Formas farmacéuticas y Concentraciones
- Contraindicaciones
- Advertencias y precauciones
- Sensibilización por contacto
- Contenido inflamable
- Efectos sistémicos
- Reacciones adversas
- Experiencia en ensayos clínicos
- Estudios de seguridad dérmica
- Experiencia postcomercialización
- USO EN POBLACIONES ESPECÍFICAS
- Embarazo
- Lactancia
- Hembras y machos con capacidad reproductiva
- Uso pediátrico
- Uso geriátrico
- Espuma de ketoconazol Descripción
- Espuma de ketoconazol-Farmacología clínica
- Mecanismo de acción
- Farmacodinámica
- Farmacocinética
- Microbiología
- Toxicología no clínica
- Carcinogénesis, Mutagénesis, Alteración de la fertilidad
- Ensayos clínicos
- forma de suministro/Almacenamiento y Manipulación
- Información de Asesoramiento para el paciente
- Instrucciones de Uso
- INFORMACIÓN del PACIENTE
- PANEL DE PRESENTACIÓN PRINCIPAL DEL PAQUETE/ETIQUETA-CAJA DE CARTÓN
- More about ketoconazole topical
- Consumer resources
- Professional resources
- Related treatment guides
Indicaciones y uso de Espuma de Ketoconazol
Espuma de Ketoconazol, el 2% está indicado para el tratamiento tópico de la dermatitis seborreica en pacientes inmunocompetentes de 12 años de edad y mayores.
Limitaciones de uso
No se ha establecido la seguridad y eficacia de la espuma de ketoconazol al 2% para el tratamiento de infecciones fúngicas.
Dosis y Administración de espuma de Ketoconazol
Se debe aplicar espuma de ketoconazol al 2% en la(s) zona (s) afectada (s) dos veces al día durante cuatro semanas.
Sostenga el recipiente en posición vertical y dispense espuma de ketoconazol al 2% en la tapa de la lata u otra superficie fría en una cantidad suficiente para cubrir la(s) zona (s) afectada (s). No se recomienda dispensar directamente en las manos, ya que la espuma comenzará a derretirse inmediatamente al contacto con la piel caliente. Tome pequeñas cantidades de espuma de ketoconazol, al 2% con las yemas de los dedos, y masajee suavemente en las áreas afectadas hasta que la espuma desaparezca. Para las zonas con pelo, separe el cabello, de modo que la espuma de ketoconazol se pueda aplicar un 2% directamente sobre la piel (en lugar de sobre el cabello).
Evite el contacto con los ojos y otras membranas mucosas. La espuma de ketoconazol al 2% no es para uso oftálmico, oral o intravaginal.
Formas farmacéuticas y Concentraciones
Espuma de ketoconazol, al 2% contiene 20 mg de ketoconazol, USP por gramo, suministrado en envases de 50 g y 100 g.
Contraindicaciones
Ninguna.
Advertencias y precauciones
Sensibilización por contacto
La espuma de ketoconazol al 2% puede dar lugar a sensibilización por contacto, incluida la fotoalergenicidad.
Contenido inflamable
El contenido de espuma de ketoconazol, al 2%, incluye alcohol y propano / butano, que son inflamables. Evite el fuego, las llamas y/o el humo durante la aplicación e inmediatamente después de la misma. No perfore y / o incinere los recipientes. No exponga los recipientes al calor y/o almacene a temperaturas superiores a 120°F (49°C).
Efectos sistémicos
Se ha observado hepatitis con ketoconazol administrado por vía oral (incidencia notificada de 1:10.000). Se han observado niveles séricos de corticosteroides inducidos por ACTH y testosterona reducidos con dosis altas de ketoconazol administrado por vía oral. Estos efectos no se han observado con ketoconazol tópico.
Reacciones adversas
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se realizan en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no pueden compararse directamente con las tasas en los ensayos clínicos de otro medicamento y pueden no reflejar las tasas observadas en la práctica. Sin embargo, la información sobre reacciones adversas de los ensayos clínicos proporciona una base para identificar las reacciones adversas que parecen estar relacionadas con el consumo de drogas y para aproximar las tasas.
Los datos de seguridad presentados en la Tabla 1 reflejan la exposición a Espuma de ketoconazol, 2% en 672 sujetos de 12 años o más con dermatitis seborreica. Los sujetos aplicaron espuma de ketoconazol, 2% o espuma para vehículos dos veces al día durante 4 semanas en las áreas afectadas de la cara, el cuero cabelludo y/o el pecho. Las reacciones adversas que ocurrieron en > 1% de los sujetos se presentan en la Tabla 1.
Cuadro 1: Las Reacciones adversas notificadas por >1% de los Sujetos en los Ensayos Clínicos
|
Reacciones Adversas |
Ketoconazol Espuma, 2% N=672 n (%) |
Vehículo de Espuma N=497 n (%) |
|
los Sujetos con una Reacción Adversa |
188 (28%) |
122 (25%) |
|
en el sitio de Aplicación de la quema |
67 (10%) |
49 (10%) |
|
Reacción en el lugar de aplicación |
41 (6%) |
24 (5%) |
Las reacciones en el lugar de aplicación que se notificaron en <1% de los sujetos fueron sequedad, eritema, irritación, parestesia, prurito, erupción cutánea y calor.
Estudios de seguridad dérmica
En un estudio de fotoalergenicidad, 9 de 53 sujetos (17%) presentaron reacciones durante el período de exposición tanto en los lugares irradiados como en los no irradiados tratados con espuma de ketoconazol, 2%. La espuma de ketoconazol al 2% puede causar sensibilización por contacto.
Experiencia postcomercialización
Se han identificado las siguientes reacciones adversas durante el uso postcomercialización de espuma de ketoconazol, 2%:
Trastornos gastrointestinales: Queilitis
Trastornos generales y alteraciones en el lugar de administración: Dolor y quemadura en el lugar de aplicación
Trastornos de la piel y del tejido subcutáneo: Sensación de ardor en la piel y eritema
Debido a que estos eventos se notifican voluntariamente de una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición a medicamentos.
USO EN POBLACIONES ESPECÍFICAS
Embarazo
Resumen de riesgos
No hay datos disponibles sobre espuma de ketoconazol, uso del 2% en mujeres embarazadas para identificar un riesgo asociado al fármaco de defectos congénitos graves, aborto espontáneo o resultados adversos maternos o fetales. No se han realizado estudios de reproducción en animales con espuma de ketoconazol al 2%. En estudios de reproducción en animales con ratones, ratas y conejos preñados, se observaron efectos embriotóxicos y de desarrollo (anomalías estructurales) tras la administración oral de ketoconazol durante la organogénesis. Suponiendo una absorción sistémica equivalente de dosis tópicas y orales de ketoconazol y una Espuma de ketoconazol, dosis máxima recomendada en humanos del 2% (DMRH) de 8 gramos (equivalente a 160 mg de ketoconazol), se observaron efectos embriotóxicos entre 0,8 y 2,4 veces la DMRH y se observaron efectos en el desarrollo entre 4.8 veces la MRHD .
Se desconoce el riesgo de antecedentes de defectos congénitos graves y aborto espontáneo para la población indicada. Todos los embarazos tienen un riesgo de antecedentes de defectos de nacimiento, pérdida u otros resultados adversos. En la población general de los Estados Unidos, el riesgo de antecedentes estimado de defectos congénitos graves y aborto espontáneo en embarazos clínicamente reconocidos es de 2 a 4% y de 15 a 20%, respectivamente.
Datos
Datos en animales
Los múltiplos animales de los cálculos de exposición humana se basan en comparaciones de la superficie corporal (ASC) de dosis orales administradas a animales y una espuma de ketoconazol, dosis máxima recomendada en humanos del 2% (DMRH) de 8 gramos (equivalente a 2,67 mg de ketoconazol/kg/día para un individuo de 60 kg o 98,8 mg de ketoconazol/m2/día).
Se han realizado estudios de desarrollo embriofetal en ratones, ratas y conejos con ketoconazol administrado por vía oral. Cuando se administró por vía oral a ratones en los días de gestación 6 a 18 (cubriendo el período de organogénesis), el ketoconazol fue embriotóxico (25 mg/kg y superior; 0,8 veces la MRHD en base a comparaciones de ASC) con una alta incidencia de reabsorciones, aumento del número de nacidos muertos y retraso del parto. También se observaron retrasos en la maduración. No hubo evidencia de toxicidad materna o malformaciones de hasta 50 mg/kg (1,5 veces la MRHD basada en comparaciones de ASC). No se observaron efectos en el desarrollo relacionados con el tratamiento a dosis de 10 mg/kg (0,3 veces la MRHD basada en comparaciones de ASC).
En presencia de toxicidad materna en ratas, el ketoconazol administrado por vía oral fue embriotóxico (40 mg/kg o superior; 2,4 veces la MRHD basada en comparaciones de ASC), incluido un aumento de fetos reabsorbidos y mortinatos, y teratogénico (80 mg/kg o superior; 4,8 veces la MRHD basada en comparaciones de ASC), incluidos sindactilia, oligodactilia, costillas onduladas y paladar hendido. Además, 100 mg/kg (6 veces la MRHD basada en comparaciones de ASC) de ketoconazol administrado por vía oral en un solo día durante la gestación (días de gestación 9 a 12) fue embriotóxico (aumento de reabsorciones). Esta misma dosis oral administrada el día 12, 13, 14 ó 15 de la gestación indujo malformaciones externas incluyendo paladar hendido, micromelia y anomalías digitales (braquidactilia, ectrodactilia, sindactilia).
En conejas preñadas administración oral de ketoconazol, evidencia de embriotoxicidad (aumento de la reabsorción) se observó a 10 mg/kg (1,2 veces la MRHD basado en BSA comparaciones) y superior y un aumento en la incidencia de anormalidades esqueléticas se observó en 40 mg/kg (4,8 veces la MRHD basado en BSA comparaciones).
Lactancia
Resumen de riesgos
No se dispone de información sobre la presencia de ketoconazol en la leche materna, ni sobre los efectos en el niño amamantado, ni sobre los efectos en la producción de leche después de la aplicación tópica de espuma de ketoconazol, al 2% en mujeres en periodo de lactancia. En estudios con animales, se encontró ketoconazol en la leche tras la administración oral. Se deben considerar los beneficios para el desarrollo y la salud de la lactancia materna, junto con la necesidad clínica de Espuma de ketoconazol de la madre, al 2%, y cualquier posible efecto adverso de la Espuma de Ketoconazol en el lactante, al 2% o de la afección materna subyacente.
Hembras y machos con capacidad reproductiva
Infertilidad
En estudios de fertilidad en animales en ratas y perros, la administración de dosis orales de ketoconazol entre períodos de 3 días y 3 meses dio lugar a una infertilidad reversible .
Uso pediátrico
No se ha establecido la seguridad y eficacia de la espuma de ketoconazol, 2% en pacientes pediátricos menores de 12 años de edad.
De los 672 sujetos tratados con espuma de ketoconazol, el 2% en los ensayos clínicos, 44 (7%) tenían entre 12 y 17 años de edad. .
Uso geriátrico
De los 672 sujetos tratados con espuma de ketoconazol, el 2% en los ensayos clínicos, 107 (16%) tenían 65 años o más.
En los ensayos clínicos de espuma de ketoconazol, el 2% no incluyó un número suficiente de sujetos de 65 años o más para determinar si respondían de manera diferente a los sujetos más jóvenes.
Espuma de ketoconazol Descripción
Espuma de ketoconazol, 2% contiene 2% de ketoconazol USP, un agente antifúngico, en una espuma hidroetanólica termolábil para aplicación tópica.
El nombre químico del ketoconazol es piperazina, 1-acetil-4-metoxi]fenil] -, cis-con la fórmula molecular C26H28CI2N4O4 y un peso molecular de 531,43.
La siguiente es la estructura química:
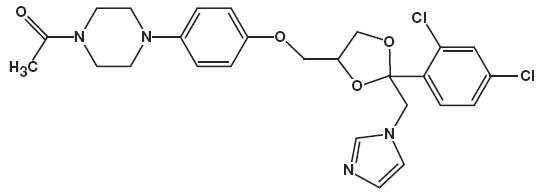
Espuma de ketoconazol al 2% contiene 20 mg de ketoconazol por gramo en un vehículo de espuma hidroetanólica termolábil que consiste en alcohol cetílico, ácido cítrico, etanol (desnaturalizado con alcohol terc-butílico y sulfato de brucina) al 58%, polisorbato 60, citrato de potasio, propilenglicol, agua purificada y alcohol estearílico presurizado con un propulsor de hidrocarburo (propano/butano).
Espuma de ketoconazol-Farmacología clínica
Mecanismo de acción
Se desconoce el mecanismo de acción del ketoconazol en el tratamiento de la dermatitis seborreica.
Farmacodinámica
No se ha establecido la farmacodinámica de la espuma de ketoconazol al 2%.
Farmacocinética
En un estudio de biodisponibilidad, 12 sujetos con dermatitis seborreica de moderada a grave aplicaron 3 g de espuma de ketoconazol al 2% dos veces al día durante 4 semanas. Los niveles plasmáticos circulantes de ketoconazol fueron < 6 ng/ml para la mayoría de los sujetos (75%), observándose un nivel máximo de 11 ng/ml en un sujeto.
Microbiología
El ketoconazol es un agente antimicótico que inhibe la síntesis in vitro de ergosterol, un esterol clave en la membrana celular de Malassezia furfur. Se desconoce la importancia clínica de la actividad antimicótica en el tratamiento de la dermatitis seborreica.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Alteración de la fertilidad
No se han realizado estudios a largo plazo en animales para evaluar el potencial carcinogénico o fotocancerígeno de la Espuma de ketoconazol, 2%.
En estudios de carcinogenicidad oral en ratones (18 meses) y ratas (24 meses) a dosis de 5, 20 y 80 mg/kg/día, el ketoconazol no fue carcinogénico. La dosis alta en estos estudios fue de aproximadamente 2,4 a 4,8 veces la MRHD en base a comparaciones de ASC. En un ensayo de mutación inversa bacteriana, el ketoconazol no expresó ningún potencial mutagénico. En tres ensayos in vivo (intercambio de cromátidas hermanas en humanos, pruebas letales dominantes y pruebas de micronúcleos en ratones), el ketoconazol no mostró ningún potencial genotóxico.
En estudios de fertilidad en animales, el ketoconazol oral alteró la fertilidad de machos y hembras en ratas de forma dependiente de la dosis y de la duración. En las mujeres, las dosis orales de hasta 40 mg/kg (2,4 veces la MRHD basada en comparaciones de ASC) no tuvieron efecto sobre la fertilidad, mientras que las dosis de 75 mg/kg (4,5 veces la MRHD basada en comparaciones de ASC) y superiores disminuyeron la tasa de embarazo y el número de lugares de implantación. En ratas macho, la administración oral de dosis de 200 mg/kg/día (12 veces la MRHD basada en comparaciones de ASC) durante tres días disminuyó la fertilidad y de 400 mg/kg/día (24 veces la MRHD basada en comparaciones de ASC) durante tres días produjo una pérdida completa de fertilidad. Cuando se administraron durante períodos más largos (hasta 3 meses), se observó una disminución de la fertilidad en ratas macho a dosis tan bajas como 24 mg/kg/día (1,4 veces la MRHD basada en comparaciones de ASC). En perros beagle machos, una dosis oral de 25 mg/kg/día de ketoconazol durante un máximo de 4 semanas (5.2 veces la MRHD basada en comparaciones de ASC) resultó en una disminución de la motilidad de los espermatozoides, disminución del recuento de espermatozoides, aumento de espermatozoides anormales y atrofia de los testículos. Estos efectos se revirtieron tras la retirada del tratamiento.
Ensayos clínicos
La seguridad y eficacia de la espuma de ketoconazol, 2%, se evaluaron en un ensayo aleatorizado, doble ciego, controlado con vehículo en sujetos de 12 años de edad y mayores con dermatitis seborreica leve a grave. En el ensayo, 427 sujetos recibieron espuma de ketoconazol, el 2% y 420 sujetos recibieron espuma de vehículo. Los sujetos aplicaron espuma de ketoconazol, 2% o espuma para vehículos dos veces al día durante 4 semanas en las áreas afectadas de la cara, el cuero cabelludo y/o el pecho. La gravedad global de la enfermedad en términos de eritema, descamación e induración se evaluó al inicio y en la semana 4 en una escala de Evaluación Global Estática (ISGA) de 5 puntos del investigador.
El éxito del tratamiento se definió como el logro de una puntuación ISGA de 0 (clara) o 1 en la semana 4 (final del tratamiento) (la mayoría de las lesiones tienen puntuaciones individuales de descamación, eritema e induración que promedian 1 ) y al menos dos grados de mejoría respecto al valor basal. Los resultados se presentan en la Tabla 2. La base de datos no era lo suficientemente grande como para evaluar si había diferencias en los efectos en subgrupos de edad, género o raza.
Cuadro 2: Los Resultados de eficacia
|
Número de Sujetos |
Ketoconazol Espuma, 2% N = 427 n (%) |
Vehículo de Espuma N = 420 n (%) |
|
los Sujetos Lograr el Éxito del Tratamiento |
239 (56%) |
176 (42%) |
forma de suministro/Almacenamiento y Manipulación
Ketoconazole de Espuma, 2% contiene 20 mg de ketoconazol, USP por gramo. La espuma hidroetanólica termolábil está disponible de la siguiente manera:
NDC 45802-532-32
lata de aluminio de 50 g
NDC 45802-532-33
Lata de aluminio de 100 g
Almacenar a 20° a 25°C (68° a 77°F). .
No conservar en nevera.
El contenido es inflamable. No exponga los envases al calor y/o almacene a temperaturas superiores a 49°C (120°F). No conservar a la luz solar directa.
Contenido bajo presión. No perfore y / o incinere el recipiente.
Mantener fuera del alcance de los niños.
Información de Asesoramiento para el paciente
Consulte la etiqueta para el paciente aprobada por la FDA (Prospecto para el Paciente).
Instruir a los pacientes sobre el uso adecuado de espuma de ketoconazol al 2%.
* Evite el fuego, las llamas y/o el humo durante la aplicación e inmediatamente después de la misma. * No aplique espuma de ketoconazol al 2% directamente en las manos. Dispensar sobre una superficie fría y aplicar en las zonas afectadas con las yemas de los dedos. * Lávese las manos después de la aplicación * Espuma de ketoconazol al 2% puede causar irritación de la piel (ardor y/o reacciones en el lugar de aplicación) • Indique al paciente que se ponga en contacto con un proveedor de atención médica si el área de aplicación muestra signos de irritación aumentada e informe de cualquier signo de reacciones adversas.
Hecho en Israel
Fabricado Por Perrigo
Yeruham, Israel
Distribuido Por
Perrigo®
Allegan, MI 49010
www.perrigo.com
Rev 08-18
5K200RCJ3
Instrucciones de Uso
Ketoconazole de Espuma, 2%
Información Importante: Ketoconazol Espuma, el 2% es para uso sobre la piel. No use espuma de ketoconazol al 2% en los ojos, la boca o la vagina.
Paso 1: Retire la tapa transparente de la espuma de ketoconazol, lata al 2%.
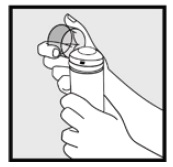
Paso 2: Sostenga la lata en posición vertical y presione firmemente la boquilla para dispensar espuma de ketoconazol, al 2% en la tapa transparente. * Dispense suficiente espuma de ketoconazol al 2% para cubrir toda la(s) zona (s) afectada (s).
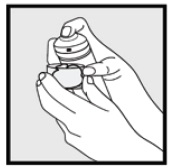
• Si la lata parece tibia o la espuma parece líquida, ponla bajo agua fría.
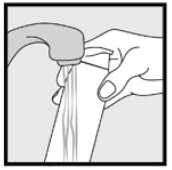
Paso 3: Coja pequeñas cantidades de espuma de ketoconazol, al 2% con las yemas de los dedos y frote suavemente la espuma en la(s) zona (s) afectada (s) hasta que la espuma desaparezca.
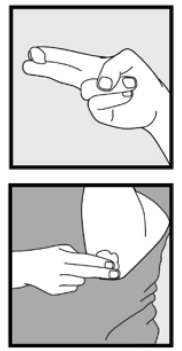
• Si está tratando áreas como el cuero cabelludo, separe el cabello para que se aplique espuma de ketoconazol al 2% directamente sobre la piel.

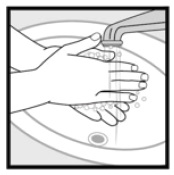
Paso 4: Lávese las manos después de aplicar espuma de ketoconazol al 2%. • Deseche todo el medicamento que queda en la tapa.
¿Cómo debo almacenar Espuma de Ketoconazol, 2%?
• Almacene espuma de ketoconazol al 2% a temperatura ambiente entre 20°C y 25°C (68°F a 77°F). * No guarde la espuma de ketoconazol, lata al 2% en el refrigerador o congelador. * Mantenga la espuma de ketoconazol al 2% lejos del calor. Nunca tire la lata al fuego, incluso si la lata está vacía. * No almacene espuma de ketoconazol al 2% a temperaturas superiores a 120°F (49°C). * No atraviese (perfore) la espuma de ketoconazol, lata al 2%.
Mantenga la espuma de ketoconazol, el 2% y todos los medicamentos fuera del alcance de los niños.
Estas Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos.
Sólo Rx
Hecho en Israel
Fabricado Por Perrigo
Yeruham, Israel
Distribuido Por
Perrigo®
Allegan, MI 49010
www.perrigo.com
Rev 08-18
INFORMACIÓN del PACIENTE
Ketoconazole de Espuma, 2%
Información Importante: Ketoconazol Espuma, el 2% es para uso sobre la piel. No use espuma de ketoconazol al 2% en los ojos, la boca o la vagina.
¿Qué es la espuma de ketoconazol, 2%?
La espuma de ketoconazol al 2% es un medicamento recetado que se usa en la piel (tópico) para tratar la dermatitis seborreica en personas de 12 años de edad y mayores con un sistema inmunitario normal.
Se desconoce si la espuma de ketoconazol al 2% es segura y eficaz cuando se usa para tratar infecciones fúngicas.
Se desconoce si la espuma de ketoconazol al 2% es segura y eficaz en niños menores de 12 años de edad.
Antes de usar Espuma de ketoconazol, al 2%, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si:
• está embarazada o planea quedar embarazada. No se sabe si la espuma de ketoconazol, 2%, dañará al feto. • está amamantando o planea amamantar. No se sabe si la espuma de ketoconazol, al 2%, pasa a la leche materna. Hable con su proveedor de atención médica sobre la mejor manera de alimentar a su bebé durante el tratamiento con espuma de ketoconazol al 2%.
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos con y sin receta, las vitaminas y los suplementos a base de hierbas.
¿Cómo debo usar espuma de Ketoconazol, 2%?
• Use espuma de ketoconazol al 2% exactamente como su proveedor de atención médica le indique que la use. Consulte las «Instrucciones de uso» detalladas al final de este prospecto para obtener instrucciones sobre cómo aplicar espuma de ketoconazol, al 2% de la manera correcta. * Aplique espuma de ketoconazol al 2% en la(s) zona (s) de la piel afectada (s) 2 veces al día durante 4 semanas. Debe aplicar suficiente espuma de ketoconazol, al 2%, para cubrir toda la(s) zona (s) afectada (s). * Hable con su proveedor de atención médica si su piel no mejora después de 4 semanas de tratamiento con espuma de ketoconazol al 2%. * Dispensar espuma de ketoconazol al 2% directamente en la tapa. No dispense espuma de ketoconazol al 2% directamente sobre sus manos, porque la espuma comenzará a derretirse al contacto con la piel caliente. * Lávese las manos después de aplicar espuma de ketoconazol al 2%.
¿Qué debo evitar mientras uso espuma de ketoconazol, 2%?
• Espuma de ketoconazol, 2% inflamable. Evite el fuego, las llamas o fumar durante e inmediatamente después de aplicar espuma de ketoconazol al 2% en la piel. * Evite que la espuma de ketoconazol, al 2%, entre o cerca de los ojos, la boca, los labios o la vagina. Si recibe espuma de ketoconazol al 2% en los labios o en los ojos, la boca o la vagina, enjuáguese bien con agua.
¿Cuáles son los posibles efectos secundarios de la espuma de ketoconazol, 2%?
La espuma de ketoconazol al 2% puede causar efectos secundarios graves, como:
* Irritación de la piel en el área o áreas de aplicación, incluidas reacciones cutáneas causadas por la exposición a la luz. Informe a su proveedor de atención médica si desarrolla irritación de la piel durante el tratamiento con espuma de ketoconazol al 2%.
Los efectos secundarios más comunes de la espuma de ketoconazol, al 2%, incluyen ardor, sequedad, enrojecimiento, irritación, entumecimiento, picor, erupción cutánea y calor en el lugar de aplicación.
Estos no son todos los posibles efectos secundarios de la espuma de ketoconazol, 2%.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar de los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar Espuma de Ketoconazol al 2%?
• Almacene espuma de ketoconazol al 2% a temperatura ambiente entre 20°C y 25°C (68°F a 77°F). * No guarde la espuma de ketoconazol, lata al 2% en el refrigerador o congelador. * Mantenga la espuma de ketoconazol al 2% lejos del calor. Nunca tire la lata de espuma de ketoconazol al 2% al fuego, incluso si la lata está vacía. * No almacene espuma de ketoconazol al 2% a temperaturas superiores a 120°F (49°C). * No atraviese (perfore) la espuma de ketoconazol, lata al 2%. Mantenga la espuma de ketoconazol, el 2% y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de la espuma de ketoconazol, 2%.
Los medicamentos a veces se prescriben para fines distintos de los enumerados en el prospecto de información para el paciente. No use espuma de ketoconazol al 2% para una condición para la que no se le recetó. No le dé espuma de ketoconazol al 2% a otras personas, incluso si tienen los mismos síntomas que usted. Puede dañarlos. Puede pedirle a su farmacéutico o proveedor de atención médica información sobre la espuma de ketoconazol, 2%, que está escrita para profesionales de la salud.
¿Cuáles son los ingredientes de la espuma de ketoconazol, 2%?
ingrediente Activo: ketoconazol
Ingredientes Inactivos: alcohol cetílico, ácido cítrico, etanol (desnaturalizado con alcohol terc-butílico y sulfato de brucina) al 58%, polisorbato 60, citrato de potasio, propilenglicol, agua purificada y alcohol estearílico presurizado con un propulsor de hidrocarburos (propano/butano)
Para obtener más información, llame a Perrigo al 1-866-634-9120
Este prospecto de información para el paciente ha sido aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos.
PANEL DE PRESENTACIÓN PRINCIPAL DEL PAQUETE/ETIQUETA-CAJA DE CARTÓN
Solo Rx
Espuma de ketoconazol, 2%
Solo Para Uso Tópico.
No es Para Uso Oftálmico, Oral o Intravaginal.
100 g

La siguiente imagen es un marcador de posición que representa el identificador del producto que se coloca o se imprime en la etiqueta del envase del medicamento durante la operación de envasado.

| KETOCONAZOL espuma en aerosol de ketoconazol |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
Etiquetadora – Perrigo De Nueva York, Inc (078846912)
More about ketoconazole topical
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Compare Alternatives
- Pricing & Coupons
- En Español
- 36 Reviews
- Drug class: topical antifungals
Consumer resources
- Patient Information
- Ketoconazole Topical (Advanced Reading)
Professional resources
- Prescribing Information
- Ketoconazole (Topical) (Professional Patient Advice)
- Ketoconazole Cream (FDA)
- Ketoconazole Shampoo (FDA)
Other brands Nizoral Shampoo, Ketodan, Extina, Xolegel
Related treatment guides
- Seborrheic Dermatitis
- Cutaneous Candidiasis
- Androgenetic Alopecia
- Dandruff
- … +4 más
Descargo de responsabilidad médica