- Introducción
- Materiales y métodos
- Recogida de huevos
- Cuantificación de Ecdisteroides
- Cuantificación de hormonas juveniles
- Análisis estadísticos
- Resultados
- Discusión
- Ecdisteroides
- Hormona juvenil
- Declaración de disponibilidad de datos
- Las contribuciones de los autores
- Financiación
- Conflicto de intereses
- Agradecimientos
- Material suplementario
Introducción
La radiación adaptativa de insectos en diversos climas se ha visto facilitada en parte por la evolución repetida de la diapausa, una detención anticipada del desarrollo antes de condiciones desfavorables (por ejemplo, invierno, estación seca; Waterhouse y Norris, 1980; Tauber et al., 1986; Danks, 1987; Hodkova y Hodek, 2004). La diapausa se inicia típicamente en respuesta a una señal ambiental de token (p. ej., cambio estacional en el fotoperíodo), mantenido durante un período determinado genéticamente, y luego terminado después de que las condiciones favorables hayan regresado. Por lo tanto, la diapausa permite a los insectos alinear su crecimiento y reproducción con los ciclos estacionales locales (Tauber et al., 1986; Danks, 1987). La diapausa es un regulador clave de la historia de vida, el rango geográfico y la abundancia estacional para muchos insectos polinizadores (por ejemplo, Kemp y Bosch, 2005; Fründ et al., 2013), plagas agrícolas (por ejemplo, Pullin et al., 1991; Li et al., 2012; Levine et al., 2015) y vectores de enfermedades (por ejemplo, Denlinger y Armbruster, 2014; Gray et al., 2016). Además, la diapausa invoca modificaciones fisiológicas generalizadas que incluyen acumulación de reservas de nutrientes, supresión de la actividad metabólica, aumento del catabolismo anaeróbico, detención del ciclo celular, alteraciones en la señalización Wnt y regulación ascendente de varios mecanismos de tolerancia al estrés (Denlinger, 2002; Hahn y Denlinger, 2007, 2011; King y MacRae, 2015; Ragland y Keep, 2017). Comprender los mecanismos reguladores subyacentes a la diapausa es un problema de larga data en la biología de los organismos y facilitará el desarrollo de nuevos enfoques de gestión para especies clave.
Los ecdisteroides y las hormonas juveniles regulan una amplia gama de procesos fisiológicos y de desarrollo en insectos (Gruntenko y Rauschenbach, 2008; Jindra et al., 2013; Palli, 2016), incluyendo diapausa (Denlinger, 1985; Denlinger et al., 2012). La diapausa reguladora de señales hormonales específicas tiende a variar según la etapa en la que se produce la detención del desarrollo (Denlinger et al., 2012). Por ejemplo, la detención del desarrollo durante la diapausa larvaria o pupal está regulada típicamente por cambios en la abundancia de ecdisteroides (por ejemplo, Ohtaki y Takahashi, 1972; Bowen et al., 1984; Richard et al., 1987). En contraste, la detención del desarrollo durante la diapausa en adultos a menudo está regulada por cambios en la abundancia de hormonas juveniles (por ejemplo, Spielman, 1974; Schooneveld et al., 1977; Saunders et al., 1990 y ver reseña en Denlinger et al., 2012).
Existe una brecha importante en nuestra comprensión de la regulación hormonal de la diapausa embrionaria, que se observa ampliamente en Lepidópteros, Ortopteros, Hemípteros y Dípteros. Investigaciones anteriores han documentado ampliamente la regulación endocrina de la diapausa embrionaria en la polilla del gusano de seda (Bombyx mori) por la hormona diapausa (Hasegawa, 1963; Yamashita y Hasegawa, 1966; Yamashita, 1996). Sin embargo, este papel regulador de la hormona diapausa parece ser exclusivo de B. mori y, por lo tanto, ha proporcionado poca información sobre la base hormonal de la diapausa embrionaria en otras especies (Denlinger et al., 2012). Más allá de B. mori, la regulación hormonal de la diapausa embrionaria se ha establecido en solo tres especies. La polilla gitana (Lymantria dispar) sufre un paro de desarrollo iniciado y mantenido por una mayor abundancia de ecdisteroides (Lee et al., 1997; Lee y Denlinger, 1997), mientras que la baja abundancia de ecdisteroides regula la diapausa en dos langostas (Chortoicetes terminifera, Locusta migratoria;Gregg et al., 1987; Tawfik et al., 2002).
Hasta la fecha, ningún estudio ha caracterizado la abundancia de hormonas durante la diapausa embrionaria de ninguna especie de dípteros. Aquí, abordamos esta brecha investigando la regulación hormonal de la diapausa embrionaria en el mosquito tigre asiático, Aedes albopictus. En los últimos 30 años, este vector de importancia médica(Paupy et al., 2009) ha invadido con éxito regiones templadas de todo el mundo (Benedict et al., 2007) debido en parte a una diapausa embrionaria que ha facilitado la supervivencia durante el transporte de larga distancia (Juliano y Lounibos, 2005; Diniz et al., 2017) y evolucionó rápidamente para alinear el momento de detención del desarrollo con las condiciones climáticas locales (Urbanski et al., 2012). Poblaciones templadas de Ea. albópictus entra en una diapausa fotoperiódica regulada por la madre. En períodos cortos de otoño, las hembras producen huevos que completan el desarrollo embrionario, pero permanecen refractarios a los estímulos de eclosión como larvas de farato dentro del corión del huevo hasta la primavera siguiente. Durante la última década, la regulación transcripcional de la diapausa embrionaria en Ea. albopictus ha sido ampliamente caracterizado(Urbanski et al., 2010; Poelchau et al., 2011, 2013a, b; Huang X. et al., 2015; Batz et al., 2017), pero la regulación hormonal de esta adaptación crucial sigue siendo desconocida. Cuantificamos la 20-hidroxiecdisona (20HE) y la hormona juvenil III (JH3) en óvulos con y sin diapausa en tres puntos de tiempo que incluyen etapas clave del desarrollo embrionario e interpretamos nuestros resultados en el contexto de RNAseq recolectados previamente (Poelchau et al.,2013a, b) y datos manipulativos (Suman et al., 2015).
Materiales y métodos
Recogida de huevos
En todas las mediciones se utilizaron huevos F11 de una colonia de Ae de laboratorio. albopictus se estableció en agosto de 2015 a partir de más de 200 larvas recolectadas en Manassas, VA, Estados Unidos. Antes de este experimento, la población se mantenía en las condiciones descritas anteriormente . Para generar muestras de huevos para este experimento, las larvas F10 se mantuvieron en contenedores de Sterlite de 5,5 litros a una densidad de aproximadamente 250 larvas por 2.5 L de agua desionizada (DI) con 5 mL de purín de alimentos (Armbruster y Conn, 2006) bajo fotoperíodo LD a 21°C y 80% de HR. Cada lunes, miércoles y viernes, las larvas se filtraban a través de una red de malla fina y luego se transferían a un recipiente de Esterlita limpio de 5,5 L; las pupas se distribuían a jaulas de adultos mantenidas bajo fotoperíodo LD que evita la diapausa o fotoperíodo de día corto que induce la diapausa (SD, 8:16 L:D).
Se suministró a las hembras adultas harinas de sangre semanales y una taza de oviposición forrada con papel toalla sin blanquear y rellena a medias con agua DI hasta que cesara la oviposición. Los huevos se recolectaron diariamente, se mantuvieron en una toalla de papel húmeda durante 48 h, luego se secaron al aire y se almacenaron en contenedores en condiciones de SD. A los 5, 7 y 11 días después de la oviposición (dpov), los huevos recolectados se pesaron al 1 µg más cercano (media: 11,460 mg, rango: 9,1–19,5 mg) en una microbalanza MX5 (Mettler-Toledo, Columbia, OH, Estados Unidos), se colocaron en tubos de 1,5 mL, se congelaron a presión en nitrógeno líquido entre las 11 am y las 12 pm (tiempo Zeitgeber 3-4 h) y se almacenaron a -80°C. Se retuvo un subconjunto de huevos para confirmar que las condiciones fotoperiódicas de LD y SD estimulaban la producción de huevos sin diapausa y diapausa, respectivamente(véase Urbanski et al., 2012).
Muestreamos huevos a 5, 7 y 11 dpov por dos razones. Primero, Ae. albopictus inicia la diapausa (sensu Koštál, 2006; Koštál et al., 2017) tras la finalización del desarrollo embrionario (Mori et al., 1981). En las condiciones utilizadas en nuestros experimentos, Ae. los embriones de albopictus se segmentan aproximadamente a 5 dpov y los embriones sin diapausa son competentes para eclosionar aproximadamente a 7 dpov (Poelchau et al., 2013a). Por 11 dpov, la detención del desarrollo está firmemente establecida en embriones de diapausa(Poelchau et al., 2013b). Por lo tanto, elegimos comparar embriones de diapausa y no diapausa en puntos de tiempo que intercalan el período de competencia para incubar, incluido el establecimiento de detención del desarrollo durante la diapausa. En segundo lugar, elegimos puntos de tiempo similares a los utilizados para experimentos previos de embriones con RNAseq (Poelchau et al., 2013a, b) para que estos datos puedan ser aprovechados para interpretar nuestros resultados actuales. Estos resultados de RNAseq se encontraron previamente bien correlacionados con los resultados de expresión génica obtenidos a través de qRT-PCR (Poelchau et al., 2013a).
Cuantificación de Ecdisteroides
Para extraer ecdisteroides, se colocaron muestras de huevos en un tubo molinillo de micro tejido de fondo cónico de vidrio borosilicato de 0,5 ml (Wheaton, Millville, NJ, Estados Unidos) con 1 µg de farnesol (Sigma-Aldrich, St.Louis, MO, Estados Unidos) agregado como patrón interno. Los huevos se homogeneizaron manualmente tres veces con un mortero de teflón en un MeOH refrigerado de grado HPLC de 300 µL y luego se hilaron a 12.000 FCR durante 10 minutos en una centrífuga refrigerada (4°C). El sobrenadante resultante se agrupó y luego se eluyó a través de columnas de óxido de aluminio dos veces con MeOH al 90% refrigerado y una vez con MeOH. Las muestras se secaron en una centrífuga de vacío refrigerada (4°C), se resuspendieron en 20 µL de MeOH y se almacenaron a -80°C hasta el análisis. Se prepararon controles positivos agregando 1 µg de 20HE (Sigma-Aldrich) y farnesol a tubos vacíos que de otro modo se procesaban de forma idéntica. El análisis de muestras de la concentración de ecdisteroides se realizó utilizando un Micromass Quattro Micro LC-MS / MS (Waters Co., Milford, MA, Estados Unidos). Los volúmenes de inyección fueron de 5,0 µL, con separaciones realizadas utilizando columnas de 2,1 mm por 50 mm de ACQUITY UPLC BEH C18 con una fase estacionaria de 1,7 µm (Waters Co.). Las condiciones de funcionamiento para las corridas de LC fueron un caudal de fase móvil de 0,37 mL min–1 con una fase móvil binaria de 0,1% de ácido fórmico en acetonitrilo y 0,1% de ácido fórmico en agua. Las condiciones iniciales fueron 1: 99 acetonitrilo: agua, seguido de flujo isocrático durante 0,3 min. A 0,3 min, un gradiente lineal de 1:acetonitrilo de 99 a 99:1:el agua se aplicó durante 4,2 min, seguido de un flujo isocrático de 1,0 min a 99: 1 acetonitrilo: agua, después de lo cual la fase móvil regresó a 1:99 acetonitrilo:agua. La configuración del espectrómetro de masas fue electrospray positivo, con una temperatura de desolvatación de 350°C. 20HE y farnesol eluidos a 2,89 y 4,97 min, respectivamente, y se cuantificaron mediante el monitoreo de reacciones múltiples de transiciones características: 481,22 (m/z) > 445,24 (m/z) y 205,41 (m/z) > 121,09 (m/z), respectivamente. El límite de detección del ensayo es de aproximadamente 5 pg.
Cuantificación de hormonas juveniles
Cada muestra de huevo se colocó en un tubo triturador de micro tejidos de fondo cónico de vidrio borosilicato de 0,5 ml (Wheaton) con 1 µg de farnesol (Sigma-Aldrich) agregado como patrón interno. Los huevos se homogeneizaron manualmente tres veces con un mortero de teflón en hexano refrigerado de grado HPLC de 500 µL, luego se hilaron a 12.000 FCR durante 10 minutos en una centrífuga refrigerada (4°C). Las fracciones de hexano se recombinaron en un vial de vidrio de borosilicato limpio y se secaron por centrifugación al vacío. La JH se cuantificó mediante cromatografía de gases / espectrometría de masas como se describió anteriormente (Brent y Vargo, 2003). Brevemente, el residuo se lavó de los viales con tres enjuagues de hexano y se agregó a columnas de vidrio de borosilicato llenas de óxido de aluminio. Para filtrar los contaminantes, las muestras se elutaron a través de las columnas sucesivamente con hexano, 10% éter etílico-hexano y 30% éter etílico-hexano. Después del secado, las muestras se derivaron calentando a 60°C durante 20 min en una solución de alcohol metil-d (Sigma-Aldrich) y ácido trifluoroacético (Sigma-Aldrich). Las muestras fueron secadas, resuspendidas en hexano y nuevamente elusionadas a través de columnas de óxido de aluminio. Los componentes no derivatizados se eliminaron con un 30% de éter etílico. El derivado JH se recogió en nuevos viales mediante la adición de un 50% de acetato de etilo y hexano. Después del secado, las muestras se resuspendieron en hexano, y luego se analizaron con un GC de la serie HP 7890A (Agilent Technologies, Santa Clara, CA, Estados Unidos) equipado con una columna de cera ZB de Zebron de 30 m × 0,25 mm (Phenomenex, Torrance, CA, Estados Unidos) acoplada a un detector selectivo de masa inerte HP 5975C. El helio se utilizó como gas portador. La forma de JH se confirmó por primera vez con muestras de prueba en modo de escaneo para detectar firmas conocidas de JH 0, JH I, JH II, JH3 y JH3 etilo; JH3 se confirmó como la forma endógena primaria en esta especie. Las muestras posteriores se analizaron utilizando el modo MS SIM, monitorizándose en m / z 76 y 225 para asegurar la especificidad para el derivado d3-metoxihidrina de JH3. Se cuantificó la abundancia total contra una curva estándar de JH3 derivatizado y se ajustó para la masa inicial de huevos. El límite de detección del ensayo es de aproximadamente 1 pg.
Análisis estadísticos
Los análisis se realizaron en R (R Core Team, 2019). La abundancia de JH3 se transformó en logaritmo y se analizó con ANOVA para probar los efectos del estado de la diapausa, la edad y su interacción. 20LA abundancia fue no lineal y ajustada utilizando dos modelos de regresión polinómica: un modelo completo que incluía la edad y el estado de desarrollo (diapausa, no diapausa), y un modelo reducido que contenía solo la edad. Los modelos se compararon utilizando ANOVA para determinar si la inclusión del estado de desarrollo mejoró significativamente el poder explicativo.
Se utilizaron análisis transcripcionales de datos RNAseq recolectados previamente de Ea de diapausa y no diapausa. huevos de albopictus (Conjunto de datos suplementarios 1; Poelchau et al., 2013a, b). Los genes expresados diferencialmente en 3, 6 y 11 dpov se investigaron mediante análisis de enriquecimiento de conjuntos de genes (Mootha et al., 2003) usando el paquete Piano (Väremo et al., 2013) establecido en parámetros predeterminados seguido de corrección FDR. Se anotó un conjunto de genes de referencia con los términos de proceso biológico GO asignados en VectorBase (Giraldo-Calderón et al., 2015). Los genes de la vía de síntesis JH3 y ecdisteroides, así como los receptores JH3 y los genes de degradación, se anotaron manualmente de acuerdo con la literatura previa (Bai et al., 2007; Li et al., 2011; Nouzova et al., 2011; Niwa y Niwa, 2014; Matthews et al., 2016). Además, anotamos genes inducibles por JH3 y ecdisteroides basados en descripciones de genes proporcionadas en VectorBase (Giraldo-Calderón et al., 2015). Una descripción completa de estos conjuntos de genes se proporciona en el conjunto de datos suplementario 1.
Resultados
La incidencia media de diapausa fue del 95,9% (rango: 90,5–100%) con fotoperíodo SD y 5.4% (rango: 1,8–9,5%) bajo fotoperíodo de dilatación (Conjunto de datos suplementario 2); por lo tanto, nuestros tratamientos fotoperiódicos indujeron las respuestas de diapausa esperadas. 20HE alcanzó su punto máximo en condiciones de diapausa y no diapausa a 7 dpov, pero incluir el estado de diapausa como factor en un modelo cuadrático para la abundancia de 20HE no mejoró el poder explicativo del modelo (Figura 1A y Conjunto de Datos Suplementarios 3; F3,43 = 0.21, p = 0.890). Estos resultados indican que el estado de diapausa no explica significativamente la variación en el título de 20 HE. El análisis de la vía de RNAseq indicó que ni la vía de síntesis 20HE ni los genes inducibles por 20HE se alteraron significativamente en condiciones de diapausa vs. no diapausa a 3, 6 u 11 dpov (Tabla 1).

Tabla 1. Resultados del análisis de enriquecimiento de conjuntos de genes, consulte el Conjunto de datos suplementario 1 para obtener un resumen completo de estos conjuntos de genes.
Se confirmó que la JH3 es la forma primaria de la hormona juvenil en esta especie. La abundancia de JH3 se redujo significativamente en embriones de diapausa (Figura 1B y Conjunto de Datos Suplementarios 3; F1,64 = 5,08, p = 0,028). Sin embargo,la edad (F2, 64 = 0,66,p = 0,518) y la interacción del estado de la diapausa y la edad (F2, 64 = 0,13, p = 0,883) no afectaron los niveles de JH3. El análisis de la vía de los datos de RNAseq indicó que la vía de síntesis de JH3 se reprimió significativamente a 3 dpov y los genes inducibles por JH se reprimieron significativamente a 6 dpov (Figura 2 y Tabla 1).
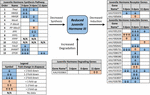
Figura 2. Summary of differential expression of genes involved in JH3 synthesis, degradation, and induction for Ae. albopictus (Poelchau et al., 2013a, b). Las reducciones significativas inducidas por diapausa (azul) o aumentos (naranja) se indican con celdas sombreadas. La magnitud diferencial se indica con flechas como se describe en la leyenda en la parte inferior izquierda. ∗Los genes sin nombres comunes se identifican por el número de identificación de VectorBase.
Discusión
La diapausa es una adaptación generalizada que permite a los insectos alinear su crecimiento y reproducción con condiciones estacionales favorables (Tauber et al., 1986; Danks, 1987). Comprender los cambios hormonales mediante los cuales los insectos coordinan la percepción de señales externas que inducen a la diapausa con los mecanismos fisiológicos que conducen a la detención del desarrollo es un objetivo de larga data en biología (Lees, 1956; Denlinger, 2002). Décadas de investigación han llevado a la identificación de estrategias hormonales comunes para la diapausa en las etapas larvaria, pupa y adulta; sin embargo, la regulación hormonal de la diapausa embrionaria sigue siendo en gran medida desconocida, particularmente en Dípteros (Denlinger, 1985, 2002; Denlinger et al., 2012). En este estudio, nuestra medición directa de la abundancia reducida de JH3 en diapausa está corroborada por perfiles de expresión génica previos (Poelchau et al., 2013a, b) y experimentos manipulativos (Suman et al., 2015) apoyando la hipótesis de que el JH3 regula la diapausa embrionaria en esta especie.
Ecdisteroides
En el presente estudio, medimos directamente la abundancia de ecdisteroides en tres puntos de tiempo bajo condiciones de diapausa y no diapausa en embriones del mosquito Ae. albopictus. De acuerdo con los resultados anteriores de Toxorhynchites amboinensis (Russo y Westbrook, 1986) 20, los niveles de HE alcanzaron su punto máximo cerca de la conclusión del desarrollo embrionario (7 dpov; Figura 1A). Sin embargo, el título 20HE no difirió significativamente entre los huevos de diapausa y no diapausa. Además, ni la vía de síntesis de 20HE ni los genes inducibles por 20HE experimentaron cambios significativos y coordinados en la expresión génica (Tabla 1). Concluimos que, en contraste con diapausas embrionarias examinadas previamente en Lepidópteros y Ortopteros (Hasegawa, 1963; Yamashita y Hasegawa, 1966; Gregg et al., 1987; Yamashita, 1996; Lee y Denlinger, 1997; Lee et al., 1997; Tawfik et al., 2002), 20HE no regula la iniciación de la diapausa en Ea. albopictus.
Hormona juvenil
En contraste, observamos una abundancia de JH3 aproximadamente dos veces menor en embriones de diapausa (Figura 1B). Aunque de menor magnitud que las diferencias en la abundancia de JH3 detectadas bajo condiciones de diapausa vs.no diapausa en insectos que diapausa en otras etapas de la vida (por ejemplo, Yin y Chippendale, 1979; Walker y Denlinger, 1980; Readio et al., 1999), nuestras mediciones directas están corroboradas por evidencia transcripcional (Figura 2). Por ejemplo, la vía de síntesis de JH3 se reprime significativamente durante la preparación temprana de la diapausa (3 dpov). Apoyando nuestra interpretación de estos resultados, estudios previos han encontrado que la expresión reducida de genes a lo largo de la vía de síntesis de JH3 está fuertemente correlacionada con una menor abundancia de JH3 en ambos Aedes aegypti (Nouzova et al., 2011; Rivera-Perez et al., 2014) y Diploptera punctata (Huang J. et al., 2015). Los genes inducibles por JH también se reprimen significativamente durante la preparación tardía de la diapausa (6 dpov; Tabla 1), lo que sugiere que los embriones destinados a la diapausa tienen una capacidad limitada para responder a la señalización de JH3 cerca del momento en que los embriones sin diapausa se vuelven competentes para eclosionar. Además, la expresión génica de una enzima degradante de JH3 (esterasa JH) se regula significativamente en el mantenimiento temprano de la diapausa (11 dpov; Figura 2), así como posteriormente en el mantenimiento de la diapausa (21 y 40 dpov; Poelchau et al., 2013b) sugiriendo que el JH3 puede permanecer en baja abundancia a lo largo de la diapausa en esta especie.
La reducción de la abundancia de JH3 durante la detención del desarrollo es algo contraintuitivo porque el bajo título hormonal juvenil se asocia típicamente con mudas progresivas, particularmente desde la etapa larvaria hasta la pupa (Palli, 2016). Sin embargo, la aplicación de un análogo JH3 (piriproxifeno) a la diapausa Ae. los huevos de albopictus aceleran la tasa de terminación de la diapausa de una manera dependiente de la dosis (Suman et al., 2015). En la dosis más efectiva, aproximadamente el 80% de los huevos expuestos al piriproxifeno terminan la diapausa en 30 dpov en comparación con solo el 1% de terminación de la diapausa en 80 dpov para los huevos de control (Suman et al., 2015). Las alteraciones en la abundancia de JH3 también pueden generar un fenotipo similar a la diapausa embrionaria en otras especies. Por ejemplo, en B. mori, la reducción experimental de la síntesis de JH3 por JHAMT knockout da como resultado larvas de farato completamente desarrolladas que no responden a los estímulos de eclosión; este fenotipo se puede rescatar de manera dependiente de la dosis mediante la aplicación de JH3 extraído o metopreno, un análogo de JH3 (Nakao et al., 2015). De manera similar, la suplementación experimental de otro análogo hormonal juvenil (RO-20-3600) a huevos recién depositados de Drosophila melanogaster produce larvas de farato que se mueven dentro del huevo pero no eclosionan (Smith y Arking, 1975). En conjunto, estos datos indican que la abundancia de hormonas juveniles probablemente contribuye a la regulación de las respuestas de eclosión en diversos insectos. La diapausa embrionaria en el estadio larval del farato se define por una falta de respuesta a los estímulos de eclosión por lo tanto, los cambios en la abundancia de hormonas juveniles pueden representar una estrategia hormonal común para regular esta forma de diapausa.
En conjunto con datos transcripcionales y manipulativos anteriores, nuestros resultados implican fuertemente la reducción de la abundancia de JH3 como el regulador probable de la diapausa embrionaria en Ea. albopictus. Esta investigación es la primera cuantificación directa de la abundancia de hormonas durante la diapausa embrionaria en cualquier especie de díptero y representa un paso importante para aclarar la regulación hormonal de esta adaptación crucial a entornos adversos. La caracterización de la relación entre los estímulos externos y la detención del desarrollo a través de la señalización hormonal sigue siendo un desafío importante (Denlinger, 1985; Denlinger et al., 2012). Elucidar estas vías en una variedad de especies proporcionará una visión crítica de los problemas fundamentales y aplicados, incluida la comprensión de las bases moleculares y fisiológicas de la evolución de la historia de vida, la predicción de las respuestas de las especies al cambio climático y la identificación de objetivos novedosos para el manejo de especies de plagas y vectores (Denlinger, 2008).
Declaración de disponibilidad de datos
Todos los conjuntos de datos generados para este estudio se incluyen en el artículo / Material suplementario.
Las contribuciones de los autores
ZB, CB y PA contribuyeron a la concepción, diseño del estudio y prepararon el borrador inicial del manuscrito. ZB, MM y JS realizaron la cría de animales y recolectaron las muestras de huevos. CB realizó los análisis de LC-MS/MS y GC-MS. ZB realizó los análisis estadísticos. Todos los autores contribuyeron a la revisión del manuscrito y aprobaron la versión presentada.
Financiación
Este trabajo fue apoyado por los Institutos Nacionales de Salud (1R15A|111328-01) y la Dotación Familiar Davis a PA.
Conflicto de intereses
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un conflicto de intereses potencial.
Agradecimientos
Agradecemos a Allan Knopf y Dan Langhorst su ayuda para medir los títulos hormonales. También agradecemos a David Denlinger por sus útiles comentarios sobre versiones anteriores del manuscrito. El uso de nombres comerciales o productos comerciales en este artículo tiene el único propósito de proporcionar información específica y no implica recomendación o aprobación por parte del Departamento de Agricultura de los Estados Unidos. El USDA es un proveedor y empleador que ofrece igualdad de oportunidades.
Material suplementario
Equipo principal de R (2019). R: Un Lenguaje y Entorno para la Computación Estadística. Viena: R Core Team.
Google Scholar
Väremo, L., Nielsen, J., and Nookaew, I. (2013). Enriquecer el análisis del conjunto de genes de los datos de todo el genoma mediante la incorporación de la direccionalidad de la expresión génica y la combinación de hipótesis y métodos estadísticos. Nucleic Acids Res. 41, 4378-4391. doi: 10.1093 / nar / gkt111
Resumen PubMed / Texto completo Cruzado / Google Scholar