INTRODUCCIÓN
La taquicardia ectópica de la unión aguda (JET) puede aparecer después de la cirugía por defectos cardíacos congénitos. Aunque es autolimitante dentro de las 48-72 h, la mortalidad en ausencia de tratamiento oportuno es del 40% 1 debido a la frecuencia cardíaca (FC) elevada y la disociación auriculoventricular (AVD). La mala respuesta al tratamiento farmacológico ha llevado a la búsqueda de otras opciones de tratamiento, incluida la hipotermia moderada.2 Este tratamiento, descrito por primera vez en 19873, se ha reportado en la literatura con poca frecuencia, y todos los informes involucran un número bajo de pacientes.
PACIENTES Y MÉTODO
Pacientes
Se revisaron las historias clínicas de pacientes operados de cardiopatías congénitas entre septiembre de 1999 y octubre de 2001 en el Área Infantil del Corazón del Complejo Hospitalario Juan Canalejo de A Coruña, noroeste de España. Se examinaron electrocardiogramas estándar, así como electrogramas auriculares registrados durante episodios de arritmia con los electrodos auriculares colocados durante la cirugía o con electrodos esofágicos. Solo se incluyeron en este estudio pacientes con JET confirmado o probable que fueron tratados con hipotermia.
Criterios diagnósticos
– JET confirmado: a) taquicardia con complejo QRS similar al trazado basal o a un trazado obtenido por estimulación auricular, junto con b) AVD con frecuencia auricular más lenta que ventricular.
– Probable JET: se registró cuando se cumplió el criterio 1, como se señaló anteriormente, pero no fue posible demostrar una AVD, o cuando hubo conducción retrógrada 1:1 y la arritmia no respondió a la cardioversión eléctrica o a la sobreestimulación auricular.
Tratamiento
El tratamiento del JET se basó en: a) medidas básicas (disminución del uso de agentes inotrópicos, sedación, corrección del desequilibrio electrolítico); b) marcapasos (para restablecer la sincronía auriculoventricular estableciendo una FC más rápida que la causada por el JET); c) hipotermia y d) fármacos antiarrítmicos. La digoxina se utilizó como soporte inotrópico y diurético en algunos pacientes.
La hipotermia se inició cuando el estado hemodinámico se deterioró a pesar de las medidas básicas, o cuando no fue posible mantener una tasa de marcapasos más rápida que la tasa de JET. Todos los pacientes fueron sedados y sometidos a ventilación mecánica con relajantes musculares. Se utilizaron ventiladores, compresas frías colocadas sobre la piel y lavado con solución salina fisiológica fría a través de una sonda nasogástrica. La temperatura se redujo hasta que la velocidad del CHORRO disminuyó, pero nunca por debajo de 33 ºC, medida con un termómetro rectal. Los pacientes fueron recalentados lentamente (1 ºC/8 h) después de al menos 36 h de estabilidad hemodinámica (presión venosa central adecuada, presión arterial y diuresis) aumentando las fuentes de calor externas bajo monitorización electrocardiográfica constante. En los pacientes tratados con marcapasos, este tratamiento se interrumpió cuando apareció el ritmo sinusal normal o cuando la tasa de JET disminuyó por debajo del percentil 75 de normalidad según la edad.
Análisis estadístico
Las variables cuantitativas se expresan como media±desviación estándar, y también se reporta la mediana para las variables cuya distribución fue marcadamente asimétrica. Las variables categóricas se expresan en valores absolutos (porcentajes). Los cambios en los valores hemodinámicos obtenidos a las 1, 2, 4, 8, 12 y 24 h del inicio de la hipotermia se analizaron con MANOVA para tendencias lineales para medidas repetidas; la distribución normal de los datos se verificó previamente con la prueba de Shapiro-Wilks. Las diferencias se consideraron significativas a los resultados de P
Un total de 138 pacientes se sometieron a cirugía cardíaca pediátrica con bypass cardiopulmonar; 21 (15,2%) desarrollaron JET confirmado o probable, y se utilizó hipotermia en 12 pacientes analizados (9 niñas, edad media 2,1±2,0 meses) (Tabla 1). El inicio del JET se registró 6,3±11,9 h después de la operación (mediana, 2 h). En ese momento, la temperatura era de 37,0±0,7 °C (Tabla 2). La hipotermia se inició 1,5±0,5 h después del inicio del JET (mediana, 1,0 h), y duró 74±42 h (rango, 36-144 h). Durante la hipotermia, se utilizó digoxina en 6 pacientes, y en 4 de ellos también se administró amiodarona como soporte durante la hipotermia. Se utilizó marcapasos en 10 pacientes: en 9 se colocaron electrodos epicárdicos en quirófano y en 1 se utilizó un electrodo esofágico.
los Cambios en la temperatura central y la situación hemodinámica durante las primeras 24 h se muestra en la Figura 1. Las mayores mejorías se obtuvieron durante las primeras 4 h de hipotermia, después de lo cual los pacientes permanecieron estables.
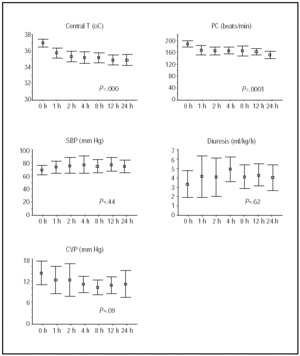
Fig. 1. Curso durante las primeras 24 h de hipotermia. Las líneas ilustran medias e intervalos de confianza del 95%. Los valores de P se refieren a las pruebas de tendencias lineales de MANOVA para medidas repetidas. FC indica frecuencia cardíaca; latidos/min, latidos por minuto; T, temperatura; PAS, presión arterial sistólica; CVP, presión venosa central.
Todos los pacientes, excepto uno, sobrevivieron. El bebé que murió tenía un bajo estado de producción secundaria al JET, que era refractario al tratamiento. No hubo complicaciones atribuibles directamente a la hipotermia. En el momento del recalentamiento, 5 pacientes continuaron con JET; uno requirió reenfriamiento debido a un aumento significativo de la FC. El ritmo predominantemente sinusal reapareció 65±38 h después del inicio de la hipotermia. Dos de los 6 pacientes que recuperaron un ritmo sinusal normal durante la hipotermia requirieron reenfriamiento porque reaparecieron el JET y la FC rápida.
Los 11 pacientes que fueron dados de alta permanecieron vivos y no tuvieron secuelas neurológicas después de un período de seguimiento medio de 15±12 meses (rango, 2-36 meses). El ritmo sinusal se mantuvo sin arritmia durante el seguimiento.
DISCUSIÓN
El JET postoperatorio surge de un foco ectópico ubicado en el tejido ganglionar o haz de His, y es inducido por irritación mecánica durante la cirugía.2 Su naturaleza ectópica la hace sensible al equilibrio simpático-vagal y resistente a la sobreestimulación auricular o a la cardioversión eléctrica. La alta FC y la AVD disminuyen el gasto cardíaco, y esto a su vez acelera la arritmia debido al aumento del tono adrenérgico, creando así un círculo vicioso.1,2 Debido a que el proceso es autolimitante en 48-72 h2,el objetivo principal del tratamiento es el mantenimiento del gasto cardiaco adecuado hasta que la arritmia se remita espontáneamente.
El tratamiento debe incluir 1,2,4, 5 corrección del desequilibrio electrolítico y del desequilibrio ácido-base, eliminación de los estímulos adrenérgicos (dolor, irritación, ansiedad), sedación adecuada y disminución de los niveles de agentes inotrópicos y vasodilatadores, que aceleran la FC y la JET.2 La respuesta a los fármacos antiarrítmicos es pobre2, y la digoxina no es eficaz.5 La propafenona parece tener algún beneficio, 6 a pesar de que es un agente inotrópico negativo. La amiodarona es útil7, 8 aunque en nuestra experiencia puede requerir expansión de volumen debido a la aparición de hipotensión. La procainamida es eficaz en combinación con hipotermia solo cuando la hipotermia sola es insuficiente.5 El papel de los betabloqueantes es controvertido,2 y antagonistas del calcio no se recomienda. Otras opciones de tratamiento son varios modos de estimulación con marcapasos y la ablación rápida del haz de His en casos refractarios.1,2
El diagnóstico precoz es fundamental. Cuando se sospecha de JET, se debe realizar un electrocardiograma de 12 derivaciones y un electrograma auricular.9 En nuestra serie de pacientes, la electrografía auricular permitió desenmascarar la AVD en 2 pacientes y confirmar la sospecha en 6 pacientes en los que el electrocardiograma de superficie sugería una AVD (Figura 2).
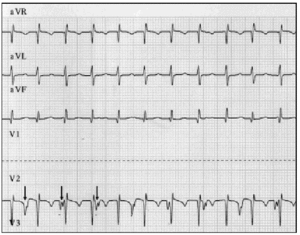
Fig. 2. Rastreo electrocardiográfico de JET, incluyendo cables aVR, aVL y aVF. El trazado inferior muestra el electrograma auricular, y se obtuvo conectando el cable utilizado habitualmente para el electrodo V2 al electrodo epicárdico auricular. Este rastreo muestra un aumento de la actividad auricular (flechas); la disociación auriculoventricular es evidente por la frecuencia auricular más lenta en comparación con la frecuencia ventricular.
El tratamiento con hipotermia se basa en la observación de que la disminución de la temperatura central reduce la automaticidad de las células del marcapasos. Desde que el primer reporte de este tratamiento fue publicado por Bash et al., en 1987,3 han aparecido informes dispersos sobre el uso exitoso de hipotermia en un pequeño número de pacientes.9,10 El objetivo de estas intervenciones era alcanzar una temperatura central de 32-35 °C. Nuestro objetivo era reducir la FC hasta que fuera posible el tratamiento adecuado con marcapasos, y así evitar la hipotermia profunda y sus posibles efectos secundarios. En 2 pacientes no se utilizaron marcapasos porque no se disponía de electrodos epicárdicos auriculares. En vista de su buen curso clínico, decidimos no usar un electrodo esofágico. Debido al diseño de nuestro estudio, no fue posible juzgar la utilidad relativa de la digoxina y la amiodarona administradas durante la hipotermia en el control de la FC.
En esta serie de pacientes, la hipotermia asociada al uso de marcapasos fue una opción eficaz y segura. Los cambios hemodinámicos ocurrieron en pocas horas y no se observaron efectos secundarios directamente atribuibles a la hipotermia. Aunque el pequeño número de pacientes que estudiamos no nos permite generalizar, la tasa de mortalidad en nuestra serie del 8,3% fue claramente inferior a la cifra del 40% reportada para el tratamiento conservador.1 El bebé que falleció fue uno de los primeros pacientes de la serie y tenía taquicardia muy rápida, lo que podría explicar el fracaso de la hipotermia.
El recalentamiento se inició después de al menos 36 h de estabilidad hemodinámica sin esperar la recuperación de un ritmo sinusal estable. La probabilidad de que se necesitara un recooling (27%) no se relacionó con el ritmo sinusal ni con el CHORRO, por lo que creemos que el recalentamiento puede cronometrarse únicamente sobre la base de criterios hemodinámicos.
Las limitaciones de nuestro estudio son las inherentes a cualquier análisis observacional retrospectivo basado en un pequeño número de pacientes sin grupo control. Sin embargo, creemos que nuestros hallazgos, junto con otros informes publicados, respaldan el uso de la hipotermia como un tratamiento eficaz y seguro para el manejo del JET postoperatorio.