| Autor | Afiliación |
|---|---|
| Lindsay A. Weiner, MD | Centro Médico de la Universidad de Maryland, Baltimore, Maryland |
| George Willis, MD | Facultad de Medicina de la Universidad de Maryland, Departamento de Medicina de Emergencias, Baltimore, Maryland |
| Zachary D. W. Dezman, MD, MS, MS | Facultad de Medicina de la Universidad de Maryland, Departamento de Medicina de Emergencias, Baltimore, Maryland |
| Laura J. Bontempo, MD, MEd | Facultad de Medicina de la Universidad de Maryland, Departamento de Medicina de Emergencias, Baltimore, Maryland |
Presentación del caso
Discusión del caso
Resultado del caso
Discusión del residente
Diagnóstico final
Puntos clave de enseñanza
PRESENTACIÓN DEL caso
Una mujer de 52 años de edad acudió al servicio de urgencias para hemodiálisis (EH) debido a enfermedad renal terminal (ERT). Había pasado las semanas anteriores en un hospital externo en tratamiento de neumonía y bacteriemia con daptomicina. She subsequently left against medical advice (AMA) after having her dialysis access catheter removed. Se presentó a nuestro Departamento de Emergencias porque necesitaba la colocación de acceso vascular para la EH y el reinicio de los tratamientos de diálisis. Su historial médico incluyó enfermedad renal crónica secundaria a nefrosclerosis hipertensiva, anemia, hipertensión, trombosis venosa profunda (TVP), lupus eritematoso sistémico y un trastorno convulsivo de etiología desconocida.
El paciente, un testigo de Jehová, rechazó las transfusiones de sangre; por lo tanto, su anemia estaba siendo tratada con administración intravenosa (IV) de hierro, epoyetina alfa y folato. Otros medicamentos incluyeron nifedipina, clonidina, metoprolol, sevelámero y prednisona. Era alérgica a la amoxicilina, azitromicina, hidralazina, labetolol, linezolid, morfina y vancomicina. Informó que había consumido heroína por vía intravenosa muchos años antes y que había fumado cigarrillos. Negó el consumo de alcohol o cualquier consumo actual de drogas o tabaco.
A su llegada, estaba alerta y sin angustia aguda con fiebre de 38.3 ° Celsius, frecuencia cardíaca de 87 latidos por minuto( lpm), presión arterial de 110/65 milímetros de mercurio (mmHg), frecuencia respiratoria de 17 respiraciones por minuto y oximetría de pulso del 99% mientras respira aire ambiente. Pesaba 80 kilogramos y medía 5 pies y 6 pulgadas de alto. Su cabeza era normocefálica y atraumática con membranas mucosas húmedas. Las pupilas eran anictéricas, iguales, redondas y reactivas a la luz y la acomodación. El cuello estaba flexible y sin linfadenopatía ni sensibilidad. Sus pulmones tenían sonidos respiratorios gruesos con crepitantes bibasilares leves, pero sin silbidos o ronquidos. No hubo retracciones ni aumento del trabajo de respiración. Su corazón era de ritmo y ritmo regular sin soplos, rozaduras o galopadas. Su abdomen estaba blando con sonidos intestinales normales y sin distensión, sensibilidad, rebote o protección. No había ángulo costovertebral ternura. Las extremidades inferiores tenían 1 + edema con picaduras, 2 + pulsos dorsales pedales y no tenían sensibilidad ni deformidad. El paciente tenía fuerza y tono muscular normales en todas las extremidades con sensación intacta. Fístulas viejas estaban presentes en las extremidades superiores izquierda y derecha sin emociones palpables. Estaba alerta y orientada a la persona, el lugar y el tiempo.
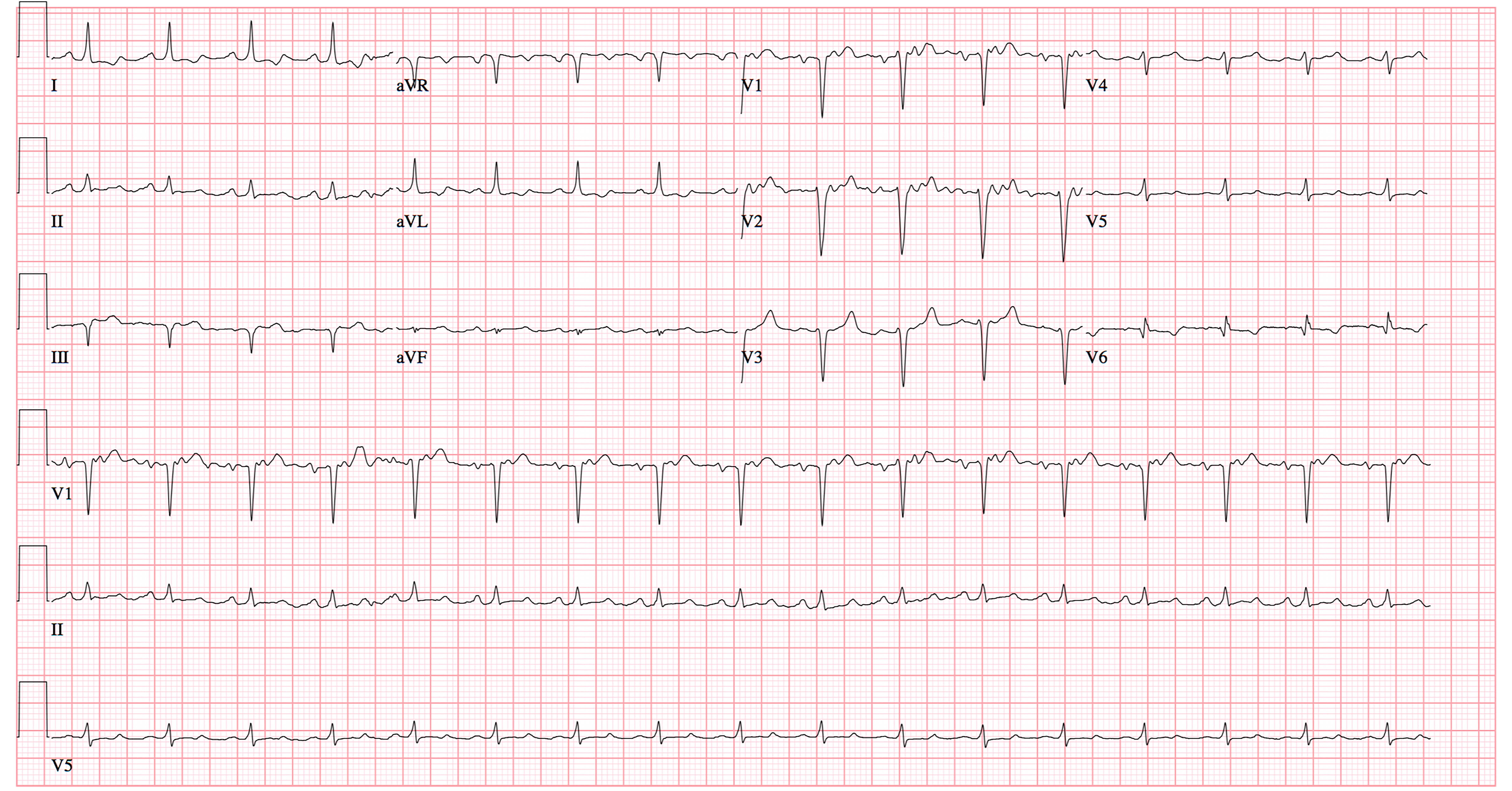
Los valores de laboratorio iniciales del paciente se muestran en la Tabla 1. Estos fueron significativos para leucocitosis leve, anemia a 5,3 g/dL, trombocitopenia, hiperpotasemia y creatinina elevada de 11,9 mg/dL. Su electrocardiograma inicial (ECG) mostró taquicardia sinusal con inversiones de onda T en las derivaciones I y V6 (Imagen 1). Esto no cambió con respecto a un ECG previo. El paciente fue ingresado en el equipo médico y comenzó a recibir daptomicina. Mientras esperaba la colocación en la cama, el compañero de la unidad de cuidados intensivos médicos (UCI) insertó un catéter de diálisis femoral izquierdo sin túnel para iniciar la EH. La colocación fue confirmada por el fácil inconveniente de la sangre de todos los puertos. Durante el proceso de consentimiento para la colocación del catéter, se documentó que la paciente declaró que «preferiría morir antes que recibir transfusiones de sangre.»Después de la colocación del catéter, se intentó iniciar la EH, pero se puso hipotensa y se quejó de debilidad casi de inmediato. Sus signos vitales durante el intento inicial de EH eran una presión arterial de 85/56 mmHg con una frecuencia cardíaca de 105 lpm.
| los Valores de | |
|---|---|
| recuento sanguíneo Completo | |
| recuento de glóbulos Blancos | 12.4 K/mcl |
| Hemoglobina | 5.3 g/dL |
| Hematocrito | 15.8% |
| Platelets | 133 K/mcl |
| Basic metabolic panel | |
| Sodium | 135 mmol/L |
| Potassium | 5.8 mmol/L |
| Chloride | 99 mmol/L |
| Bicarbonate | 27 mmol/L |
| Blood urea nitrogen | 56 mg/dL |
| Creatinine | 11.9 mg/dL |
| Glucose | 189 mg/dL |
| Calcium | 7.2 mg / dL |
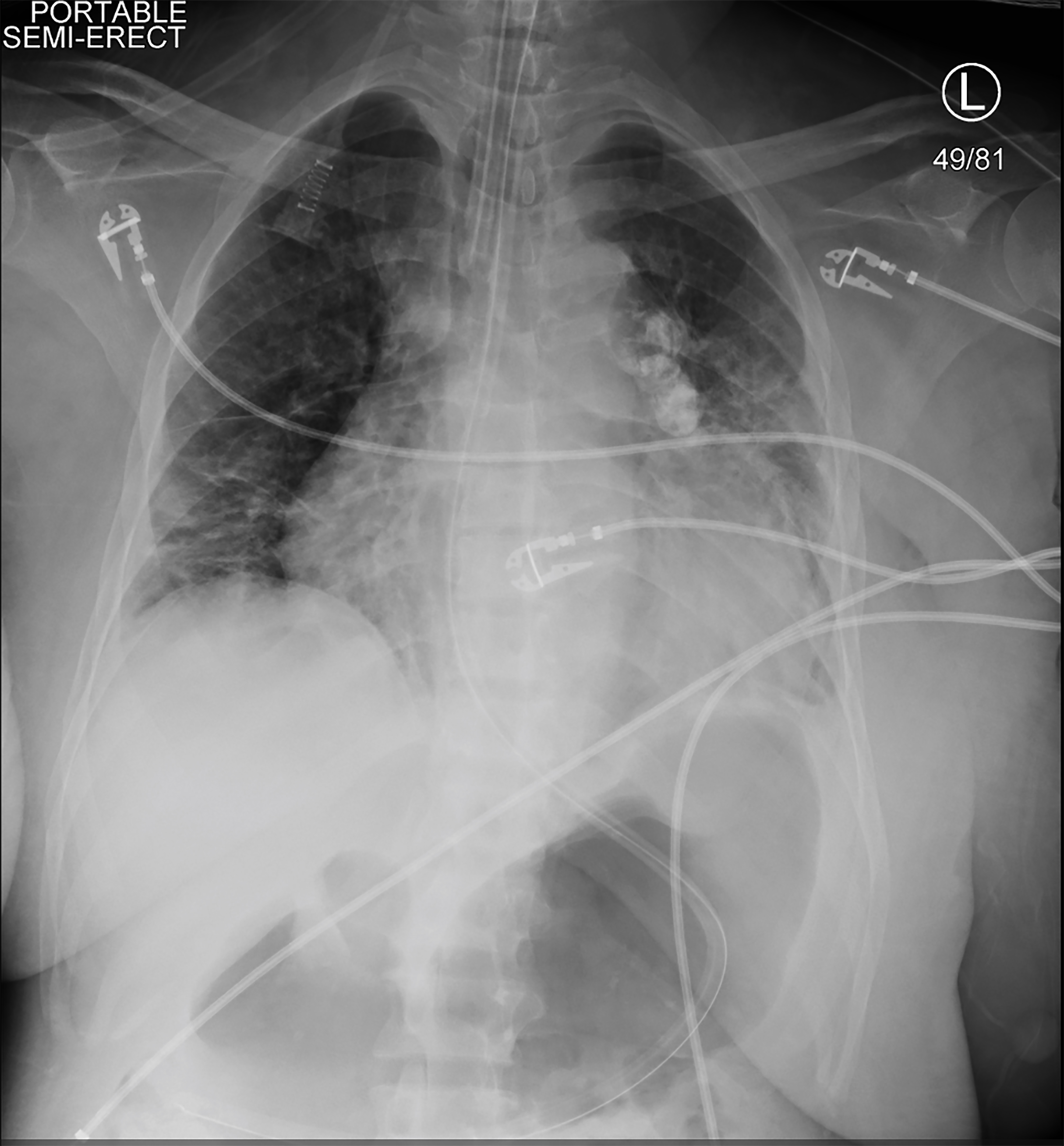
Debido a que el paciente estaba sintomático e hipotenso durante la EH, se inició la terapia continua de reemplazo renal (TRCR). Poco después, se puso hipotensa, no respondió y tuvo un ataque tónico clónico. Los signos vitales en ese momento eran una frecuencia cardíaca de 113 lpm, presión arterial de 75/48 mmHg, frecuencia respiratoria de 20 respiraciones por minuto y saturación de oxígeno del 78% en el aire ambiente. Un examen físico breve y repetido mostró que la paciente no respondía a los estímulos dolorosos y que sus pupilas eran iguales y reactivas. Se le administraron 4 mg de lorazepam e intubaron para proteger las vías respiratorias. Se colocaron una vía femoral arterial derecha y una vía central venosa de triple luz femoral derecha. Una radiografía de tórax confirmó la colocación de la sonda endotraqueal (Imagen 2). Se suspendió la TRCR, pero el paciente permaneció en shock a pesar de las infusiones en bolo de cristaloides, por lo que se iniciaron los vasopresores. Estaba recibiendo dosis crecientes de vasopresores cuando los valores de laboratorio repetidos indicaron una hemoglobina de 1,6 g / dL (Tabla 2).
| Values (prior value) | |
|---|---|
| Complete blood cell count | |
| White blood cell count | 13.4 K/mcl (12.4 K/mcl) |
| Hemoglobin | 1.6 g/dL (5.3 g/dL) |
| Hematocrit | 5.7% (15.8%) |
| Platelets | 167 K/mcl (133K/mcl) |
| Complete metabolic panel | |
| Sodium | 131 mmol/L |
| Potassium | 6.7 mmol/L |
| Chloride | 99 mmol/L |
| Bicarbonate | 14 mmol/L |
| Blood urea nitrogen | 56 mg/dL |
| Creatinine | 11.9 mg/dL |
| Glucose | 169 mg/dL |
| Alanine aminotransferase | 23 u/L |
| Aspartate aminotransferase | 31 u/L |
| Alkaline phosphatase | 145 u/L |
| Total bilirubin | 0.4 mg/dL |
| Total de proteínas | 5.8 g/dL |
| la Albúmina | 3.2 g/dL |
| Lactato | 15 u/L |
| gases en sangre Arterial | |
| pH | 7.23 |
| PCO2 | 28 mmHg |
| PO2 | 214 mmHg |
Poco después entró en paro cardíaco con un ritmo de actividad eléctrica sin pulso (PEA). El retorno de la circulación espontánea se logró después de seis minutos de reanimación cardiopulmonar. Se observó un aumento de la distensión abdominal durante la reanimación, por lo que se introdujo un catéter urinario sensor de presión. Las presiones máximas de las vías respiratorias y de la vejiga se midieron a más de 60 cmH2O y 50 mmHg, respectivamente. A continuación se consultó la cirugía. Se inició un protocolo de transfusión masiva después de que sus familiares más cercanos accedieran a permitir la transfusión de productos sanguíneos. Se realizó una evaluación focalizada con ecografía para trauma (FAST), que mostró líquido libre en la bolsa de Morrison. A medida que se continuaban las medidas de reanimación, se obtuvo un estudio adicional y se realizó un diagnóstico.
DISCUSIÓN DEL CASO
Este caso se presentó con una secuencia única y tortuosa de eventos que giraron muy rápidamente en una dirección desafortunada. Cuando se presenta con pacientes que tienen quejas vagas o mínimas, corresponde a los proveedores buscar pistas para ayudar a hacer el diagnóstico. Por lo tanto, comencé buscando las pistas en este caso.
El paciente presentó una queja principal de necesidad de diálisis. Recientemente había sido ingresada en otro centro por neumonía y bacteriemia y se le retiró el catéter de EH debido a la sospecha de sepsis por vía. Firmó la salida de AMA de este centro después de recibir daptomicina. Se desconoce cuánto tiempo había estado sin EH o si terminó su tratamiento con antibióticos antes de irse. Sin embargo, es esencialmente asintomática.
Su historial médico anterior es notable por convulsiones, TVP y anemia. No hay mención de ningún anticoagulante o antiepiléptico, lo que indica que no recordaba los nombres de sus medicamentos o que no estaba tomando ninguno. Cabe destacar que es testigo de Jehová y, por lo tanto, recibió terapias alternativas para su anemia, que incluyen hierro, ácido fólico y epógeno.
Su examen físico revela que está febril pero con signos vitales estables. Esperaría esto teniendo en cuenta que había dejado la otra instalación y probablemente no terminó su tratamiento con antibióticos para su neumonía y bacteriemia. Otras posibilidades incluyen una infección resistente al antibiótico o una infección nosocomial recién adquirida de su estancia hospitalaria anterior. Tiene algunos sonidos respiratorios gruesos y crepitantes bibasilares en su examen pulmonar, lo que corrobora su historial de neumonía. La neumonía es probablemente la fuente de la fiebre, así como de la bacteriemia, que puede no presentarse con síntomas.
Sus estudios de laboratorio revelaron algunos hallazgos pertinentes. Estaba anémica e hipercalémica. También era hipocalcémica e hiperfosfatémica. También tuvo uremia leve. La mayoría de estos hallazgos se esperarían en un paciente con ERT. La anemia puede ser el resultado de una enfermedad renal. Otras posibilidades en el diagnóstico diferencial para la anemia incluyen hemorragia, deficiencia de hierro y deficiencia de folato. Ella no se queja de ninguna pérdida de sangre ni tenemos los índices de glóbulos rojos como el volumen corpuscular medio para poder hacer estos diagnósticos alternativos en este punto. Lo más probable es que su hipercalemia se deba a su falta de EH. Su hiperfosfatemia también es muy probable debido a la falta de EH; sin embargo, la daptomicina también puede causar hiperfosfatemia.
Mientras espera la colocación en la cama, comienza la EH, durante la cual comienza a quejarse de sentirse débil y se nota que se vuelve hipotensa y taquicárdica. Luego se inicia TRCR y permanece hipotensa, se vuelve hipóxica, no responde y tiene una convulsión tónico-clónica que requiere intubación e iniciación de vasopresores. El examen muestra pupilas iguales y reactivas en un paciente que no responde a estímulos dolorosos. Los estudios de laboratorio revelan un empeoramiento profundo de la anemia, un empeoramiento de la hiperpotasemia y el desarrollo de un intervalo de acidosis láctica. A continuación, entra en un paro de guisantes y, después de un retorno exitoso de la circulación espontánea, se le transfunde sangre. Sin embargo, sigue hipotensa e hipóxica a pesar de la intubación. También tiene un abdomen distendido y presiones máximas de las vías respiratorias superiores a 60 cmH2O. Un examen RÁPIDO revela líquido libre en la bolsa de Morrison.
Un cambio de estado tan profundo después de una intervención terapéutica requiere un pensamiento serio. Comencemos con la hipotensión y la taquicardia durante la EH y la TRCR posterior. La hipotensión durante la EH es ciertamente posible con caudales más altos. Sin embargo, la TRCR tiene caudales mucho más lentos y la hipotensión es menos frecuente cuando se usa TRCR. Entonces, ¿por qué esta persona en shock requiere vasopresores después de iniciar la EH?
Al acercarme a pacientes con shock, me viene a la mente el SHOCK mnemónico (séptico/espinal, hipovolémico, obstructivo, cardiogénico, anafiláctico – K como en láctico). La sepsis es ciertamente posible, dada su historia de bacteriemia. Sin embargo, es menos probable que sea la causa de una descompensación tan profunda, especialmente con un inicio agudo en el entorno de inicio de la EH. El shock hipovolémico o hemorrágico es otra posibilidad. Tiene factores de riesgo para ambos, ya que puede estar en anticoagulación con su historial de TVP, así como posiblemente tener un mal funcionamiento urémico de las plaquetas. Esto tendrá que investigarse más a fondo. El shock obstructivo, como en la embolia pulmonar o el taponamiento, es otra posibilidad. Sin duda, tiene factores de riesgo para esto con su historial de TVP y estado de anticoagulación desconocido. También es hipóxica, lo que no se explica por la neumonía porque sus saturaciones originales estaban por encima del 95%. También podría haber desarrollado taponamiento de pericarditis urémica, aunque esto es menos probable dado que su nitrógeno ureico en sangre (BUN) no está significativamente elevado y no tenía quejas de síntomas de pericarditis. Otra posible causa de colapso hemodinámico que conduce al choque obstructivo es una embolia de aire del nuevo catéter de EH y la posterior iniciación de la EH a través de él. Debido a que esto es posible, tenemos que desentrañar esto un poco más también.
El shock cardiogénico es menos probable, ya que es poco probable que haya desarrollado un infarto de miocardio indoloro tan grave que entrara en shock cardiogénico. Los problemas anafilácticos y endocrinos son otras posibles causas de shock. Sin embargo, no se administraron medicamentos ni se mencionó erupción cutánea o compromiso de las vías respiratorias para sugerir la anafilaxia como causa. Se debe considerar el shock endocrino ya que está tomando prednisona, lo que hace que la insuficiencia suprarrenal sea una posible causa. La hiperpotasemia e hiponatremia que usted esperaría con insuficiencia suprarrenal están presentes; sin embargo, no hay mención de incumplimiento o vómitos de los esteroides, lo que hace que esta posibilidad sea menos probable.
La incautación durante la EH es otra entidad presente en este caso. Tiene antecedentes de convulsiones, y no hay ningún antiepiléptico en su lista de medicamentos. Entonces, su ataque podría ser por incumplimiento. La encefalopatía urémica puede presentarse como convulsiones en cualquier punto; sin embargo, el MOÑO solo está ligeramente elevado, lo que lo hace poco probable. El síndrome de desequilibrio de diálisis es otra causa de convulsiones durante la EH. Sin embargo, por lo general ocurre durante la primera sesión de EH y se asocia con una rápida caída del MOÑO. Este paciente ha estado en EH durante algún tiempo y el MOÑO no está marcadamente elevado, lo que hace que este diagnóstico sea poco probable. Por último, la disminución de la perfusión al cerebro debido a la hipotensión durante la EH puede inducir convulsiones. El paciente se hipotensor durante la EH, lo que puede ocurrir debido a mayores caudales. Luego se le administró TRCR, que utiliza un flujo más lento y tiene una incidencia mucho menor de hipotensión; sin embargo, se volvió más hipotensa. Esto sugiere que lo más probable es que haya alguna otra razón para la hipotensión en lugar de simplemente la EH.
También tiene líquido libre en su examen RÁPIDO y ahora tiene un abdomen distendido. Junto con la anemia que empeora profundamente, tengo que asumir que está sangrando en su abdomen. No hay nada más que hemorragia y hemólisis que podría explicar una caída tan profunda en su hemoglobina, y no hay evidencia de sospecha de hemólisis en su historia, examen físico o estudios secundarios.
El paciente también está experimentando presiones elevadas de las vías respiratorias en el ventilador. Hay varias razones por las que las presiones de sus vías respiratorias podrían ser elevadas; pero en el entorno de un abdomen distendido e hipotensión, el síndrome compartimental abdominal (SCA) ocupa un lugar destacado en mis diagnósticos diferenciales. Por lo tanto, tengo que asumir que se trata de un sangrado relativamente rápido, ya que ha bajado su hemoglobina significativamente, ha entrado en un paro de guisantes, ha mejorado con transfusiones de sangre y requiere múltiples vasopresores para mantener su presión arterial. ¿Pero por qué está sangrando en el abdomen? Ella no ha experimentado ningún trauma en su abdomen a menos que haya ocurrido durante la convulsión en el hospital; sin embargo, si este hubiera sido el caso, asumiría que esta historia se habría dado. Ciertamente podría haber experimentado algún tipo de catástrofe aórtica, como una ruptura de aneurisma aórtico abdominal, pero sería muy extraño que esto hubiera ocurrido durante la EH.
Ahora tuve que dar un paso atrás y ver las pistas de diagnóstico como un todo y juntar estas piezas del rompecabezas. Al tener a la vista toda esta paciente presentación, surge un tema común en casi todos los aspectos de su secuencia de eventos. Hemorragia. ¿Anemia? Hemorragia. Su anemia empeora? Definitivamente hemorragia. La hipotensión? Hemorragia. ¿Convulsiones? Hipoperfusión por hipotensión por hemorragia. La hipoxia? Anemia profunda, que proviene de una hemorragia. ¿ACS? Hemorragia. ¿Acidosis láctica? Hipotensión y anemia por hemorragia.
Ahora solo tenemos que averiguar de dónde viene esta hemorragia. Cuando la paciente se presentó por primera vez, parecía notablemente estable. No tenía ninguna queja y sus signos vitales, aparte de la fiebre, estaban dentro de los límites normales. Le colocaron un catéter de EH sin mencionar ninguna complicación. Comienza la EH y su presión arterial baja, su frecuencia cardíaca aumenta y se vuelve sintomática casi de inmediato. Yo podría fácilmente culpa HD como la causa; sin embargo, sus proveedores de iniciar TDC y su hipotensión empeora, haciendo HD menos probable que sea la causa. Por lo tanto, algo sucedió antes del inicio de la EH, ya que estaba estable hasta que comenzó la EH. Lo único que ocurrió antes del inicio de la EH fue la colocación del catéter de EH. No se menciona ninguna complicación o pérdida significativa de sangre durante la colocación. Sin embargo, es el único evento entre la estabilidad del paciente y su inestabilidad.
Si no hubo mención de una complicación obvia, ¿qué pudo haber sucedido? Recuerde que la presunta fuente del sangrado está en el abdomen. El catéter de HD se colocó en la ingle, que no está lejos del abdomen y del espacio retroperitoneal. Si el proveedor que colocó la línea penetró el otro lado de la pared del vaso, fácilmente podría haber colocado el catéter de HD de modo que su punta esté en el retroperitoneo. En ese caso, el paciente extravasaría sangre en el espacio retroperitoneal causando hipotensión, disminución de la perfusión, acidosis láctica y anemia profunda. Una vez que el espacio retroperitoneal se llenó, habría un aumento de la presión intraabdominal que eventualmente llevaría a SCA. Una revisión de la literatura revela un reporte de caso de este tipo de complicación.1
Por lo tanto, el estudio diagnóstico que realizaría es una angiografía por tomografía computarizada (TC) del abdomen y la pelvis. Esto mostraría dónde se colocó el catéter de HD y examinaría el retroperitoneo en busca de signos de sangrado activo.
RESULTADO DEL CASO
El estudio diagnóstico fue una angiografía por TC del abdomen y la pelvis. El catéter femoral izquierdo de HD había perforado la vena ilíaca común izquierda del paciente y formado un hematoma retroperitoneal del lado derecho. El equipo quirúrgico evaluó a la paciente y realizó una laparotomía temporizadora junto a la cama para tratar su SCA agudo. Esto reveló un gran hematoma retroperitoneal del lado derecho y una gran cantidad de ascitis. La hemodinámica de la paciente se estabilizó después de este procedimiento y pudo salir de todos los vasopresores. Luego fue transportada directamente al quirófano con el equipo de cirugía vascular para una reparación de emergencia de su vena ilíaca común izquierda.
Continuó recibiendo múltiples transfusiones de sangre durante la reparación. Posteriormente fue transferida a la UCI quirúrgica con un abdomen abierto que posteriormente fue reparado. La paciente se despertó completamente intacta neurológicamente y fue dada de alta a casa cinco semanas después de su lesión.
DISCUSIÓN RESIDENTE
El SCA es el punto final de un espectro que comienza con hipertensión intraabdominal (HIA) y termina cuando la presión intraabdominal supera los 20 mmHg y se acompaña de disfunción orgánica terminal.2 La presión abdominal normal, incluso en pacientes críticos, debe ser < 12 mmHg. La HIA, que puede graduarse en etapas, se define como una presión de 12-25 mmHg sin la presencia de disfunción orgánica.
Hay varios tipos distintos de SCA. El SCA primario ocurre en traumatismos o catástrofes quirúrgicas que resultan en un gran evento hemorrágico, como en el caso presentado.3 El SCA secundario ocurre cuando los pacientes de la UCI son resucitados agresivamente con grandes volúmenes de cristaloides.4,5 Las causas secundarias menos comunes incluyen lesiones grandes que ocupan espacio, edema intestinal o retroperitoneal y pancreatitis. El SCA secundario es insidioso y comúnmente se diagnostica después de un retraso, lo que complica aún más una mortalidad ya alta.4,5
La letalidad del SCA se debe a la perfusión de órganos comprometida y al fallo orgánico posterior. En los riñones, la disminución de la perfusión renal conduce a congestión y oliguria, mientras que el aumento de la presión del compartimiento causa compresión directa del órgano.6,7 El aumento de la resistencia vascular esplácnica produce edema intestinal, translocación de bacterias intestinales, hiperlactemia y sepsis.6,7 La precarga cardíaca puede disminuir debido a la compresión de la vena cava inferior que causa disminución del gasto cardíaco, mientras que la postcarga del ventrículo derecho aumenta.7 La oxigenación se ve afectada a medida que se empuja el diafragma cefálico y disminuye la capacidad residual funcional.7 La presión intracraneal también se eleva como resultado de la compresión venosa yugular que afecta el retorno venoso. Clínicamente, el paciente presentará hipotensión, hipoxia, lesión renal aguda, estado mental alterado, convulsiones o falta de respuesta; eventualmente, el paciente experimenta colapso cardiovascular total.6-8
El estándar de oro para el diagnóstico de SCA es la medición de la presión vesical indirectamente con un catéter urinario.9 Para medir una presión precisa, el paciente debe estar en posición supina y la medición se debe tomar al final de la espiración, con el transductor puesto a cero y en línea con la cresta ilíaca. Se ha demostrado que esta medición se correlaciona con la presión intraabdominal medida directamente.10 La medición de la presión vesical cada 4-6 horas es adecuada en pacientes críticamente enfermos con riesgo de desarrollar SCA.
El pilar del tratamiento para el SCA es la laparotomía descompresiva, que generalmente requiere dejar al paciente con el abdomen abierto postoperatorio.11 Otras medidas temporizadoras secundarias incluyen sedación y analgesia, parálisis neuromuscular, descompresión del contenido intestinal con sonda nasogástrica o endogástrica, diuréticos y TRCR.11,12
La mortalidad por SCA sigue siendo alta a pesar de la intervención médica. Si bien la laparotomía descompresiva reduce de manera efectiva e inmediata la presión intraabdominal, este procedimiento se asocia con múltiples comorbilidades médicas con una mortalidad que aún permanece hasta el 50%.13 Esto puede deberse al hecho de que en el momento de la laparotomía descompresiva, los pacientes están críticamente enfermos y el procedimiento se considera un último recurso.
Un segundo tema importante para la discusión en este caso es el dilema ético que enfrentan los proveedores que atienden a esta paciente críticamente enferma cuyas creencias religiosas estaban en oposición al tratamiento estándar (transfusión de productos sanguíneos) para su enfermedad. La paciente tenía documentación inicial en su tabla de la conversación médico-paciente durante la cual declaró su rechazo consciente de los productos sanguíneos. Sin embargo, no tenía documentación escrita y firmada de rechazo a transfusiones de productos sanguíneos en la tabla. Mientras la paciente estaba inconsciente e in extremis, su esposo, que no es un Testigo de Jehová practicante, revocó su decisión en un intento de salvar su vida. ¿Dónde se encuentra esta decisión en el equilibrio entre la autonomía y el poder de los familiares más cercanos para decidir qué intervenciones médicas debe recibir un paciente? ¿Qué sucede cuando el familiar más cercano toma una decisión que va en contra de la elección del paciente? En situaciones de vida o muerte con dilemas éticos, donde la toma de decisiones rápida decidirá el resultado del paciente, ¿cómo se puede colocar esta carga en los seres queridos?
El dilema ético, por lo tanto, radica en la idea de que mientras la transfusión viola el valor de la autonomía, simultáneamente cumple con el concepto ético de beneficencia. En general, las directivas personales del paciente deben tener prioridad sobre cualquier decisión tomada por el representante médico. Sin embargo, la decisión de la familia de transfundir en nombre del paciente inconsciente, como se ve en el presente caso, es legalmente apropiada a pesar de que viola la autonomía del paciente.
Se consultó al comité de ética después de que el paciente ya había recibido una transfusión masiva de hemoderivados y continuaba recibiendo más transfusiones de glóbulos rojos. El comité recomendó que el paciente dejara de recibir transfusiones de productos sanguíneos a pesar del consentimiento de sus familiares más cercanos. El paciente se despertó completamente neurológicamente intacto y fue informado de las transfusiones de sangre. Decidió que en el futuro solo aceptaría plasma de banco de sangre y glóbulos rojos donados por su familia durante un evento agudo. La paciente fue dada de alta a casa cinco semanas después de su lesión iatrogénica.
DIAGNÓSTICO FINAL
Perforación iatrogénica de la vena ilíaca izquierda común con el síndrome compartimental abdominal resultante.
PUNTOS CLAVE DE ENSEÑANZA
El SCA ocurre cuando la presión intraabdominal está por encima de 20 mmHg y hay daño en los órganos terminales.
El SCA primario es causado por trauma o cirugía, pero tenga en cuenta el SCA secundario que se observa en la reanimación masiva, especialmente en las UTIS.
El estándar de oro del diagnóstico de SCA es una presión de vejiga medida.
El tratamiento es una laparotomía, así como medidas de temporización, como la evacuación del contenido intestinal y/o sedación y parálisis.
Se obtuvo el consentimiento informado documentado del paciente y/o la aprobación de la Junta de Revisión Institucional y se presentó para la publicación de este informe de caso.
Notas al pie de página
Editor de sección: Rick A. McPheeters, DO
Texto completo disponible en acceso abierto en http://escholarship.org/uc/uciem_cpcem
Dirección para correspondencia: Laura J. Bontempo, MD, MEd, University of Maryland, Department of Emergency Medicine, 110 S Paca Street, 6th Floor, Suite 200, Baltimore, MD 21201. Correo electrónico: [email protected]. 2:103 – 108
Historial de envíos: Revisión recibida el 22 de enero de 2018; Enviada el 19 de marzo de 2018; Aceptada el 21 de marzo de 2018
Conflictos de intereses: Por el acuerdo de envío de artículos CPC-EM, todos los autores están obligados a revelar todas las afiliaciones, fuentes de financiación y relaciones financieras o de gestión que podrían percibirse como fuentes potenciales de sesgo. Los autores no revelaron ninguna.
1. Pafitanis G, Spyridon K, Theodorakopoulou E, et al. Reporte de un caso de síndrome compartimental abdominal causado por una mala posición de un catéter venoso femoral. Int J Surg Case Rep. 2015; 12: 84-6.
2. Maluso P, Olson J, Sarani B. Hipertensión del compartimento abdominal y síndrome del compartimento abdominal. Crit Care Clin. 2016;32(2):213-22.
3. Morken J, West MA. Síndrome del compartimento abdominal en la unidad de cuidados intensivos. Curr Opin Cuidado de Hematocrito. 2001;7(4):268-74.
4. Biffl WL, Moore EE, Burch JM, et al. El síndrome compartimental abdominal secundario es un evento altamente letal. Am J Surg. 2001; 182 (6): 645-8.
5. Burrows R, Edington J, Robbs JV. A wolf in wolf’s clothing: the abdominal compartiment syndrome (en inglés). S Afr Med J. 1995; 85 (1): 46-8.
6. Caldwell CB, Ricotta JJ. Cambios en el flujo sanguíneo visceral con presión intraabdominal elevada. J Surg Res. 1987; 43 (1): 14-20.
7. Balogh Z, McKinley BA, Cox CS, et al. Síndrome compartimental abdominal: causa o efecto de la insuficiencia multiorgánica post-lesión. Choque. 2003;20(6):483-92.
8. Vidal MG, Ruiz Weisser J, Gonzalez F, et al. Incidencia y efectos clínicos de la hipertensión intraabdominal en pacientes críticos. Medicina de Hematocrito. 2008;36(6):1823-31.
9. Kron IL, Harman PK, Nolan SP. La medición de la presión intraabdominal como criterio para la re-exploración abdominal. Ann Surg. 1984;199 (1): 28-30.
10. Saggi BH, Sugerman HJ, Ivatury RR, et al. Síndrome del compartimento abdominal. Trauma J. 1998;45(3):597-609.
11. Kirpatrick AW, Roberts DJ, De Waele JD, et al. Hipertensión intraabdominal y síndrome compartimental abdominal: definiciones de consenso actualizadas y guías de práctica clínica de la Sociedad Mundial del Síndrome Compartimental Abdominal. Medicina de Cuidados Intensivos. 2013;39(7):1190-206.
12. Ouellet JF, Leppaniemi A, Ball CG, et al. Alternativas a la descompresión abdominal formal. Am Surg. 2011; 77 (Sl): S51-7.
13. De Waele JJ, Hoste EA, Malbrain ML. Laparotomía descompresiva para el síndrome del compartimento abdominal-un análisis crítico. Cuidado de Hematocrito. 2006; 10 (2): R51.