Nombre genérico: sulfonato de poliestireno sódico
Forma de dosificación: polvo rectal oral
Revisado médicamente por Drugs.com. Última actualización el 21 de septiembre de 2020.
- Descripción general
- Efectos secundarios
- Dosis
- Profesional
- Interacciones
- Más
- Descripción del polvo de Kalexate
- Polvo de kalexato-Farmacología clínica
- Indicaciones y uso para el polvo de Kalexate
- Contraindicaciones
- Advertencias
- Precauciones
- Interacciones medicamentosas
- Madres lactantes
- Uso pediátrico
- Reacciones adversas
- Sobredosis
- Dosis y Administración de Polvo de Kalexate
- Cómo se suministra el polvo de Kalexate
- ETIQUETA DEL PAQUETE.PANEL DE VISUALIZACIÓN PRINCIPAL
- More about Kalexate (sodium polystyrene sulfonate)
- Recursos para el consumidor
- Recursos profesionales
- Guías de tratamiento relacionadas
Descripción del polvo de Kalexate
Poliestireno sódico El sulfonato, USP, es un benceno, dietenil-polímero, con etenilbenceno, sulfonado, sal de sodio y tiene la siguiente fórmula estructural:
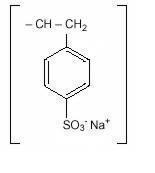
El fármaco es una forma de crema a marrón claro, finamente molida, en polvo de sulfonato de poliestireno sódico, una resina de intercambio de cationes preparada en la fase de sodio con una capacidad de intercambio in vitro de aproximadamente 3.1 mEq (in vivo, aproximadamente 1 mEq) de potasio por gramo. El contenido de sodio es de aproximadamente 100 mg (4,1 mEq) por gramo del fármaco. Se puede administrar por vía oral o en un enema.
Polvo de kalexato-Farmacología clínica
A medida que la resina pasa a lo largo del intestino o se retiene en el colon después de la administración por enema, los iones de sodio se liberan parcialmente y se reemplazan por iones de potasio. En su mayor parte, esta acción ocurre en el intestino grueso, que excreta iones de potasio en mayor grado que el intestino delgado. La eficiencia de este proceso es limitada e impredeciblemente variable. Por lo general, se aproxima al orden del 33 por ciento, pero el rango es tan grande que los índices definitivos de balance de electrolitos deben monitorizarse claramente.
No se dispone de datos metabólicos.
Indicaciones y uso para el polvo de Kalexate
Sulfonato de poliestireno sódico, USP está indicado para el tratamiento de la hipercalemia.
Contraindicaciones
Sulfonato de poliestireno sódico, USP está contraindicado en las siguientes condiciones: pacientes con hipopotasemia, pacientes con antecedentes de hipersensibilidad a las resinas de sulfonato de poliestireno, enfermedad intestinal obstructiva, neonatos con motilidad intestinal reducida (postoperatoria o inducida por fármacos) y administración oral en neonatos (ver PRECAUCIONES).
Advertencias
Necrosis intestinal: Se han notificado casos de necrosis intestinal, que pueden ser mortales, y otros eventos adversos gastrointestinales graves (sangrado, colitis isquémica, perforación) en asociación con Sulfonato de poliestireno sódico, uso de USP. La mayoría de estos casos notificaron el uso concomitante de sorbitol. Los factores de riesgo para eventos adversos gastrointestinales estuvieron presentes en muchos de los casos, incluyendo prematuridad, antecedentes de enfermedad intestinal o cirugía, hipovolemia e insuficiencia e insuficiencia renal. No se recomienda la administración concomitante de sorbitol (ver PRECAUCIONES, Interacciones medicamentosas).
• Suspender el uso en pacientes que desarrollen estreñimiento.
Terapia alternativa en Hiperpotasemia severa
Dado que la reducción efectiva del potasio sérico con Sulfonato de Poliestireno sódico, la USP puede tardar horas o días, el tratamiento con este medicamento solo puede ser insuficiente para corregir rápidamente la hiperpotasemia severa asociada con estados de descomposición tisular rápida (por ejemplo, quemaduras e insuficiencia renal) o hiperpotasemia tan marcada como para constituir una emergencia médica. Por lo tanto, siempre se deben considerar otras medidas definitivas, incluida la diálisis, que pueden ser imperativas.
Hipopotasemia
La terapia con sulfonato de poliestireno sódico, USP, puede presentar una deficiencia grave de potasio. El efecto debe controlarse cuidadosamente mediante determinaciones frecuentes de potasio sérico dentro de cada período de 24 horas. Dado que la deficiencia de potasio intracelular no siempre se refleja en los niveles séricos de potasio, el nivel al que se debe suspender el tratamiento con Sulfonato de Poliestireno sódico, USP, debe determinarse individualmente para cada paciente. La condición clínica del paciente y el electrocardiograma son ayudas importantes para hacer esta determinación. Los signos clínicos tempranos de hipopotasemia grave incluyen un patrón de confusión irritable y procesos de pensamiento retardados.
Electrocardiográficamente, la hipopotasemia grave a menudo se asocia con un intervalo Q-T alargado, ensanchamiento, aplanamiento o inversión de la onda T y ondas U prominentes. Además, se pueden presentar arritmias cardíacas, como contracciones auriculares, ganglionares y ventriculares prematuras, y taquicardias supraventriculares y ventriculares. Es probable que los efectos tóxicos de la digitálica sean exagerados. La hipopotasemia marcada también se puede manifestar por una debilidad muscular severa, que a veces se extiende hasta una parálisis franca.
Alteraciones electrolíticas
Al igual que todas las resinas de intercambio de cationes, el sulfonato de poliestireno sódico, la USP no es totalmente selectiva (para el potasio) en sus acciones, y también se pueden perder pequeñas cantidades de otros cationes como el magnesio y el calcio durante el tratamiento. En consecuencia, los pacientes que reciben sulfonato de poliestireno sódico, USP deben monitorizarse para detectar todas las alteraciones electrolíticas aplicables.
Alcalosis sistémica
Se ha notificado alcalosis sistémica después de administrar resinas intercambiadoras de cationes por vía oral en combinación con antiácidos donadores de cationes no absorbibles y laxantes como hidróxido de magnesio y carbonato de aluminio. El hidróxido de magnesio no debe administrarse con Sulfonato de poliestireno sódico, USP. Se ha informado de un caso de convulsiones de gran mal en un paciente con hipocalcemia crónica de insuficiencia renal a quien se le administró sulfonato de poliestireno sódico, USP con hidróxido de magnesio como laxante. (Consulte PRECAUCIONES, Interacciones medicamentosas.)
Precauciones
Se recomienda precaución cuando se administra sulfonato de poliestireno sódico, USP a pacientes que no pueden tolerar ni siquiera un pequeño aumento de las cargas de sodio (es decir, insuficiencia cardíaca congestiva grave, hipertensión grave o edema marcado). En tales casos, puede indicarse una restricción compensatoria de la ingesta de sodio procedente de otras fuentes.
En caso de estreñimiento clínicamente significativo, el tratamiento con sulfonato de Poliestireno sódico, USP debe interrumpirse hasta que se reanude el movimiento intestinal normal (ver ADVERTENCIAS, Necrosis intestinal).
Interacciones medicamentosas
Antiácidos
La administración oral simultánea de sulfonato de poliestireno sódico, USP con antiácidos y laxantes donadores de cationes no absorbibles puede reducir la capacidad de intercambio de potasio de la resina.
Antiácidos y laxantes donadores de cationes no absorbibles
Se ha notificado alcalosis sistémica después de administrar resinas intercambiadoras de cationes por vía oral en combinación con antiácidos y laxantes donadores de cationes no absorbibles, como hidróxido de magnesio y carbonato de aluminio. El hidróxido de magnesio no debe administrarse con Sulfonato de poliestireno sódico, USP. Se ha informado de un caso de convulsiones de gran mal en un paciente con hipocalcemia crónica de insuficiencia renal a quien se le administró sulfonato de poliestireno sódico, USP con hidróxido de magnesio como laxante.
Obstrucción intestinal debido a concreciones de hidróxido de aluminio cuando se usa en combinación con Sulfonato de Poliestireno sódico, se ha informado de la USP.
Digitálicos
Es probable que los efectos tóxicos de la digitálica en el corazón, especialmente diversas arritmias ventriculares y disociación ganglionar A-V, sean exagerados por la hipopotasemia, incluso frente a concentraciones séricas de digoxina en el «rango normal». (Ver ADVERTENCIAS).
Sorbitol
El uso concomitante de Sorbitol con Sulfonato de Poliestireno sódico, USP ha sido implicado en casos de necrosis intestinal, que puede ser mortal. Por lo tanto, no se recomienda la administración concomitante. (Ver ADVERTENCIAS).
Litio
Sulfonato de poliestireno sódico, USP puede disminuir la absorción de litio.
Tiroxina
Sulfonato de poliestireno sódico, USP puede disminuir la absorción de tiroxina.
No se han realizado estudios de carcinogénesis, Mutagénesis, Alteración de la fertilidad
.
Categoría de embarazo C
No se han realizado estudios de reproducción en animales con sulfonato de poliestireno sódico, USP. Tampoco se sabe si el sulfonato de poliestireno sódico, la USP puede causar daño fetal cuando se administra a una mujer embarazada o puede afectar la capacidad de reproducción. Sulfonato de poliestireno sódico, USP debe administrarse a una mujer embarazada solo si es claramente necesario.
Madres lactantes
No se sabe si este medicamento se excreta en la leche materna. Debido a que muchos medicamentos se excretan en la leche materna, se debe tener precaución cuando se administra sulfonato de poliestireno sódico USP a una mujer lactante.
Uso pediátrico
No se ha establecido la eficacia del sulfonato de poliestireno sódico, USP en pacientes pediátricos. En neonatos, Sulfonato de poliestireno sódico, la USP no debe administrarse por vía oral. Tanto en niños como en neonatos, se debe tener especial cuidado con la administración rectal, ya que una dosis excesiva o una dilución inadecuada podrían provocar la retención de la resina.
Debido al riesgo de hemorragia digestiva o necrosis intestinal, se debe tener especial cuidado en niños prematuros o con bajo peso al nacer.
Reacciones adversas
Sulfonato de poliestireno sódico, USP puede causar cierto grado de irritación gástrica. Pueden ocurrir anorexia, náuseas, vómitos y estreñimiento, especialmente si se administran dosis altas. También pueden ocurrir hipopotasemia, hipocalcemia, hipomagnesemia y retención significativa de sodio, y sus manifestaciones clínicas relacionadas (ver ADVERTENCIAS). Ocasionalmente se desarrolla diarrea. Las dosis grandes en personas de edad avanzada pueden causar impactación fecal (ver PRECAUCIONES). Se han notificado casos raros de necrosis intestinal. Se ha reportado obstrucción intestinal debido a concreciones de hidróxido de aluminio, cuando se usa en combinación con Sulfonato de Poliestireno sódico, USP.
Se han notificado los siguientes acontecimientos a partir de la experiencia postcomercialización en todo el mundo:
* Concreciones gastrointestinales (bezoares) tras la administración oral;
* Colitis isquémica, ulceración o necrosis del tracto gastrointestinal que podría dar lugar a perforación intestinal; y,
* Casos raros de bronquitis aguda y/o bronconeumonía asociados con la inhalación de partículas de sulfonato de poliestireno.
Sobredosis
La sobredosis puede provocar alteraciones electrolíticas, como hipocalcemia, hipocalcemia e hipomagnesemia .Las alteraciones bioquímicas resultantes de la sobredosis pueden dar lugar a signos y síntomas clínicos de hipopotasemia, que incluyen: irritabilidad, confusión, procesos de pensamiento retardados, debilidad muscular, hiporreflexia, que puede progresar a parálisis franca y/o apnea. Se puede presentar tetania. Los cambios electrocardiográficos pueden ser compatibles con hipopotasemia o hipercalcemia; pueden producirse arritmias cardíacas. Se deben tomar las medidas adecuadas para corregir los electrolitos séricos (potasio, calcio, magnesio) y la resina se debe eliminar del tracto alimentario mediante el uso adecuado de laxantes o enemas.
Dosis y Administración de Polvo de Kalexate
La suspensión de este medicamento debe prepararse recién y no almacenarse más de 24 horas.
La dosis media diaria de resina para adultos es de 15 a 60 g. Esto se proporciona mejor administrando 15 g (aproximadamente 4 cucharaditas de nivel) de Sulfonato de Poliestireno sódico, USP de una a cuatro veces al día. Un gramo de Sulfonato de Poliestireno sódico, USP contiene 4,1 mEq de sodio; una cucharadita de nivel contiene aproximadamente 3,5 g de Sulfonato de Poliestireno sódico, USP y 15 mEq de sodio. (Una cucharadita colmada puede contener entre 10 y 12 g de Sulfonato de poliestireno sódico, USP. Dado que la eficiencia in vivo de las resinas de intercambio de sodio y potasio es de aproximadamente el 33 por ciento, aproximadamente un tercio del contenido real de sodio de la resina se está entregando al cuerpo.
En niños pequeños y lactantes, se deben emplear dosis más bajas utilizando como guía una tasa de 1 mEq de potasio por gramo de resina como base para el cálculo.
Cada dosis debe administrarse en forma de suspensión en una pequeña cantidad de agua o, para mayor palatabilidad, en jarabe. La cantidad de líquido suele oscilar entre 20 ml y 100 mL, dependiendo de la dosis, o puede determinarse simplemente permitiendo de 3 a 4 ml por gramo de resina. Los profesionales sanitarios deben seguir todas las precauciones de aspiración al administrar este producto, como colocar y mantener al paciente en posición vertical mientras se administra la resina.
La resina puede introducirse en el estómago a través de un tubo de plástico y, si se desea, mezclarse con una dieta adecuada para un paciente con insuficiencia renal.
La resina también se puede administrar, aunque con resultados menos efectivos, en un enema que consiste (para adultos) de 30 a 50 g cada seis horas. Cada dosis se administra en forma de emulsión tibia (a temperatura corporal) en 100 ml de vehículo acuoso. La emulsión debe agitarse suavemente durante la administración. El enema debe mantenerse el mayor tiempo posible y debe ir seguido de un enema de limpieza.
Después de un enema de limpieza inicial, se inserta un tubo de goma suave de gran tamaño (French 28) en el recto a una distancia de aproximadamente 20 cm, con la punta bien dentro del colon sigmoide, y se pega con cinta adhesiva en su lugar. A continuación, la resina se suspende en la cantidad adecuada de vehículo acuoso a temperatura corporal y se introduce por gravedad, mientras que las partículas se mantienen en suspensión mediante agitación. La suspensión se enjuaga con 50 ml o 100 ml de líquido, tras lo cual se sujeta el tubo y se deja en su lugar. Si se produce una fuga en la espalda, las caderas se elevan sobre almohadas o se toma una posición de rodilla en el pecho temporalmente. Se puede usar una suspensión algo más gruesa, pero se debe tener cuidado de que no se forme pasta, porque esta última tiene una superficie de intercambio muy reducida y será particularmente ineficaz si se deposita en la ampolla rectal. La suspensión se mantiene en el colon sigmoide durante varias horas, si es posible. Luego, el colon se riega con una solución que contiene sodio a temperatura corporal para eliminar la resina. Pueden ser necesarios dos litros de solución de lavado. Los retornos se drenan constantemente a través de una conexión de tubo en Y. Aunque no se recomienda el uso de sorbitol, se debe prestar especial atención a este enema de limpieza si se ha utilizado sorbitol
La intensidad y duración de la terapia dependen de la gravedad y resistencia de la hiperpotasemia.
Sulfonato de poliestireno sódico, USP no debe calentarse, ya que al hacerlo puede alterar las propiedades de intercambio de la resina.
Cómo se suministra el polvo de Kalexate
Sulfonato de poliestireno sódico, USP está disponible como crema a marrón claro, polvo finamente molido en frascos de 1 libra (454 g),
NDC 10702-036-45.
Almacenar a 20 ° a 25° C (68°a 77 ° F) con excursiones permitidas entre 15° a 30°C (59° a 86°F).
Solo Rx
Fabricado por:
KVK-TECH INC.
110 Terry Drive
Newtown, PA 18940 USA.
ID del artículo # 006067/04
Código del fabricante: 10702 10/13
ETIQUETA DEL PAQUETE.PANEL DE VISUALIZACIÓN PRINCIPAL
Etiqueta de frasco de 454 g
NDC 10702-036-45
SULFONATO DE POLIESTIRENO SÓDICO, USP
RESINA DE INTERCAMBIO CATIÓNICO
454 g
Solo Rx
Dosis media para adultos: 15 g (aproximadamente 4 cucharaditas de nivel) de una a cuatro veces al día en agua. Consulte la información de prescripción completa.
El efecto debe controlarse cuidadosamente mediante determinaciones frecuentes de potasio sérico dentro de cada período de 24 horas. Contenido de sodio de aproximadamente 60 mEq por 15 g.
La suspensión debe prepararse recién y no almacenarse más de 24 horas. Dispense en recipientes herméticos y resistentes a la luz, tal como se definen en los compendios oficiales.
Almacenar a 20 ° a 25° C (68°a 77 ° F) con excursiones permitidas entre 15° a 30°C (59° a 86°F).
KVK-TECH, INC.

| KALEXATE sodium polystyrene sulfonate powder |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Etiquetadora – KVK-Tech, Inc. (173360061)
Registrante-KVK-Tech, Inc. (173360061)
| Establecimiento | |||
| Nombre de | Dirección | ID/FEI | Operaciones |
| KVK-Tech, Inc. | 173360061 | FABRICACIÓN(10702-036) | |
More about Kalexate (sodium polystyrene sulfonate)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Drug Interactions
- Pricing & Coupons
- En Español
- Drug class: resinas intercambiadoras de cationes
- Alertas de la FDA (2)
Recursos para el consumidor
- Información para el paciente
Recursos profesionales
- Información de prescripción
- Polvo oral de Sulfonato de Poliestireno sódico (FDA)
Otras marcas Kayexalate, Kionex
Guías de tratamiento relacionadas
- Hiperpotasemia
Descargo de responsabilidad médica