Introduction
Kruppel-like factor 4 (KLF4) on sinkin ja sormen transkriptiotekijän perheeseen kuuluva tekijä,joka ilmaistaan eri ihmiskudoksissa. Se tunnetaan yhtenä neljästä tekijästä, jotka indusoivat pluripotentteja kantasoluja (iPSCs) (Ghaleb and Yang, 2017). KLF4 voi säädellä useita tärkeitä biologisia prosesseja, kuten neuroinflammaatiota, oksidatiivista stressiä, proliferaatiota, erilaistumista ja apoptoosia (Kaushik et al., 2010; Mamonkin ym., 2013; Zhang et al., 2015; Miao et al., 2017; Xu et al., 2017). Aiempien tutkimusten määrät keskittyivät KLF4: n rooliin syövän kehityksessä ja etenemisessä (Karam et al., 2017; Yadav et al., 2018). KLF4 on kaksitoiminen transkriptiotekijä, joka voi käyttää rooliaan onkogeeninä tai tuumorisuppressorigeeninä riippuen syöpätyypistä tai syöpävaiheesta (Evans and Liu, 2008). Se voi aktivoida tai estää solujen proliferaatioon, erilaistumiseen ja apoptoosiin osallistuvien geenien transkriptiota (Ding et al., 2015). KLF4 voi tehdä yhteistyötä muiden uudelleenohjelmointi tekijät muuntaa somaattisten solujen ipscs ja estää erilaistumista kantasolujen (Takahashi and Yamanaka, 2006; van Schaijik et al., 2018). Tämä tarjoaa terapeuttisia näkymiä verisuonitaudeille, immuunitaudeille, anoreksialle ja muille sairauksille (Imbernon et al., 2014; Liu Y. et al., 2015; Murgai et al., 2017). Lisäksi KLF4: llä voi olla laajalti keskushermostoa säätelevä rooli. Useat tutkimukset osoittavat, että KLF4 liittyy useita neurologisia sairauksia, kuten Alzheimerin tauti (AD), epilepsia, Parkinsonin tauti, vesipää ja skitsofrenia (Qin et al., 2011; Xie et al., 2013; Han et al., 2015; Nishiguchi et al., 2015; Li L. et al., 2017).
AD on yksi yleisimmistä kroonisista hermoston rappeumasairauksista, joka johtaa kognitiivisiin ja muistihäiriöihin, erilaisiin psyykkisiin oireisiin ja käyttäytymishäiriöihin ja etenevä dementia on yleisin kliininen piirre (Jiang et al., 2018). AD: n nykyiset vahvistetut patogeeniset tekijät sisältävät epänormaalin amyloidi-β (Aß) – laskeuman indusoimien seniiliplakkien muodostumisen ja tau: n kertymisen indusoimien neurofibrillaaristen tanglien tai dystrofisen neuriitin muodostumisen (Querfurth and LaFerla, 2010; Shinohara et al., 2014). Lisäksi AD: hen voivat vaikuttaa myös perintötekijät. Syntyvä patogeneesi on kuitenkin vielä hämärän peitossa. Yleisimpiä lääkkeitä AD-hoitoon ovat neurotransmitterivahvistimet, anti-Amyloidivalmisteet, neuroprotektiiviset peptidit ja muut lääkkeet (Cacabelos, 2018). Useat tutkimukset ovat osoittaneet, että KLF4: llä oli merkittävä rooli AD: n patogeneesissä. Tässä katsauksessa keskitymme klf4: n sääntelyrooliin neuroinflammaatiossa, neuronaalisessa apoptoosissa, aksonaalisessa regeneraatiossa ja raudan kertymisessä selittämään klf4: n ja AD: n patogeneesin välistä yhteyttä, mikä saattaa tarjota tietoa neurodegeneratiivisten häiriöiden solu-ja molekyylimekanismeista.
Klf4: n biologiset ominaisuudet
KLF4 on sinkkisormea sisältävä ydinproteiini, joka on eristetty nih 3T3-kirjastosta ja sijaitsee solun tumassa. Se tunnistettiin ja luonnehdittiin ensin Shields et al. (1996). Ihmisen klf4: n molekyylimassa on 55kD ja se sijaitsee kromosomissa 9q31. KLF4 kattaa 6,3 kb: n geenisegmentin ja siinä on viisi eksonia. Sen cDNA-koodausalue koodaa polypeptidin, joka koostuu 470 aminohappojäännöksestä (Yet et al., 1998; Ghaleb ja Yang, 2017). Klf4: n karboksyyliterminaalissa on DNA: ta sitova rakennealue, jossa on kolme Cys2His2 (C2H2) – tyyppistä sinkkisormirakennetta, jotka muodostuvat 81 erittäin säilyneestä aminohaposta. Se säätelee transkriptiota suurella affiniteetilla caccc-elementtien ja GC-rikkaan kohdegeenin DNA-sekvenssien kanssa (Shields and Yang, 1998; Pearson et al., 2008). Suurin osa KLF4: n DNA: n sitoutumispaikoista sijaitsee sinkkisormen alueella, mukaan lukien n-terminaalinen transkriptio-aktivaatioalue proteiinien vuorovaikutukseen, C-terminaalinen sinkkisormen rakenne DNA: n sitoutumiseen ja transkription inhibitioalue (Bieker, 2001). KLF4 on mukana säätelemässä monien endogeenisten geenien ilmentymistä (Shields and Yang, 1998). Klf4: n aminoterminaalissa on hyvin vaihteleva transkriptiosäätelyalue. 91: n ja 117: n aminon välissä sijaitsevat aminohappojäämät muodostavat transkriptionaalisen aktivaatio-domeenin, jossa on runsaasti proliinia ja seriiniä, kun taas transkriptionaalinen repressio-domeeni on myös olemassa. Siksi KLF4: llä on kaksi haittavaikutusta: aktivoiva ja estävä geenin transkriptio (Yet et al., 1998; Wei et al., 2006).
alkionkehityksen aikana klf4-arvo oli suurempi alkion kehityksen myöhäisvaiheessa. Kypsissä kudoksissa ja elimissä KLF4 ilmaistaan pääasiassa ruoansulatuskanavassa, suuontelossa, ihon orvaskedessä, verisuonten endoteelissa ja munuaisissa, ja sitä ilmaistaan vähemmän aivoissa (Segre et al., 1999; Ghaleb ym., 2011; Liu et al., 2013; Chen et al., 2015; hän et al., 2015; Bin et al., 2016). Sillä uskotaan olevan merkittävä rooli solujen lisääntymisen ja erilaistumisen säätelyssä. Lisäksi KLF4 voi myös säädellä solusykliä. KLF4 voi aktivoida P21: n p53-riippuvaisesti (Zhang et al., 2000). Lisäksi todettiin, että KLF4 ( – / – ) – solut siirtyivät vanhenemisvaiheeseen aikaisemmin kuin KLF4 ( + / + ) – solut, mikä voidaan selittää klf4 ( – / – ) – solujen vähemmän antioksidanttista geeniekspressiota ja korkeampaa reaktiivista happilajistoa (Ros). ROS voi lisätä p53: n ja p21: n ilmentymistä ja myöhemmin edistää DNA-vaurioita (Liu C. et al., 2015). Havaittiin, että PRMT5 voi nostaa klf4-ilmentymää proteiinipitoisuuksissa. PRMT5: n on raportoitu lisäävän p21: n transkriptiota ja vähentävän BAX: n ilmentymistä estämällä KLF4: n ubikitylaatiota (hu ym., 2015). Lisäksi lukuisat tutkimukset ovat osoittaneet, että KLF4 osallistuu neuronien apoptoosin säätelyyn (Kong et al., 2016; Cui et al., 2017; Song et al., 2018). Tuntemamme klf4: n fysiologinen säätelyrooli on vielä pieni, ja lisätutkimuksia tarvitaan.
Klf4: n rooli AD: ssä
on hyvin osoitettu, että AD: lle on ominaista pääasiassa muistin ja kognitiivisten häiriöiden sekä johdon toimintahäiriöiden esiintyminen (Goedert and Spillantini, 2006). Monet tutkimukset ovat osoittaneet, että neuronaalinen apoptoosi ja synaptinen toimintahäiriö ovat kognitiivisten toimintojen heikkenemisen patologinen perusta (Caccamo et al., 2017; Guo et al., 2017; Yoon et al., 2018). Aß-laskeuman, oksidatiivisen stressin ja raudan kertymisen kertyneet vauriot voivat johtaa ad-potilaiden neuronaaliseen toimintahäiriöön ja apoptoosiin. Useat tutkimukset ovat osoittaneet, että KLF4: n sääntelyrooli näyttää olevan keskeinen keskushermostossa. Ottaen huomioon, että KLF4: n on raportoitu säätelevän hermosolujen apoptoosia, synaptista regeneraatiota, oksidatiivista stressiä ja neuroinflammaatiota, KLF4: n ja AD: n patogeneesin välinen suhde saattaa olla mahdollinen uusi kohde AD: n hoidolle.
Klf4: n rooli Neuroinflammaatiossa
kliiniset tutkimukset ovat osoittaneet, että aß voi aggregoitua ja on tärkein osa AD-potilaiden aivokudoksen solunulkoisia talletuksia, mikä voi heikentää ympäröiviä synapseja ja neuroneja ja johtaa hermosolukuolemaan. Aß: n epänormaali eritys tai liiallinen tuotanto johtaa AD: n patologisiin muutoksiin, joten aß-laskeuma on AD: n ydinyhteys (Rajmohan and Reddy, 2017). Lisäksi tutkimukset ovat osoittaneet, että liiallinen aß-laskeuma voi stimuloida gliasoluja erittämään ROS: ää ja muita vaikuttavia tekijöitä, mikä johtaa oksidatiiviseen stressiin. Tiedettiin, että oksidatiivinen stressi voi stimuloida Aß: n tuotantoa. Siksi Aß ja oksidatiivinen stressi voivat olla vuorovaikutuksessa keskenään ja vaikuttaa AD: n etenemiseen (Cheignon et al., 2018).
KLF4: ää on raportoitu mahdollisena modulaattorina, ja sillä on suuri vaikutus makrofagien ja endoteelisolujen välityksellä tapahtuvaan tulehdukseen (Kuva 1) (Yoshida et al., 2014; Kapoor ym., 2015; Yang et al., 2018). Keskushermostossa liialliset ja krooniset tulehdusreaktiot voivat vaurioittaa hermosoluja ja neurogliosyyttejä. Äskettäin osoitettiin, että KLF4-lauseke korreloi positiivisesti aß42: n aiheuttaman neuroinflammaation kanssa. Mikrogliaalisissa BV2-soluissa oligomeerinen Aß42 voi lisätä KLF4-ilmentymää, jonka välittäjänä toimii aktivoitunut P53 (Li L. et al., 2017). Tulehdustiloissa, kuten aß-kertymässä, proinflammatoristen sytokiinien vapautumista voidaan stimuloida AD: n sukupolvessa (Griffin and Barger, 2010). Liukoisten aß42-oligomeerien neurotoksisuus ja proinflammatorinen teho on suhteellisesti suurempi kuin liukenematon kuituesiintymä (Selkoe, 1991; Weinberg et al., 2018). Klf4: n vaikeneminen voi palauttaa aß42-välitteisen neuroinflammaation, ja klf4: n yliekspressio voi pahentaa Aß42-välitteistä neuroinflammaatiota (Li L. et al., 2017). Aß-kertymä indusoi astrosyyttien ja mikroglian aktivaatiota (Rodríguez et al., 2016). Aktivoidut astrosyytit voivat tehostaa neuroinflammaatiota vapauttamalla tulehdusta edistäviä tekijöitä, kuten IL-1, IL-6 ja TNF-α (Rubio-Perez and Morillas-Ruiz, 2012; Doméné et al., 2016). Tulehdusreaktioiden noidankehä johtaa lopulta toimintahäiriöön ja hermosolujen apoptoosiin.
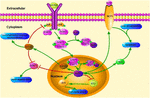
KUVA 1. Klf4: ään liittyvien signalointireittien Schematicillustration. Tämä luku korostaa KLF4: n roolia neuroprotektiossa ja aksonin uudistumisessa. Kuvassa olevat nuolet osoittavat aktivointia tai edistämistä, ja suorat osoittavat siihen liittyvää inhibitiota. KLF4, Kruppelin kaltainen Tekijä 4; STAT3, transkription 3 Signaalianturi ja aktivaattori; JAK, Janus-kinaasi; SOCS3, sytokiinisignaloinnin 3 Vaimennin; HCP1, heme-kantajaproteiini 1; ERK5, mitogeeniaktivoitu proteiinikinaasi 5.
KLF4: llä on keskeinen rooli tulehdussignaalien säätelyssä. Gliasoluissa gemfibrotsiilin indusoima KLF4-aktivaatio lisää sytokiinisignaali 3: n (SOCS3) suppressoria PI3-kinaasi-AKT-reitin kautta (Ghosh and Pahan, 2012). Klf4: n siRNA-välitteinen knockdown voisi heikentää SOCS: n määrää hiirten astrogliassa ja mikrogliassa, mikä voisi myöhemmin vaikuttaa tulehduksellisen geenin ilmentymiseen (Kaushik et al., 2010; Ghosh ja paha, 2012). Lisäksi SOCS-deleetio voi edistää loukkaantuneiden neuronien selviytymistä ja edistää aksonien uudistumista (Smith et al., 2009; Sun ym., 2011). Ja KLF4 säätelee positiivisesti IL-1β: n tai muiden tulehdusta edistävien markkereiden tuotantoa. Se säätelee positiivisesti syklo-oksigenaasi-2: ta (Cox-2) ja negatiivisesti indusoituvaa typpioksidisyntaasia (Inos) (Kaushik et al., 2013). Lisäksi KLF4 on tärkeä monosyyttien erilaistumista säätelevä tekijä ja mahdollinen immuunisäätelyn kohde (Alder ym., 2008). Siksi KLF4 saattaa edistää neuroinflammaatiota säätelemällä näitä negatiivisia säätelijöitä.
on syytä mainita, että Parkinsonin taudin mallissa KLF4 voi edistää MPP+: n aiheuttamaa oksidatiivista stressiä ja neurotoksisuutta ja sitten lisätä neuronaalista apoptoosia ja viivästyttää solujen proliferaatiota (Chen et al., 2013). Oksidatiivinen stressi on epätasapaino peroksidaation ja antioksidaation välillä. Vapaat radikaalit voivat aiheuttaa muutoksia eri makromolekyyleissä, mikä johtaa soluvaurioihin, solujen vanhenemiseen ja kudosvaurioihin (Parajuli et al., 2013; Nie et al., 2015). Oksidatiivinen stressi voi pahentaa varhaista tulehdusta ja Aß-tuotantoa ja sitten pahentaa AD (Cai et al., 2011). Siksi KLF4 voi olla osallisena OKSIDATIIVISESSA stressissä AD: ssa.
nämä löydökset viittaavat siihen, että KLF4: llä on keskeinen rooli neuroinflammaation välittäjänä aktivoimalla mikrogliaa ja siten proinflammatoristen sytokiinien vapautumista. Se voi voimistaa neuroinflammaatiota. Tähän mennessä monet tutkimukset AD: n patogeneesistä ovat keskittyneet neuroinflammaatioon. Immuunisäätelyn mahdollisena kohteena KLF4 voi edistää mikroglian tulehdusreaktioita vaikuttamalla niihin liittyviin negatiivisiin säätelijöihin, millä on suuri vaikutus AD: n kehittymiseen.
KLF4: n rooli Apoptoosissa
neurodegeneratiivisiin muutoksiin kuuluu hermosolujen ja synapsien vähittäinen häviäminen edustavilla aivoalueilla, kuten aivokuoressa, hippokampuksessa ja muissa subkortikaalisissa alueilla. Hermokadon aiheuttamat keskushermoston toiminnalliset häiriöt ovat pysyviä (Citron, 2010). Jatkuva oksidatiivinen stressi voi johtaa neuronaaliseen apoptoosiin (Wu et al., 2010). Suuri määrä tutkimuksia on vahvistanut, että AD liittyy läheisesti oksidatiiviseen stressiin (Lee et al., 2012; Yui et al., 2015). Todettiin, että krooninen oksidatiivinen stressi voi parantaa Fosfolipaasin A2 ryhmän 3 (Pla2g3) ilmentymistä astrosyyteissä ja häiritä aß: n tasapainoa ja johtaa siten AD: n kehittymiseen (Yui et al., 2015).
monet tutkimukset ovat osoittaneet, että KLF4: llä on tärkeä rooli oksidatiivisen stressin kehittymisen estämisessä (Shi ym., 2014; Liu C. et al., 2015). Todettiin, että KLF4 voi edistää H2O2: n aiheuttamaa solujen apoptoosia, tämä toiminta johtuu todennäköisesti lisääntyneestä bax-ilmentymästä ja vähentyneestä bcl-2-ilmentymästä (Li et al., 2010). Kversetiini voi vähentää KLF4-ilmentymistä ihmisen neuroblastooma SH-SY5Y-soluissa ja lisätä BCL-2/bax-suhteen ilmentymistä. Lisäksi kversetiini voi kohtuullistaa Sh-5YSY-solun apoptoosiastetta ja vähentää kaspaasi-3-entsyymin aktiivisuutta (Xi et al., 2012). Tuoreessa tutkimuksessa selvitettiin mitogeeniaktivoidun proteiinin (MAP) kinaasi 5: n (ERK5) neuroprotektiivista vaikutusta oksidatiivista stressiä vastaan. Erk5: n aktivointi voi osittain vähentää H2O2: n aiheuttamaa hippokampaalisten neuronien kuolemaa ja lisätä NGF: n ja PC: n aiheuttamaa neuroprotektiota (Su et al., 2014). Nils ym. käytti MEK5: n mutanttia (MEK5D) erk5-aktivoidun transkription ja toiminnallisten vasteiden tutkimiseen ihmisen endoteelisoluissa, ja tunnistettu KLF4 oli uusi loppupään erk5-kohde (Ohnesorge et al., 2010). Todettiin, että klf4: n yliekspressio voi tukahduttaa TNF-välitteistä tulehdusreaktiota ja vähentää leukosyyttien adheesiota ja tyvisoluapoptoosia. Nämä tulokset vahvistavat, että KLF4: llä on anti-inflammatorisia ja anti-apoptoottisia ominaisuuksia (Ohnesorge et al., 2010). Myöhemmät kokeet ovat osoittaneet, että aivojen luolamaisen epämuodostuman 1 (CCM1) katoaminen endoteelisoluissa aktivoi ERK5: n MEKK3-MEK5-signaalireitin kautta ja lisää KLF4-ekspressiota (Cuttano et al., 2016). ERK5 toimii välittäjänä esivakautuksessa (PC) ja nerve growth factor (NGF)-säädellyssä klf4: n ilmentymisessä (Su et al., 2014). Lisäksi RNAi-välitteinen klf4: n kaataminen voi myös vähentää NGF-tai PC – indusoitua neuroprotektiota. Klf4: n yliekspressio johtaa suurempaan bcl-2/bax-suhteeseen H2O2-stressaantuneissa soluissa (Su et al., 2014). Ylimitoitettu KLF4 kiihdyttää muutoksia BCL – 2: ssa ja bax: ssa yhdistämällä siihen vastaavan promoottorin (Li et al., 2010). Erk5 / KLF4 cascade voi toimia pivot eri reittejä, jotka suojaavat hermosoluja oksidatiivisen stressin aiheuttama kuolema (Su et al., 2014).
oksidatiivisen stressin on katsottu liittyvän läheisesti moniin degeneratiivisiin sairauksiin. KLF4: llä on merkittävä rooli geneettisen stabiilisuuden ylläpitämisessä oksidatiivisessa stressissä. KLF4 ja ERK5 toimivat yhdessä suojaamaan hermosoluja oksidatiivisen stressin aiheuttamalta apoptoosilta. Siksi klf4 voi aktivoituessaan toimia terapeuttisena kohteena oksidatiivista stressiä vastaan. On raportoitu, että statiinilääkkeet voivat aktivoida ERK5: tä, mikä johtaa KLF4: n ja siitä riippuvaisten geenien ilmentymiseen (Ohnesorge et al., 2010), mutta mekanismi on edelleen epäselvä, ja KLF4: ään liittyviä ylä-ja loppupään kohdegeenejä tutkitaan vähemmän oksidatiivisessa stressissä, tarvitaan lisätutkimuksia.
KLF4: n rooli aksonien uudistumisessa
aksonien varhainen häviäminen on yleinen piirre hermoston rappeutumissairauksissa. Synaptinen menetys ja liikenteen heikkeneminen AD voi aiheuttaa kognitiivisia häiriöitä (Holtzman et al., 2011; Coleman, 2013). Deklaratiivisen muistivaurion aste liittyy hippokampuksen ja aivokuoren synaptiseen tiheyteen. Liukoiset Aß-oligomeerit vähentävät glutamaatin sisäänottoa ja edistävät synaptista toimintahäiriötä, mikä häiritsee synaptista plastisuutta (Li et al., 2009). Siksi on erityisen tärkeää tutkia, miten keskushermoston aksonit korjataan. Verkkokalvon ganglionisoluissa aksoneilla on vahva kyky kasvaa ja uudistua varhaisen kehityksen aikana, mutta aikuisten nisäkkäiden keskushermostossa aksonit menettävät uudistumiskykynsä ja neuronit voivat valmistua kuolemaan tai surkastua (Goldberg and Barres, 2000; Goldberg et al., 2002).
KLF4: llä on tärkeä rooli aksonien kasvun estämisessä. Alkioiden RGCs: ssä klf4: n yliekspressio voi vähentää neuriittien venymäprosenttia, aksonien ja dendriittien pituutta sekä neuriittien haarautumista. Lisäksi todettiin, että klf4: n yliekspressio voi vähentää pitkän aikavälin postnataalisia aksonien kasvunopeuksia, mutta ei onnistunut vähentämään lyhytaikaisia aksonien kasvunopeuksia (Moore ym., 2009; Steketee et al., 2014). Myöhemmissä tutkimuksissa on havaittu, että klf4–cKO-hiirten aksonikimput olivat verrokkihiiriä paksumpia (Fang et al., 2016). Lisäksi klf4-ilmentymän poistaminen kehityksen aikana voi lisätä aikuisten RGC: iden lisääntymismahdollisuuksia. Lisäksi KLF4: llä, jolta puuttui C-terminaalinen DNA: ta sitova domeeni, ei ollut vaikutusta aksonien kasvuun. Ei ollut vaikutusta solujen eloonjäämiseen verkkokalvon ganglion solujen loukkaantumisen jälkeen, jos KLF4 oli tyrmäävä (Moore et al., 2009).
KLF4 voi vaikuttaa myös aksonaaliseen regeneraatioon. Tuore tutkimus kertoi, että klf4-ekspression väheneminen aikuisten verkkokalvon ganglionisoluissa edisti aksonien uudistumista JAK-STAT3-reitin kautta (Qin et al., 2013). KLF4 lisäsi STAT3: n fosforylaatiota ja sääteli aksonien kasvua JAK-STAT-signaloinnilla (Qin and Zhang, 2012). Sytokiinien hoidossa stat-proteiiniperheen jäsenet fosforyloituvat solun karboksi-terminaalisissa tyrosiini-ja seriinipaikoissa stabiiliksi dimeeriksi. Tämä muutos parantaa transkriptio soluun liittyvien geenien (Yuan et al., 2005). KLF4: n ja STAT3: n yhteisvaikutus tyrosin705: n sytokiinin aiheuttamaan fosforylaatioon estää STAT3: n ilmentymistä estämällä STAT3: n sitoutumista DNA: han (Qin ym., 2013). KLF4 knockdown parantaa ilmeisesti aksonin uusiutumista verkkokalvon ganglionisoluissa näköhermon loukkaantumisen jälkeen ja estää hermoa loukkaantumasta lievän aivovamman jälkeen. Toimet välittyvät P-p53: n vähenemisestä ja pstat3: n tason noususta. KLF4 säätelee positiivisesti neuronaalista apoptoosia p53-ja JAK-STAT3-reittien kautta, ja KLF4 säätelee negatiivisesti aksonaalista korjautumista JAK-STAT3-reitin kautta (Cui et al., 2017).
siksi oletimme, että AD: ssä aksonaalinen regeneraatio voidaan toteuttaa muuttamalla KLF4: n ilmentymää tai muuttamalla solunsisäisiä siihen liittyviä signalointireittejä ja kontrolloimalla AD: n etenemistä vähentämällä puuttuvia aksoneja tai vähentämällä aksonaalista toimintahäiriötä. Klf4-transkriptiotekijän käyttö mahdollisissa terapeutiikassa vaatii kuitenkin vielä lisätutkimuksia.
Klf4: n rooli raudan kertymisessä
rautaa esiintyy laajalti biologisissa järjestelmissä, rautaan liittyvillä metalloproteinaaseilla on keskeinen rooli hapen kuljettamisessa, elektronien siirtämisessä ja biokemiallisten reaktioiden katalysoinnissa (Aisen et al., 2001). Normaalin fysiologisen alueen ylittävä raudan liika määrä voi kuitenkin vahingoittaa ihmisen terveyttä (Adlard and Bush, 2006). Tutkimuksissa on havaittu, että hippokampuksen rautapitoisuus korreloi negatiivisesti muistitestien suorituksen kanssa (Ding et al., 2009). Lisääntynyt rautakuormitus aivoissa nopeuttaa Aß-plakkien ja hyperfosforyloitujen tau-tanglien muodostumista, samalla kun se lisää oksidatiivista stressiä (Peters et al., 2015). Rauta, jolla on korkea läpäisevyysaste, edistää hermosolujen kasvua ja solujen välisiä yhteyksiä aivojen kehityksen aikana (Dallman and Spirito, 1977).
tuore tutkimus osoitti, että fysiologinen stressi aiheutti klf4-HCP1-signalointireitin aktivoitumista ja hemin oton lisääntymistä (Li H. et al., 2017). Heme muodostaa 95% ihmisen elimistön toimivasta raudasta. Se on yksi heme-oksigenaasin (Hooda et al., 2014; Kurucz et al., 2018). Oksygenaasi-1: n aktiivisuuden lisääminen voi viivästyttää ikääntyvien aivojen hapettumista (Verdile et al., 2015; Serini ja Calviello, 2016; Kurucz et al., 2018). Tämä on helpotus vaikutus AD. Fysiologinen stressi indusoi glukokortikoiditason nousua, glukokortikoidi lisää heme – kantajaproteiini 1: n (HCP1) ilmentymistä KLF4: n kautta ja sitten HCP1 edistää heme-kertymää (Li H. et al., 2017). Glukokortikoidi ja KLF4 säätelevät yhdessä anti-inflammatorisia geenejä, eivätkä solut, joilla on alhainen glukokortikoidipitoisuus, pysty täysin indusoimaan KLF4-ekspressiota (Sevilla et al., 2015). KLF4: n aiheuttama hemin saannin lisääntyminen johtaa raudan kertymiseen aivoihin. Rauta edistää Rosin vapautumista (Tronel et al., 2013). Rauta elementti lisää aivojen oksidatiivista stressiä rotilla alle psykologista stressiä (Yu et al., 2011). Siksi KLF4 ja glukokortikoidi voivat säädellä HCP1: tä yhdessä. HCP1: n lisääminen parantaa hemin kertymistä, mikä johtaa suoraan raudan kertymiseen aivoihin, pahentaa hapettumista, lisää apoptoosia tai toimintahäiriötä ja pahentaa aivovaurioita.
on yleisesti hyväksytty, että muisti-ja oppimisvaikeudet ovat Alzheimerin taudin tärkeimmät oireet. Suuri määrä kliinistä tietoa on osoittanut, että aß plakin kuormitus ja raudan kertyminen vastaus kehityksen oppimisen ja kognitiivisen toimintahäiriön AD (van Bergen et al., 2018). Äskettäin julkaistut tiedot ovat ehdottaneet, että suuriannoksinen rauta lisää aß-laskeumaa ja heikentää oppimista ja muistia hiirillä (Guo et al., 2013). Kliiniset tutkimukset ovat osoittaneet, että rautaa sisältävää mikrogliaa löytyy magneettikuvauksen kohteena olevien AD-potilaiden hippokampuksesta (Zeineh et al., 2015). Mikroglia hankkii rautaa siirtävistä tai siirtämättömistä, solunulkoisista ja solunsisäisistä lähteistä (McCarthy et al., 2018). Selektiivinen ja jatkuva KLF4-ekspressio voidaan indusoida iskeemisen hippokampaalisen reaktiivisen astrosyyttien tumassa ja sytoplasmassa (Park et al., 2014). Tutkimukset ovat osoittaneet, että KLF4 toimii transkriptioiden repressorina. Se alas-säätelee Elk-3: n ilmentymistä, ja sitten ELK-3 estää Ho-1: n ilmentymisen (Tsoyi et al., 2015). Heme-oksigenaasi – 1 (HO-1) on stressiproteiini, joka hajottaa hemen bilirubiiniksi, vapaaksi raudaksi ja hiilimonoksidiksi. HO-1: n säätely astrosyyteissä voi johtaa epänormaaliin raudan kertymiseen ja mitokondrioiden toimintahäiriöön aivoissa, mikä johtaa kognitiivisen kyvyn heikkenemiseen (Schipper, 1999, 2004). Siksi KLF4 saattaa osallistua astrosyyttien raudan kertymisprosessiin, mikä pahentaa hapettumista AD: ssa ja pahentaa aivovaurioita.
johtopäätös
KLF4: llä tiedetään yleisesti olevan keskeinen rooli solujen proliferaation, apoptoosin ja erilaistumisen säätelyssä. Aiemmat tutkimukset ovat keskittyneet klf4: n säätelyyn useissa tärkeissä neurofysiologisissa prosesseissa, mukaan lukien neuroinflammaatio, neuroprotektio ja synaptinen regeneraatio. Viime aikoina KLF4: llä on todettu olevan tärkeä rooli AD: n patogeneesissä. Tässä artikkelissa tarkastelemme klf4: n roolia neuroprotektiossa ja neurogeneesissä AD: ssä.
KLF4 ei ole ainoastaan solujen proliferaation ja erilaistumisen säätelijä, vaan myös mahdollinen kohde immuunivasteen säätelyssä. KLF4 voi säädellä negatiivisia tulehdustekijöitä ja edistää tulehdusreaktiota, ja sillä on suuri vaikutus astrosyytin ydinvoiman mikroglian ilmentymiseen. Lisäksi KLF4 ja ERK5 voivat toimia yhdessä neuroprotektiivisten vaikutusten aikaansaamiseksi. Lisäksi aksonin regenerointi voidaan toteuttaa muuttamalla spesifisten transkriptiotekijöiden sisältöä, solunsisäisiä inhibiittoreita tai muuttamalla solunsisäisiä signalointireittejä. Klf4: n tyrmääminen voi tehostaa aksonien uudistumista ja nopeuttaa aksonien kasvunopeutta. Klf4: n ekspression väheneminen edistää aksonien regeneraatiota JAK-STAT3-reitin kautta, ja KLF4 edistää JAK-STAT3-reittiä aksonien regeneroinnin jatkamiseksi. Siksi KLF4 saattaa osallistua anti-inflammatorisen, anti-apoptoosin, aksonien regeneraation ja raudan kertymisen prosessiin keskushermostossa, jolla on keskeinen rooli AD-generaatiossa. Nämä havainnot viittaavat siihen, että KLF4 on mahdollinen AD: n terapeuttinen kohde. KLF4: n vaikutusten syvä solu-ja molekyylimekanismi AD: hen on kuitenkin edelleen epäselvä, ja lisätutkimuksia tarvitaan.
tekijän osuudet
zqc, XHZ ja YJ kirjoittivat käsikirjoituksen. SHG ja JYL muokkasivat käsikirjoituksen puitteita. BJL ja RJC toimittivat kriittiset tarkistukset. Kaikki kirjoittajat hyväksyivät käsikirjoituksen lopullisen version toimitettavaksi.
Rahoitus
tätä työtä on tuettu Kiinan Natural Science Foundationin (NSFC) (81871070, 31571126, 31471120) ja Jilin Science and Technology Agencyn rahoituksella (Apurahanumerot 20180519003jh, 20180414051gh, 20170414034gh ja 20180414050gh).
Eturistiriitalausunto
kirjoittajat toteavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, joita voitaisiin pitää mahdollisena eturistiriitana.
Cacabelos, R. (2018). Onko Alzheimerin taudin lääkkeiden löytämisessä tapahtunut parannuksia viimeisten 5 vuoden aikana. Käyt.viim. Opinista. Drug Discov. 13, 523–538. doi: 10.1080/17460441.2018.1457645
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
Liu, Y., Shi, J., and Chen, X. (2015). Kausiluonteisen allergisen nuhan uudet kohteet siitepölykauden aikana ja sen ulkopuolella mikroarray-analyysillä. Acta Otolaryngol. 135, 1330–1336. doi: 10.3109 / 00016489.2015.1067906
PubMed Abstract | CrossRef Full Text | Google Scholar
Serini, S., and Calviello, G. (2016). Oksidatiivisen/nitrosatiivisen stressin vähentäminen aivoissa ja sen osallistuminen N-3 PUFA: n neuroprotektiiviseen vaikutukseen Alzheimerin taudissa. Kurr. Alzheimer Res. 13, 123-134. doi: 10.2174/1567205012666150921101147
PubMed Abstract | CrossRef Full Text / Google Scholar