Introduction
hyönteisten adaptiivista säteilyä erilaisissa ilmastoissa on osaltaan helpottanut diapaussin toistuva kehittyminen, ennakoiva kehityspysähdys ennen epäsuotuisia olosuhteita (esim.talvi, kuiva kausi; Waterhouse ja Norris, 1980; Tauber et al., 1986; Danks, 1987; Hodkova ja Hodek, 2004). Diapause käynnistetään tyypillisesti vastauksena tunnukselliseen ympäristökeppiin (esim., vuodenaikojen muutos photoperiod), ylläpidetään geneettisesti määritetyn ajan, ja sitten lopetetaan, kun suotuisat olosuhteet ovat palanneet. Siten diapause mahdollistaa hyönteisten yhdenmukaistaa niiden kasvua ja lisääntymistä paikallisten vuodenaikojen syklit (Tauber et al., 1986; Danks, 1987). Diapause on tärkeä elämänhistorian, maantieteellisen alueen ja vuodenaikojen runsauden säätelijä monille hyönteispölyttäjille (esim. Kemp and Bosch, 2005; Fründ et al., 2013), maatalouden tuholaiset (esim., Pullin et al., 1991; Li et al., 2012; Levine et al., 2015), ja taudin vektoreita (esim. Denlinger and Armbruster, 2014; Gray et al., 2016). Lisäksi diapause vetoaa laajoihin fysiologisiin muutoksiin, mukaan lukien ravinteiden varausten kertyminen, metabolisen aktiivisuuden tukahduttaminen, anaerobisen katabolian lisääntyminen, solusyklin pysähtyminen, muutokset Wnt-signaloinnissa ja erilaisten stressinsietomekanismien säätely (Denlinger, 2002; Hahn and Denlinger, 2007, 2011; King and MacRae, 2015; Ragland and Keep, 2017). Diapaussin taustalla olevien säätelymekanismien ymmärtäminen on pitkäaikainen ongelma organismibiologiassa ja helpottaa uusien hallintatapojen kehittämistä avainlajeille.
Ekdysteroidit ja nuorten hormonit säätelevät monenlaisia fysiologisia ja kehitysprosesseja hyönteisissä (Gruntenko and Rauschenbach, 2008; Jindra et al., 2013; Palli, 2016), mukaan lukien diapause (Denlinger, 1985; Denlinger et al., 2012). Erityinen hormonaalista signaalia säätelevä diapause taipumus vaihdella vaiheessa, jossa kehityspysähdys tapahtuu (Denlinger et al., 2012). Esimerkiksi kehityspysähdys toukkien tai poikasten diapaussin aikana on tyypillisesti säädelty ecdysteroidin runsauden muutoksilla (esim.Ohtaki and Takahashi, 1972; Bowen et al., 1984; Richard ym., 1987). Sitä vastoin kehityspysähdystä aikuisten diapaussin aikana säätelevät usein muutokset nuorten hormonien runsaudessa (esim.Spielman, 1974; Schooneveld et al., 1977; Saunders ym., 1990 ja katso arvostelu Denlinger et al., 2012).
ymmärryksessämme alkion diapaussin hormonaalisesta säätelystä on merkittävä aukko, jota havaitaan laajalti Lepidopteralla, Orthopteralla, Hemipteralla ja Dipteralla. Edellinen tutkimus on laajasti dokumentoinut alkion diapaussin hormonitoimintaa säätelevää säätelyä silkkiäistoukkien koissa (Bombyx mori) diapaussi-hormonilla (Hasegawa, 1963; Yamashita ja Hasegawa, 1966; Yamashita, 1996). Tämä diapaussi hormonin sääntelytehtävä näyttää kuitenkin olevan ainutlaatuinen B. mori ja siten on antanut vähän tietoa alkion diapaussin hormonaalisesta perustasta muissa lajeissa (Denlinger et al., 2012). B. Morin lisäksi alkion diapaussin hormonaalista säätelyä on todettu vain kolmella lajilla. Mustalaisperäinen Koi (Lymantria dispar) käy läpi kehityspysähdyksen, joka on aloitettu ja jota ylläpitää suurempi ecdysteroidien runsaus (Lee et al., 1997; Lee ja Denlinger, 1997) kun taas alhainen ecdysteroid-runsaus säätelee diapaussia kahdessa heinäsirkassa (Chortoicetes terminifera, Locusta migratoria; Gregg et al., 1987; Tawfik ym., 2002).
tähän mennessä yhdelläkään Dipteraanilajilla ei ole todettu hormonipitoisuuksia alkion diapaussin aikana. Tässä puutumme tähän aukkoon tutkimalla aasialaisen tiikerihyttysen, Aedes albopictuksen, alkion diapaussin hormonaalista säätelyä. Viimeisten 30 vuoden aikana tämä lääketieteellisesti tärkeä vektori (Paupy et al., 2009) on onnistuneesti vallannut lauhkeat alueet maailmanlaajuisesti (Benedict et al., 2007) johtuu osittain alkion diapaussista, joka on helpottanut selviytymistä pitkän matkan kuljetuksissa (Juliano and Lounibos, 2005; Diniz et al., 2017) ja kehittyi nopeasti mukauttamaan kehityspysähdyksen ajoitusta paikallisiin ilmasto-olosuhteisiin (Urbanski et al., 2012). AE: n lauhkeat populaatiot. albopictus syöttää maternaalisesti säädeltyä, fotoperiodista diapaussia. Lyhyissä, syksyisissä päiväkausissa naaraat tuottavat munia, jotka vievät alkion kehityksen loppuun, mutta eivät kestä kuoriutumisärsykkeitä, kun toukat ovat munan kuoressa seuraavaan kevääseen asti. Viime vuosikymmenen aikana alkion diapaussin transkriptiosäätely Ae: ssä. albopictusta on laajasti luonnehdittu (Urbanski et al., 2010; Poelchau et al., 2011,2013a, b; Huang X. et al., 2015; Batz et al., 2017) mutta tämän ratkaisevan sopeutumisen hormonaalista säätelyä ei tunneta. Määritimme 20-hydroxyecdysone (20he) ja juvenile hormone III (JH3) diapausing ja ei-diapausing munia kolmessa vaiheessa, että kiinnitin keskeiset vaiheet alkion kehityksen ja tulkitsi tulokset yhteydessä aiemmin kerätty RNAseq (Poelchau et al., 2013a, b)ja manipulatiivinen data (Suman et al., 2015).
materiaalit ja menetelmät
Munakokoelma
kaikissa mittauksissa käytettiin Ae: n laboratorioyhdyskunnasta peräisin olevia F11-munia. albopictus perustettiin elokuussa 2015 yli 200 toukasta, jotka on kerätty Manassasissa, VA: ssa, Yhdysvalloissa. Ennen tätä koetta populaatiota pidettiin yllä aiemmin kuvatuissa olosuhteissa . Munanäytteiden tuottamiseksi tätä koetta varten F10-toukkia säilytettiin 5,5 litran Sterlite-säiliöissä, joiden tiheys oli noin 250 toukkaa / 2.5 L deionisoitua (DI) vettä, jossa on 5 mL elintarvikelietettä (Armbruster and Conn, 2006) LD-valoperiodissa 21°C: ssa ja 80-prosenttisessa kosteudessa. Joka maanantai-keskiviikko-perjantai toukat suodatettiin hienosilmäisen verkon läpi ja siirrettiin sitten puhtaaseen 5,5 litran Sterliittisäiliöön; kotelot jaettiin aikuisten häkeihin, joita pidettiin joko diapaussia estävässä LD-valoperiodissa tai diapaussia aiheuttavassa lyhytpäiväisessä valoperiodissa (SD, 8:16 L:D).
täysi-ikäisille naisille annettiin viikoittain verikeittoja ja ovipositiokuppi, joka oli vuorattu valkaisemattomalla paperipyyhkeellä ja täytetty puoliksi vedellä, kunnes ovipositio lakkasi. Munat kerättiin päivittäin, niitä säilytettiin märällä paperipyyhkeellä 48 tunnin ajan, minkä jälkeen ne ilmakuivattiin ja säilytettiin säiliöissä SD-olosuhteissa. 5, 7 ja 11 päivän kuluttua munasolun asettamisesta (dpov) kerätyt munat punnittiin 1 µg: n tarkkuudella (keskiarvo: 11, 460 mg, vaihteluväli: 9, 1-19, 5 mg) mx5–mikrobalanssilla (Mettler-Toledo, Columbia, OH, Yhdysvallat), pantiin 1, 5 mL: n putkiin, pakastettiin nestemäisessä typessä klo 11-12 (Zeitgeberin aika 3-4 h) ja varastoitiin -80°C: ssa. Osa munista säilytettiin sen vahvistamiseksi, että LD-ja SD-valoperiod-olosuhteet edistivät muiden kuin diapaussi-ja diapaussi-munien tuotantoa (KS. Urbanski et al., 2012).
otimme näytteitä 5, 7 ja 11 dpov: n munista kahdesta syystä. Ensin Ae. albopictus initiates diapause (sensu Koštál, 2006; Koštál et al., 2017) alkionkehityksen loppuunsaattamisen jälkeen (Mori et al., 1981). Kokeissamme käytetyissä olosuhteissa, Ae. albopictuksen alkiot segmentoituvat noin 5 dpov: ssa ja ei-diapaussin alkiot kykenevät kuoriutumaan noin 7 dpov: ssa (Poelchau et al., 2013a). 11 dpov: llä kehityspysähdys on vakiintunut diapaussin alkioihin (Poelchau et al., 2013b). Niinpä päätimme verrata diapaussin ja ei-diapaussin alkioita aikapisteissä, jotka haarukoivat kuoriutumiskyvyn ajan, mukaan lukien kehityspysähdyksen perustaminen diapaussin aikana. Toiseksi valitsimme aikapisteet, jotka olivat samanlaisia kuin aiemmissa alkioiden rnaseq-kokeissa (Poelchau et al., 2013a, b) jotta nämä tiedot voitaisiin hyödyntää tulkitsemaan nykyisiä tuloksia. Nämä RNAseq-tulokset todettiin aiemmin korreloivan hyvin QRT-PCR: n kautta saatujen geeniekspressiotulosten kanssa (Poelchau et al., 2013a).
Ecdysteroidimääritys
ecdysteroidien uuttamiseksi munanäytteet laitettiin borosilikaattilasiin 0, 5 mL: n kartiopohjaiseen mikrokudosmyllyputkeen (Wheaton, Millville, NJ, Yhdysvallat), johon lisättiin sisäiseksi standardiksi 1 µg farnesolia (Sigma-Aldrich, St. Louis, MO, Yhdysvallat). Munat homogenoitiin käsin kolme kertaa Teflon-survimella 300 µL HPLC-luokan jäähdytetyssä MeOH: ssa, minkä jälkeen niitä kehrättiin 12 000 RCF: ssä 10 minuutin ajan jäähdytetyssä (4°c) sentrifugissa. Saatu supernatantti yhdistettiin ja eluoitiin alumiinioksidikolonnien läpi kahdesti jäähdytetyllä 90-prosenttisella MeOH: lla ja kerran MeOH: lla. Näytteet kuivattiin jäähdytetyssä (4°c) tyhjösentrifugissa, suspendoitiin uudelleen 20 µL MeOH: iin ja säilytettiin -80°C: ssa analyysiin asti. Positiiviset kontrollit valmistettiin lisäämällä 1 µg kutakin 20HE: tä (Sigma-Aldrich) ja farnesolia tyhjiin putkiin, joita muuten käsiteltiin samalla tavalla. Ecdysteroidikonsentraation näytteanalyysi tehtiin micromass Quattro Micro LC-MS/MS (Waters Co., Milford, MA, Yhdysvallat). Injektiotilavuudet olivat 5, 0 µL, ja erotukset suoritettiin käyttämällä ACQUITY UPLC BEH C18 2, 1 mm x 50 mm kolonnia, joissa on 1, 7 µm stationäärifaasi (Waters Co.). LC-ajojen toimintaolosuhteet olivat liikkuva faasivirta 0,37 mL min–1, jossa binäärinen liikkuva faasi oli 0,1% muurahaishappoa asetonitriilissä ja 0,1% muurahaishappoa vedessä. Alkuolosuhteet olivat 1:99 asetonitriili: vesi, jonka jälkeen isokraattinen virtaus 0,3 min. 0,3 min: ssa lineaarinen gradientti 1: stä:99-99:1 asetonitriili: vettä levitettiin 4,2 min, minkä jälkeen 1,0 min isokraattinen virtaus 99: 1 asetonitriili: vesi, jonka jälkeen liikkuva faasi palasi arvoon 1:99 asetonitriili:vesi. Massaspektrometrin asetukset olivat electrospray-positiiviset, ja poistolämpötila oli 350°C. 20he ja farnesol eluoitiin 2.89 ja 4.97 min, ja ne määritettiin käyttämällä monireaktiomonitorointia tyypillisistä siirtymistä: 481.22 (m/z) > 445.24 (M/z) ja 205.41 (m/z) > 121.09 (m/z). Määrityksen havaitsemisraja on noin 5 pg.
Juveniili-hormonin määritys
jokainen munanäyte laitettiin borosilikaattilasiin 0, 5 mL kartiopohjaiseen mikrokudosmyllyputkeen (Wheaton), johon lisättiin 1 µg farnesolia (Sigma-Aldrich) sisäisenä standardina. Munat homogenoitiin käsin kolme kertaa Teflon-survimella 500 µL HPLC-luokan jäähdytetyssä heksaanissa, minkä jälkeen niitä kehrättiin 12 000 RCF: ssä 10 minuutin ajan jäähdytetyssä (4°c) sentrifugissa. Heksaanifraktiot rekombinoitiin puhtaassa borosilikaattilasisessa injektiopullossa ja kuivattiin tyhjiösentrifugoimalla. JH kvantifioitiin kaasukromatografialla / massaspektrometrialla edellä kuvatulla tavalla (Brent ja Vargo, 2003). Jäännös huuhdottiin hetkeksi pois pulloista kolmella huuhtelulla heksaania ja lisättiin alumiinioksidilla täytettyihin borosilikaattilasipilareihin. Epäpuhtauksien suodattamiseksi näytteet eluoitiin kolonnien läpi peräkkäin heksaanilla, 10% etyylieetteriheksaanilla ja 30% etyylieetteriheksaanilla. Kuivaamisen jälkeen näytteitä johdettiin kuumentamalla 60°C: ssa 20 minuutin ajan metyyli-D-alkoholista (Sigma-Aldrich) ja trifluorietikkahaposta (Sigma-Aldrich) koostuvassa liuoksessa. Näytteet kuivattiin, suspendoitiin uudelleen heksaaniin ja eluoitiin uudelleen alumiinioksidikolonnien läpi. Johdannaiset komponentit poistettiin 30-prosenttisella etyylieetterillä. JH-johdannainen kerättiin uusiin injektiopulloihin lisäämällä siihen 50% etyyliasetaatti-heksaania. Kuivauksen jälkeen näytteet suspendoitiin uudelleen heksaaniin ja analysoitiin HP 7890A-sarjan GC: llä (Agilent Technologies, Santa Clara, CA, Yhdysvallat), jossa oli 30 m × 0,25 mm Zebron ZB-VAHAKOLONNI (Phenomenex, Torrance, CA, Yhdysvallat) yhdistettynä HP 5975C-inerttimassaselektiiviseen ilmaisimeen. Heliumia käytettiin kantokaasuna. JH-muoto vahvistettiin ensimmäisissä TESTINÄYTTEISSÄ skannaustilassa JH 0 -, JH I -, JH II -, JH3-ja JH3-etyylien tunnettujen allekirjoitusten osalta; JH3 vahvistettiin tämän lajin ensisijaiseksi endogeeniseksi muodoksi. Myöhemmät näytteet analysoitiin MS SIM-moodilla ja M/z 76: n ja 225: n kohdalla JH3: n D3-metoksihydriinijohdannaisen spesifisyyden varmistamiseksi. Kokonaissuuruus kvantifioitiin standardikäyrällä, jossa on derivoitu JH3 ja jota on mukautettu munien lähtömassalle. Määrityksen havaitsemisraja on noin 1 pg.
Tilastoanalyysit
analyysit tehtiin R: ssä (R Core Team, 2019). JH3-runsaus log-muunnettiin ja analysoitiin anovan avulla diapaussin tilan, iän ja niiden vuorovaikutuksen vaikutusten testaamiseksi. 20he runsaus oli epälineaarinen ja sovi käyttäen kahta polynomin regressiomallia: täysi malli, joka sisältää iän ja kehitystason (diapause, ei-diapause), ja pelkistetty malli, joka sisältää vain iän. Malleja verrattiin anovan avulla sen määrittämiseksi, paransivatko kehitystilanne selitystehoa merkittävästi.
Transkriptioanalyyseissä käytettiin aiemmin kerättyjä RNAseq-tietoja diapaussista ja ei-diapaussista Ae. albopictus eggs (täydentävä aineisto 1; Poelchau et al., 2013A, b). Eri tavoin ilmaistut geenit 3, 6 ja 11 dpov tutkittiin geenijoukon rikastusanalyyseillä (Moota et al., 2003) käyttäen Pianopakettia (Väremo et al., 2013) asetetaan oletusparametreiksi, joita seuraa FDR-korjaus. Referenssigeenijoukko merkittiin vektoribaasilla (Giraldo-Calderón et al., 2015). JH3-ja ecdysteroidisynteesireitin geenit sekä JH3-reseptorit ja hajoamisgeenit merkittiin manuaalisesti aiemman kirjallisuuden mukaan (Bai et al., 2007; Li et al., 2011; Nouzova et al., 2011; Niwa ja Niwa, 2014; Matthews et al., 2016). Lisäksi olemme merkinneet JH3 ja ecdysteroid inducble geenit perustuu geenin kuvaukset annetaan VectorBase (Giraldo-Calderón et al., 2015). Täydellinen yleiskuva näistä geenijoukoista esitetään täydentävässä aineistossa 1.
tulokset
Diapaussin keskimääräinen esiintyvyys oli 95, 9% (vaihteluväli: 90, 5–100%) SD-valojaksolla ja 5.4% (vaihteluväli: 1,8–9,5%) alle LD photoperiod (täydentävä tietokokonaisuus 2); siten meidän photoperiodic hoitoja induced odotettu diapause vastauksia. 20HE oli korkeimmillaan sekä diapaussin että ei-diapaussin olosuhteissa 7 dpov: ssä, mutta diapaussin tilan sisällyttäminen tekijänä neliömallissa 20he: lle runsaus ei parantanut mallin selittävää tehoa (Kuva 1A ja täydentävät tiedot 3; F3,43 = 0,21, p = 0,890). Nämä tulokset osoittavat, että diapaussin tila ei merkittävästi selitä vaihtelua 20HE titterissä. Rnaseq: n reittianalyysi osoitti, että 20he: n synteesireitti ja 20he: n indusoituvat geenit eivät muuttuneet merkitsevästi diapaussin ja ei-diapaussin olosuhteissa 3, 6 tai 11 dpov: n kohdalla (Taulukko 1).

Taulukko 1. Geenijoukon rikastusanalyysin tulokset, KS. täydentävä tietokokonaisuus 1, sisältää täydellisen yhteenvedon näistä geenijoukoista.
JH3: n vahvistettiin olevan tämän lajin ensisijainen nuorisohormonin muoto. JH3: n runsaus väheni merkittävästi diapaussin alkioilla (Kuva 1B ja lisäaineisto 3; F1,64 = 5, 08, p = 0, 028). Ikä (F2,64 = 0, 66,p = 0, 518) ja diapaussin tilan ja iän yhteisvaikutus (F2, 64 = 0, 13, p = 0, 883) eivät kuitenkaan vaikuttaneet JH3-tasoihin. Rnaseq-tietojen reittianalyysi osoitti, että JH3-synteesireitti tukahdutettiin merkitsevästi 3 dpov: ssa ja JH-induktiiviset geenit tukahdutettiin merkitsevästi 6 dpov: ssa (kuva 2 ja taulukko 1).
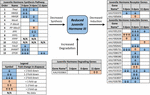
kuva 2. Yhteenveto JH3: n synteesiin, hajoamiseen ja induktioon osallistuvien geenien erilaisesta ilmentymisestä Ae: lle. albopictus (Poelchau et al., 2013A, b). Merkittävät diapaussin aiheuttamat vähennykset (sininen) tai lisäykset (oranssi) on merkitty varjostetuilla soluilla. Differentiaali magnitudi on merkitty nuolilla, jotka on kuvattu legendassa vasemmassa alakulmassa. ∗Geenit, joilla ei ole yhteistä nimeä, tunnistetaan Vektoribaasin tunnistenumerolla.
Keskustelu
Diapause on laajalle levinnyt sopeutuma, jonka avulla hyönteiset voivat sovittaa kasvunsa ja lisääntymisensä kausittain suotuisiin olosuhteisiin (Tauber et al., 1986; Danks, 1987). Hormonaalisten muutosten ymmärtäminen, jolla hyönteiset koordinoivat ulkoisten, diapaussia aiheuttavien vihjeiden havaitsemista fysiologisten mekanismien kanssa, jotka johtavat kehityspysähdykseen, on pitkäaikainen tavoite biologiassa (Lees, 1956; Denlinger, 2002). Vuosikymmenten tutkimus on johtanut yhteisten hormonaalisten strategioiden tunnistamiseen diapaussille toukkien, poikasten ja aikuisten vaiheissa; kuitenkin alkion diapaussin hormonaalinen säätely on edelleen suurelta osin tuntematon, erityisesti Dipterassa (Denlinger, 1985, 2002; Denlinger et al., 2012). Tässä tutkimuksessa suora mittaus vähentää JH3 runsautta diapause on vahvistanut aiemman geenin ekspressioprofilointi (Poelchau et al., 2013a, b)ja manipulatiiviset kokeet (Suman et al., 2015) tukee hypoteesia, jonka mukaan JH3 säätelee alkion diapaussia tässä lajissa.
Ekdysteroidit
tässä tutkimuksessa mitattiin suoraan ekdysteroidien runsautta kolmessa aikapisteessä diapaussin ja ei-diapaussin olosuhteissa hyttysen AE: n alkioissa. albopictus. Toxorhynchites amboinensis-bakteerin (Russo and Westbrook, 1986) aiempien tulosten mukaisesti 20he-tasot olivat korkeimmillaan lähellä alkion kehityksen päättymistä (7 dpov; Kuva 1a). 20HE tiitteri ei kuitenkaan eronnut merkittävästi diapaussin ja ei-diapaussin munien välillä. Lisäksi 20HE-synteesireitillä tai 20he-indusoituvilla geeneillä ei tapahtunut merkittäviä koordinoituja muutoksia geenien ilmentymisessä (Taulukko 1). Voimme päätellä, että toisin kuin aiemmin tutkittu alkion diapaents Lepidoptera ja Orthoptera (Hasegawa, 1963; Yamashita and Hasegawa, 1966; Gregg et al., 1987; Yamashita, 1996; Lee ja Denlinger, 1997; Lee et al., 1997; Tawfik ym., 2002), 20HE ei sääntele diapaussin aloittamista Ae: ssä. albopictus.
Juveniili hormoni
sitä vastoin havaitsimme diapaussin alkioissa noin kaksinkertaista JH3: n runsautta (Kuva 1b). Vaikka pienempi suuruusluokka kuin erot JH3 runsaus havaittu diapause vs. ei-diapause olosuhteissa hyönteisiä, jotka diapause muissa elämän vaiheissa (esim., Yin and Chippendale, 1979; Walker and Denlinger, 1980; Readio et al., 1999), suoria mittauksiamme tukevat transkriptiotodisteet (kuva 2). Esimerkiksi JH3-synteesireitti tukahdutetaan merkittävästi varhaisen diapaussin valmistuksen (3 dpov) aikana. Näiden tulosten tulkintaa tukevat aiemmat tutkimukset ovat havainneet, että geenien vähentynyt ilmentyminen JH3-synteesireitin varrella korreloi voimakkaasti alemman JH3-runsauden kanssa sekä Aedes aegyptissä (Nouzova et al., 2011; Rivera-Perez et al., 2014)ja Diploptera punctata (Huang J. et al., 2015). JH-induktiiviset geenit tukahdutetaan myös merkittävästi myöhäisen diapaussin valmistuksen aikana (6 dpov; Taulukko 1), mikä viittaa siihen, että diapaussin käyttöön tarkoitetuilla alkioilla on rajallinen kyky vastata JH3-signalointiin lähellä aikaa, jolloin ei-diapaussin alkiot tulevat kykeneviksi kuoriutumaan. Lisäksi JH3-hajoavan entsyymin (JH-esteraasin) geeniekspressio on merkittävästi lisääntynyt varhaisen diapaussin ylläpidossa (11 dpov; kuva 2) sekä myöhemmin diapaussin ylläpidossa (21 ja 40 dpov; Poelchau et al., 2013b) viittaa siihen, että JH3 saattaa pysyä vähäisessä runsaudessa koko diapaussin ajan tässä lajissa.
vähenevä JH3: n runsaus kehityspysähdyksen aikana on jossain määrin vastavaikuttavaa, koska alhainen nuoruusiän hormonititteri liittyy tyypillisesti eteneviin Suliin, erityisesti toukkavaiheesta kotelovaiheeseen (Palli, 2016). Kuitenkin soveltaminen JH3 analoginen (pyriproksifeeni) diapause Ae. albopictus-munat nopeuttavat diapaussin päättymisnopeutta annosriippuvaisesti (Suman et al., 2015). Tehokkaimmalla annoksella noin 80% pyriproksifeenille altistuneista munista lopettaa diapaussin 30 dpov: lla verrattuna vain 1%: n diapaussin päättymiseen 80 dpov: lla kontrollimunissa (Suman et al., 2015). Muutokset JH3: n runsaudessa voivat myös synnyttää alkion diapaussin kaltaisen fenotyypin muilla lajeilla. Esimerkiksi B. mori, kokeellinen vähentäminen JH3 synteesi jhamt knockout tulokset täysin kehittynyt pharate toukat, jotka eivät reagoi kuoriutumisen ärsykkeitä; tämä fenotyyppi voidaan pelastaa annosriippuvaisesti soveltamalla joko uutettu JH3 tai metopreeni, JH3 analoginen (Nakao et al., 2015). Samoin kokeellinen toisen nuoruusiän hormonin analogisen (RO-20-3600) lisääminen äskettäin talletettuihin Drosophila melanogaster-muniin tuottaa faraattitoukkia, jotka liikkuvat munan sisällä mutta eivät kuoriutu (Smith and Arking, 1975). Yhdessä nämä tiedot osoittavat, että nuoruusiän hormonien runsaus todennäköisesti vaikuttaa kuoriutumisvasteiden säätelyyn erilaisissa hyönteisissä. Alkion diapause pharate toukka vaiheessa määritellään epäonnistuminen vastata kuoriutumisen ärsykkeisiin siten, muutokset nuorten hormonin runsaus voi edustaa yhteistä hormonaalista strategiaa säännellä tätä muotoa diapause.
yhdessä aikaisempien transkriptioiden ja manipulatiivisten tietojen kanssa tuloksemme viittaavat voimakkaasti vähentyneeseen JH3: n runsauteen alkion diapaussin todennäköisenä säätelijänä Ae: ssä. albopictus. Tämä tutkimus on ensimmäinen suora kvantifiointi hormonien runsauden aikana alkion diapause tahansa Dipteran lajeja ja on tärkeä askel kohti selkeyttää hormonaalista säätelyä tämän ratkaisevan sopeutumisen epäsuotuisiin ympäristöihin. Ulkoisten ärsykkeiden ja kehityspysähdyksen välisen yhteyden luonnehtiminen hormonaalisen signaloinnin kautta on edelleen suuri haaste(Denlinger, 1985; Denlinger et al., 2012). Näiden reittien selventäminen eri lajeilla antaa kriittistä tietoa perus-ja sovelletuista ongelmista, kuten elämänhistoriallisen evoluution molekyylitason ja fysiologisen perustan ymmärtämisestä, lajien vasteiden ennustamisesta ilmastonmuutokseen sekä uusien tavoitteiden tunnistamisesta tuholaisten ja tartunnanlevittäjälajien hallitsemiseksi (Denlinger, 2008).
tiedon Saatavuuslausunto
Kaikki tätä tutkimusta varten luodut aineistot sisältyvät artikkeliin/Täydennysaineistoon.
Tekijäosuudet
ZB, CB ja PA osallistuivat tutkimuksen suunnitteluun, suunnitteluun ja laativat käsikirjoituksen alkuperäisen luonnoksen. ZB, MM ja JS suorittivat karjanhoidon ja keräsivät munanäytteet. CB suoritti LC-MS/MS-ja GC-MS-analyysit. ZB suoritti tilastolliset analyysit. Kaikki kirjoittajat osallistuivat käsikirjoituksen tarkistamiseen ja hyväksyivät toimitetun version.
Rahoitus
tätä työtä tukivat National Institutes of Health (1R15A|111328-01) ja Davisin Perheavustukset PA: lle.
eturistiriita
kirjoittajat toteavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, joita voitaisiin pitää mahdollisena eturistiriitana.
kiitokset
Kiitämme Allan Knopfia ja Dan Langhorstia avusta hormonitittereiden mittaamisessa. Kiitämme myös David Denlingeriä avuliaista kommenteista käsikirjoituksen aiempiin versioihin. Kauppanimien tai kaupallisten tuotteiden käyttö tässä artiklassa on tarkoitettu yksinomaan erityisten tietojen antamiseen, eikä se edellytä Yhdysvaltain maatalousministeriön suositusta tai hyväksyntää. USDA on yhtäläisten mahdollisuuksien tarjoaja ja työnantaja.
Lisämateriaali
R Ydinryhmä (2019). R: kieli ja ympäristö tilastollista tietojenkäsittelyä varten. Wien: R Ydinryhmä.
Google Scholar
Väremo, L., Nielsen, J., and Nookaew, I. (2013). Rikastetaan genomin laajuisen aineiston geenijoukkoanalyysiä sisällyttämällä siihen geeniekspression suuntaisuus ja yhdistämällä tilastollisia hypoteeseja ja menetelmiä. Nucleic Acids Res. 41, 4378-4391. doi: 10.1093 / nar / gkt111
PubMed Abstract / CrossRef Full Text / Google Scholar