yleisnimi: natriumpolystyreenisulfonaatti
annosmuoto: oraalinen, peräsuolen jauhe
lääketieteellisesti arvostellut Drugs.com. viimeksi päivitetty Sep 21, 2020.
- yleiskatsaus
- haittavaikutukset
- annostus
- ammatillinen
- yhteisvaikutukset
- lisää
- Kaleksaattijauhe kuvaus
- Kaleksaattijauhe-Kliininen farmakologia
- käyttöaiheet ja käyttö Kaleksaattijauheelle
- vasta-aiheet
- Varoitukset
- varotoimet
- Lääkkeiden yhteisvaikutukset
- imettävät äidit
- pediatrinen käyttö
- haittavaikutukset
- yliannostus
- Kalexate-jauheen Annostus ja anto
- miten Kaleksaattijauhetta toimitetaan
- pakkausmerkintä.PÄÄNÄYTTÖTAULU
- lisää Kaleksaatista (natriumpolystyreenisulfonaatista)
- Consumer resources
- Professional resources
- asiaan liittyvät hoito-oppaat
Kaleksaattijauhe kuvaus
Natriumpolystyreenisulfonaatti, USP, on bentseeni, Dietenyylipolymeeri, etenyylibentseenin kanssa sulfonoitu, natriumsuola ja sillä on seuraava rakennekaava:
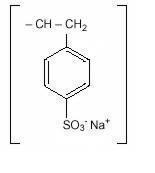
lääke on kermasta vaaleanruskeaan hienoksi jauhettua, jauhettua natriumpolystyreenisulfonaattia, natriumfaasissa valmistettua kationinvaihtohartsia, jonka in vitro-vaihtokapasiteetti on noin 3.1 mekv (in vivo noin 1 mekv) kaliumia grammaa kohti. Natriumpitoisuus on noin 100 mg (4,1 mEq) grammaa lääkettä kohti. Se voidaan antaa suun kautta tai peräruiskeena.
Kaleksaattijauhe-Kliininen farmakologia
kun hartsi kulkee suolta pitkin tai säilyy paksusuolessa peräruiskeen antamisen jälkeen, natriumionit vapautuvat osittain ja korvautuvat kaliumioneilla. Suurimmaksi osaksi tämä vaikutus tapahtuu paksusuolessa, joka erittää kaliumioneja enemmän kuin ohutsuoli. Tämän prosessin tehokkuus on rajallinen ja arvaamattomasti vaihteleva. Se yleisesti approksimoi järjestyksessä 33 prosenttia, mutta alue on niin suuri, että lopullinen indeksit elektrolyyttitasapainon on selvästi seurattava.
metabolisia tietoja ei ole saatavilla.
käyttöaiheet ja käyttö Kaleksaattijauheelle
Natriumpolystyreenisulfonaatti, USP on tarkoitettu hyperkalemian hoitoon.
vasta-aiheet
Natriumpolystyreenisulfonaatti, USP on vasta-aiheinen seuraavissa olosuhteissa: potilaat, joilla on hypokalemia, potilaat, joilla on ollut yliherkkyyttä polystyreenisulfonaattihartseille, obstruktiivinen suolistosairaus, vastasyntyneet, joiden suoliston motiliteetti on alentunut (leikkauksen tai lääkkeen indusoiman) ja suun kautta annettu vastasyntyneille (KS.varotoimet).
Varoitukset
Suolistonekroosi: Suolinekroositapauksia, jotka voivat johtaa kuolemaan, ja muita vakavia maha-suolikanavan haittavaikutuksia (verenvuoto, iskeeminen koliitti, perforaatio) on raportoitu Natriumpolystyreenisulfonaatin ja USP: n käytön yhteydessä. Suurin osa näistä tapauksista liittyi sorbitolin samanaikaiseen käyttöön. Maha-suolikanavan haittatapahtumien riskitekijöitä oli monissa tapauksissa, kuten ennenaikaisuus, aiempi suolistosairaus tai leikkaus, hypovolemia sekä munuaisten vajaatoiminta ja vajaatoiminta. Sorbitolin samanaikaista käyttöä ei suositella (KS.varotoimet, yhteisvaikutukset lääkkeiden kanssa).
* käytä vain potilaille, joiden suoli toimii normaalisti. Vältä valmisteen käyttöä potilailla, joilla ei ole ollut suolen toimintaa leikkauksen jälkeen.
* vältä valmisteen käyttöä potilailla, joilla on ummetuksen tai impaktion riski (mukaan lukien potilaat, joilla on aikaisemmin ollut impaktiota, krooninen ummetus, tulehduksellinen suolistosairaus, iskeeminen koliitti, verisuonten suoliston ateroskleroosi, aiempi suolen resektio tai suolitukos).
* käyttö tulee keskeyttää potilailla, joilla esiintyy ummetusta.
vaihtoehtoinen hoito vaikeassa Hyperkalemiassa
koska seerumin kaliumpitoisuuden tehokas alentaminen Natriumpolystyreenisulfonaatilla voi kestää tunteja tai päiviä, pelkkä hoito tällä lääkkeellä voi olla riittämätön korjaamaan nopeasti vaikeaa hyperkalemiaa, joka liittyy nopeaan kudosvaurioon (esim.palovammat ja munuaisten vajaatoiminta) tai hyperkalemiaa, joka on niin merkittävä, että se muodostaa lääketieteellisen hätätilan. Sen vuoksi olisi aina harkittava muita lopullisia toimenpiteitä, dialyysi mukaan luettuna, ja ne voivat olla välttämättömiä.
Hypokalemia
Natriumpolystyreenisulfonaattihoito voi aiheuttaa vakavaa kaliumin puutosta. Vaikutus on kontrolloitava huolellisesti seerumin kaliumpitoisuuksilla joka 24 tunnin jakson aikana. Koska solunsisäinen kaliumin puute ei aina näy seerumin kaliumtasoilla, taso, jolla natriumpolystyreenisulfonaatti, USP-hoito on lopetettava, on määritettävä yksilöllisesti jokaiselle potilaalle. Tärkeitä apuvälineitä tämän määrittämisen ovat potilaan kliininen tila ja EKG. Vaikean hypokalemian varhaisiin kliinisiin merkkeihin kuuluu ärtyneen sekavuuden ja viivästyneiden ajatusprosessien malli.
Elektrokardiografisesti vaikeaan hypokalemiaan liittyy usein pidentynyt Q-T-intervalli, T-aallon laajeneminen, litistyminen tai kääntyminen ja huomattavat U-aallot. Myös sydämen rytmihäiriöitä voi esiintyä, kuten ennenaikaista eteisen, solmukohtien, ja kammion supistukset, ja supraventrikulaarinen ja kammion tachycardias. Digitaliksen myrkkyvaikutukset ovat todennäköisesti liioiteltuja. Huomattava hypokalemia voi ilmetä myös vaikeana lihasheikkoutena, joka toisinaan ulottuu frank-halvaukseen.
elektrolyyttihäiriöt
kuten kaikki kationinvaihtohartsit, Natriumpolystyreenisulfonaatti, USP ei ole täysin selektiivinen (kaliumin suhteen) vaikutuksiltaan, ja pieniä määriä muita kationeja, kuten magnesiumia ja kalsiumia, voi myös hävitä hoidon aikana. Näin ollen potilaita, jotka saavat Natriumpolystyreenisulfonaattia, USP: tä, on tarkkailtava kaikkien mahdollisten elektrolyyttihäiriöiden varalta.
systeeminen alkaloosi
systeemistä alkaloosia on raportoitu, kun kationinvaihtohartseja on annettu suun kautta yhdessä ei-imeytyviä kationeja luovuttavien antasidien ja ulostuslääkkeiden, kuten magnesiumhydroksidin ja alumiinikarbonaatin kanssa. Magnesiumhydroksidia ei tule antaa Natriumpolystyreenisulfonaatin kanssa, USP. Yksi grand mal-kohtaustapaus on raportoitu kroonista munuaisten vajaatoimintaa sairastavalla hypokalsemiaa sairastavalla potilaalla, jolle annettiin natriumpolystyreenisulfonaattia, USP: tä ja laksatiivina magnesiumhydroksidia. Varotoimet, Lääkkeiden yhteisvaikutukset.)
varotoimet
varovaisuutta on noudatettava, kun Natriumpolystyreenisulfonaattia annetaan potilaille, jotka eivät siedä pienintäkään natriumpitoisuuden nousua (ts.vaikea kongestiivinen sydämen vajaatoiminta, vaikea hypertensio tai huomattava turvotus). Tällaisissa tapauksissa voi olla tarpeen rajoittaa natriumin saantia muista lähteistä.
kliinisesti merkitsevän ummetuksen ilmetessä Natriumpolystyreenisulfonaattihoito on keskeytettävä, kunnes suolen toiminta on jälleen normaali (KS.varoitukset, suoliston nekroosi).
Lääkkeiden yhteisvaikutukset
antasidit
Natriumpolystyreenisulfonaatin, USP: n ja ei-imeytyviä kationeja luovuttavien antasidien ja laksatiivien samanaikainen anto voi heikentää hartsin kaliumin vaihtokykyä.
imeytymättömiä kationeja luovuttavia antasideja ja ulostuslääkkeitä
systeemistä alkaloosia on raportoitu, kun kationinvaihtohartseja on annettu suun kautta yhdessä ei -absorboituvien kationeja luovuttavien antasidien ja ulostuslääkkeiden, kuten magnesiumhydroksidin ja alumiinikarbonaatin kanssa. Magnesiumhydroksidia ei tule antaa Natriumpolystyreenisulfonaatin kanssa, USP. Yksi grand mal-kohtaustapaus on raportoitu kroonista munuaisten vajaatoimintaa sairastavalla hypokalsemiaa sairastavalla potilaalla, jolle annettiin natriumpolystyreenisulfonaattia, USP: tä ja laksatiivina magnesiumhydroksidia.
suolitukos, joka johtuu alumiinihydroksidin konkretioista käytettäessä yhdessä Natriumpolystyreenisulfonaatin kanssa, USP: tä on raportoitu.
Digitalis
digitaliksen toksiset vaikutukset sydämeen, erityisesti erilaiset kammioperäiset rytmihäiriöt ja A-V-solmukohtien dissosiaatio, ovat todennäköisesti hypokalemian vuoksi liioiteltuja, vaikka seerumin digoksiinipitoisuudet olisivat ”normaalitasolla”. Varoitukset).
sorbitoli
sorbitolin samanaikainen käyttö Natriumpolystyreenisulfonaatin kanssa USP: n on todettu aiheuttavan suolistonekroosia, joka voi johtaa kuolemaan. Tämän vuoksi samanaikaista käyttöä ei suositella. Varoitukset).
litium
Natriumpolystyreenisulfonaatti, USP saattaa heikentää litiumin imeytymistä.
tyroksiini
Natriumpolystyreenisulfonaatti, USP saattaa heikentää tyroksiinin imeytymistä.
karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
tutkimuksia ei ole tehty.
Raskauskategoria C
lisääntymistutkimuksia eläimillä ei ole tehty Natriumpolystyreenisulfonaatilla, USP. Ei myöskään tiedetä, voiko Natriumpolystyreenisulfonaatti, USP aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle tai voi vaikuttaa lisääntymiskykyyn. Natriumpolystyreenisulfonaatti, USP tulee antaa raskaana olevalle naiselle vain, jos se on selvästi tarpeen.
imettävät äidit
ei tiedetä, erittyykö tämä lääke äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon, varovaisuutta on noudatettava, kun Natriumpolystyreenisulfonaatti, USP annetaan imettäville naisille.
pediatrinen käyttö
Natriumpolystyreenisulfonaatin (USP) tehoa lapsipotilailla ei ole osoitettu. Vastasyntyneille Natriumpolystyreenisulfonaattia, USP: tä ei saa antaa suun kautta. Peräsuoleen annettaessa on noudatettava erityistä varovaisuutta sekä lapsilla että vastasyntyneillä, sillä liiallinen annostus tai riittämätön laimennus voi johtaa hartsin imeytymiseen.
ruuansulatuskanavan verenvuodon tai suoliston nekroosin riskin vuoksi keskosilla tai pienipainoisilla lapsilla on noudatettava erityistä varovaisuutta.
haittavaikutukset
Natriumpolystyreenisulfonaatti, USP voi aiheuttaa jonkinasteista mahaärsytystä. Ruokahaluttomuutta, pahoinvointia, oksentelua ja ummetusta voi esiintyä varsinkin, jos annetaan suuria annoksia. Myös hypokalemiaa, hypokalsemiaa, hypomagnesemiaa ja merkittävää natriumin retentiota ja niihin liittyviä kliinisiä ilmenemismuotoja voi esiintyä (KS.varoitukset). Silloin tällöin kehittyy ripuli. Iäkkäillä henkilöillä suuret annokset voivat aiheuttaa ulosteen impaktiota (KS.varotoimet). Harvinaisissa tapauksissa on raportoitu suoliston nekroosia. Suolitukos, joka johtuu alumiinihydroksidin konkretioista, kun sitä käytetään yhdessä Natriumpolystyreenisulfonaatin, USP: n, kanssa, on raportoitu.
seuraavia tapahtumia on raportoitu maailmanlaajuisesti markkinoille tulon jälkeen:
* ulosteen impaktio peräsuolesta annon jälkeen, erityisesti lapsilla;
* ruoansulatuskanavan konkretioita (besoaareja) suun kautta annon jälkeen;
* iskeeminen koliitti, maha-suolikanavan haavaumat tai nekroosi, jotka voivat johtaa suolen perforaatioon;
• harvinaiset tapaukset akuutti bronkiitti ja / tai bronkokekeuhkokuume, johon liittyy polystyreenisulfonaattihiukkasten hengittäminen.
yliannostus
yliannostus voi aiheuttaa elektrolyyttihäiriöitä, kuten hypokalemiaa, hypokalsemiaa ja hypomagnesemiaa .Yliannostuksesta johtuvat biokemialliset häiriöt voivat aiheuttaa hypokalemian kliinisiä merkkejä ja oireita, mukaan lukien: ärtyneisyys, sekavuus, viivästynyt ajatusprosessi, lihasheikkous, hyporefleksia, joka voi edetä suoraksi halvaukseksi ja/tai uniapneaksi. Tetania voi esiintyä. EKG-muutokset voivat olla yhdenmukaisia hypokalemian tai hyperkalsemian kanssa; sydämen rytmihäiriöitä voi esiintyä. Asianmukaiset toimenpiteet on toteutettava korjata seerumin elektrolyyttejä (kalium, kalsium, magnesium), ja hartsi on poistettava ruoansulatuskanavan asianmukaisella käytöllä laksatiiveja tai peräruiskeet.
Kalexate-jauheen Annostus ja anto
tämän lääkkeen suspensio on valmistettava vasta, eikä sitä saa säilyttää yli 24 tuntia.
aikuisten keskimääräinen vuorokausiannos pihkaa on 15-60 g. Tämä on paras antaa antamalla 15 g (noin 4 tason teelusikallista) Natriumpolystyreenisulfonaattia, USP yhdestä neljään kertaa päivässä. Yksi gramma Natriumpolystyreenisulfonaattia, USP sisältää 4,1 mEq natriumia; yksi taso tl sisältää noin 3,5 g Natriumpolystyreenisulfonaattia, USP ja 15 mEq natriumia. (Kasaava teelusikallinen voi sisältää jopa 10-12 g Natriumpolystyreenisulfonaattia, USP.) Koska natrium-kalium-vaihtohartsin in vivo-tehokkuus on noin 33 prosenttia, noin kolmasosa hartsin todellisesta natriumpitoisuudesta toimitetaan elimistöön.
pienemmillä lapsilla ja imeväisillä on käytettävä pienempiä annoksia käyttämällä ohjeena kaliumin määrää 1 mekv hartsogrammaa kohti laskuperusteena.
jokainen annos annetaan suspensiona pienessä vesimäärässä tai, paremman maun vuoksi, siirapissa. Nesteen määrä vaihtelee yleensä 20 mL: sta 100 mL: aan annoksesta riippuen, tai se voidaan määrittää yksinkertaisesti sallimalla 3 mL: sta 4 mL: aan grammaa hartsia kohti. Hoitohenkilökunnan tulee noudattaa kaikkia aspiraatiota koskevia varotoimia antaessaan tätä valmistetta, kuten asettaa ja pitää potilas pystyasennossa hartsin annon aikana.
hartsi voidaan tuoda mahaan muoviputken kautta ja haluttaessa sekoittaa munuaisten vajaatoimintapotilaalle sopivaan ruokavalioon.
hartsia voidaan myös antaa, joskin tehottomammin tuloksin, peräruiskeena, joka (aikuisille) on 30-50 g kuuden tunnin välein. Jokainen annos annetaan lämpimänä emulsiona (kehon lämpötilassa) 100 mL: ssa vesipitoista kantaja-ainetta. Emulsiota tulee ravistella varovasti annostelun aikana. Peräruiske on säilytettävä mahdollisimman pitkään ja sen jälkeen on annettava puhdistava peräruiske.
alustavan puhdistavan peräruiskeen jälkeen peräsuoleen työnnetään noin 20 cm: n etäisyydeltä pehmeä, suurikokoinen (ranskankielinen 28) kumiputki, jonka kärki menee hyvin sigmoidin paksusuoleen ja teipataan paikalleen. Tämän jälkeen hartsi suspendoidaan sopivaan määrään vesipitoista kantaja-ainetta ruumiinlämpötilassa ja lisätään painovoiman vaikutuksesta, kun taas hiukkaset pidetään suspensiossa sekoittamalla. Suspensio huuhdellaan 50 mL: lla tai 100 mL: lla nestettä, minkä jälkeen putki kiinnitetään ja jätetään paikalleen. Jos selkävuotoa ilmenee, lantio kohotetaan tyynyillä tai polvirinta-asento otetaan väliaikaisesti. Hieman paksumpaa suspensiota voidaan käyttää, mutta on huolehdittava siitä, ettei tahnaa muodostu, koska viimeksi mainitun vaihtopinta on huomattavasti pienentynyt ja se on erityisen tehoton, jos se talletetaan peräsuoliampullaan. Suspensiota pidetään sigmoid-paksusuolessa useita tunteja, jos mahdollista. Sitten paksusuoli kastellaan nonatriumia sisältävällä liuoksella kehon lämpötilassa hartsin poistamiseksi. Kaksi litraa huuhteluliuosta voi olla tarpeen. Palautukset valuvat jatkuvasti Y-putkiliitoksen kautta. Vaikka sorbitolin käyttöä ei suositella, erityistä huomiota on kiinnitettävä tähän puhdistavaan peräruiskeeseen, jos sorbitolia on käytetty
hoidon voimakkuus ja kesto riippuvat hyperkalemian vaikeusasteesta ja resistenssistä.
Natriumpolystyreenisulfonaattia, USP: tä ei saa kuumentaa, sillä se voi muuttaa hartsin vaihto-ominaisuuksia.
miten Kaleksaattijauhetta toimitetaan
Natriumpolystyreenisulfonaattia, USP: tä on saatavana kermana vaaleanruskeaan hienoksi jauhettuun jauheeseen 1 paunan (454 g) purkissa,
NDC 10702-036-45.
säilytä 20° C-25°C (68° – 77°F) lämpötilassa, ja poikkeamat sallitaan välillä 15° C-30°C (59° – 86°F) .
Rx vain
valmistanut:
KVK-TECH INC.
110 Terry Drive
Newtown, PA 18940 USA.
nimiketunnus # 006067/04
valmistajan tunnus: 10702 10/13
pakkausmerkintä.PÄÄNÄYTTÖTAULU
454 g purkin etiketti
NDC 10702-036-45
NATRIUMPOLYSTYREENISULFONAATTI, USP
KATIONINVAIHTOHARTSI
454 g
Rx vain
aikuisten keskimääräinen annos: 15 g (noin 4 tason teelusikallista) yhdestä neljään kertaa päivässä vedessä. Katso täydelliset lääkemääräystiedot.
vaikutus on kontrolloitava huolellisesti seerumin kaliumpitoisuusmäärityksillä joka 24 tunnin jakso. Natriumpitoisuus noin 60 mekv / 15 g.
suspensio tulee valmistaa vasta, eikä sitä saa säilyttää yli 24 tuntia. Annostele tiiviissä, valoa kestävissä astioissa, jotka on määritelty virallisessa pakkausselosteessa.
säilytä 20° C-25°C (68° – 77°F) lämpötilassa, ja poikkeamat sallitaan välillä 15° C-30°C (59° – 86°F) .
KVK-TECH, INC.

| KALEXATE sodium polystyrene sulfonate powder |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler-KVK-Tech, Inc. (173360061)
Registrant-KVK-Tech, Inc. (173360061)
| perustaminen | |||
| nimi | osoite | ID / FEI | operaatiot |
| KVK-Tech, Inc. | 173360061 | valmistus(10702-036) | |
lisää Kaleksaatista (natriumpolystyreenisulfonaatista)
- haittavaikutukset
- raskauden tai imetyksen aikana
- annostustiedot
- Lääkkeiden yhteisvaikutukset
- hinnoittelu & Kupongit
- Espanja
- Lääkeluokka: kationinvaihtohartsit
- FDA: n hälytykset (2)
Consumer resources
- potilastiedot
Professional resources
- Lääkemääräystiedot
- Natriumpolystyreenisulfonaatti Oral Powder (FDA)
muut merkit Kayexalate, Kionex
asiaan liittyvät hoito-oppaat
- hyperkalemia
lääketieteellinen Vastuuvapauslauseke