annosmuoto: aerosoli, vaahto
lääketieteellisesti arvosteltu Drugs.com. viimeksi päivitetty Sep 1, 2019.
- yleiskatsaus
- haittavaikutukset
- annostus
- ammatillinen
- raskaus
- lisää
- käyttöaiheet ja käyttö Ketokonatsolivaahtoon
- Ketokonatsolivaahto Annostus ja anto
- lääkemuodot ja vahvuudet
- Vasta-Aiheet
- Varoitukset ja varotoimet
- Kosketusherkistyminen
- Syttyvä sisältö
- Systeemiset vaikutukset
- haittavaikutukset
- kliinisissä tutkimuksissa saadut kokemukset
- Ihoturvallisuustutkimukset
- markkinoille tulon jälkeen
- käyttö erityisryhmillä
- raskaus
- imetys
- lisääntymiskykyiset naiset ja miehet
- lapsipotilaat
- geriatrinen käyttö
- Ketokonatsolivaahto kuvaus
- Ketokonatsolivaahto – Kliininen farmakologia
- vaikutusmekanismi
- farmakodynamiikka
- farmakokinetiikka
- mikrobiologia
- ei-kliininen toksikologia
- karsinogeneesi, mutageneesi, Fertiliteetin heikkeneminen
- kliiniset tutkimukset
- toimitustapa / varastointi ja käsittely
- Potilasneuvontaa koskevat tiedot
- käyttöohjeet
- potilastiedot
- Pakkaus/etiketti PÄÄNÄYTTÖPANEELI – kotelo
- lisää ketokonatsolin ajankohtaisuudesta)
- Consumer resources
- Professional resources
- Related treatment guides
käyttöaiheet ja käyttö Ketokonatsolivaahtoon
Ketokonatsolivaahtoon, 2% on indikoitu seborrooisen dermatiitin paikalliseen hoitoon yli 12-vuotiailla immunokompetenteilla potilailla.
käyttörajoitukset
Ketokonatsolivaahdon turvallisuus ja teho, 2% sieni-infektioiden hoidossa ei ole selvitetty.
Ketokonatsolivaahto Annostus ja anto
Ketokonatsolivaahto, 2%: A tulee levittää hoitoalueelle(ihoalueille) kahdesti päivässä neljän viikon ajan.
Pidä säiliö pystyasennossa ja annostele Ketokonatsolivaahtoa 2% tölkin korkkiin tai muuhun viileään pintaan niin paljon, että se riittää peittämään vaurioituneen alueen(t). Annostelua suoraan käsiin ei suositella, sillä vaahto alkaa sulaa heti, kun se joutuu kosketuksiin lämpimän ihon kanssa. Ota pieniä määriä Ketokonatsolivaahtoa, 2% sormenpäillä, ja hiero varovasti teennäiseen kohtaan, kunnes vaahto häviää. Hiuksia kantaville alueille osa hiukset, niin että Ketokonatsolivaahto, 2% voidaan levittää suoraan iholle (eikä hiuksiin).
vältä valmisteen joutumista silmiin ja muille limakalvoille. Ketokonatsolivaahto, 2% ei ole tarkoitettu silmään, suun tai emättimeen.
lääkemuodot ja vahvuudet
Ketokonatsolivaahto, 2% sisältää ketokonatsolia 20 mg USP / gramma 50 g: n ja 100 g: n pakkauksissa.
Vasta-Aiheet
Ei Mitään.
Varoitukset ja varotoimet
Kosketusherkistyminen
Ketokonatsolivaahto, 2% voi johtaa kosketusherkistymiseen, mukaan lukien valoallergeenisuus.
Syttyvä sisältö
Ketokonatsolivaahdon sisältö, 2% Sisältää alkoholia ja propaania/butaania, jotka ovat syttyviä. Vältä tulta, liekkiä ja/tai tupakointia levityksen aikana ja välittömästi sen jälkeen. Säiliötä ei saa puhkaista ja/tai polttaa. Säiliöitä ei saa pitää kuumina ja/tai säilyttää yli 120°F: n (49°C) lämpötilassa.
Systeemiset vaikutukset
maksatulehdusta on havaittu suun kautta annetun ketokonatsolin yhteydessä (1:10 000 raportoitu ilmaantuvuus). Suun kautta annettujen suurten ketokonatsoliannosten on havaittu alentavan testosteronin ja ACTH: n aiheuttamaa kortikosteroiditasoa seerumissa. Näitä vaikutuksia ei ole havaittu paikallisen ketokonatsolin käytön yhteydessä.
haittavaikutukset
kliinisissä tutkimuksissa saadut kokemukset
koska kliinisiä tutkimuksia tehdään hyvin vaihtelevissa olosuhteissa, jonkin lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuslukuja ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa todettuihin haittavaikutuslukuihin, eivätkä ne välttämättä heijasta käytännössä havaittuja haittavaikutuksia. Kliinisistä tutkimuksista saatujen haittavaikutustietojen perusteella voidaan kuitenkin tunnistaa ne haittavaikutukset, jotka näyttävät liittyvän lääkkeen käyttöön, ja arvioida niiden esiintyvyys.
taulukossa 1 esitetyt turvallisuustiedot osoittavat, että altistus Ketokonatsolivaahdolle oli 2% 672: lla yli 12-vuotiaalla koehenkilöllä, joilla oli seborrooinen dermatiitti. Koehenkilöt levittivät Ketokonatsolivaahtoa, 2%: A tai ajoneuvovaahtoa kahdesti päivässä 4 viikon ajan kasvojen, päänahan ja/tai rintakehän hoidettaville alueille. Haittavaikutukset, joita esiintyi > 1%: lla potilaista, on esitetty taulukossa 1.
Taulukko 1: Kliinisissä tutkimuksissa >1% koehenkilöillä raportoimat haittavaikutukset
|
haittavaikutukset |
Ketokonatsolivaahto, 2% N=672 n (%) |
Ajoneuvovaahto N=497 n (%) |
|
koehenkilöt, joilla on haittavaikutus |
188 (28%) |
122 (25%) |
|
Sovelluspaikan kirjoitus |
67 (10%) |
49 (10%) |
|
kiinnityskohdan reaktio |
41 (6%) |
24 (5%) |
kiinnityskohdan reaktioita, joita raportoitiin <1%: lla koehenkilöistä, olivat kuivuus, punoitus, ärsytys, parestesia, kutina, ihottuma ja kuumotus.
Ihoturvallisuustutkimukset
valoallergeenisuustutkimuksessa 53 potilaasta 9: llä (17%) oli altistusjakson aikana reaktioita sekä ketokonatsolivaahdolla käsitellyssä säteilytetyssä että säteilyttämättömässä kohdassa, 2%. Ketokonatsolivaahto, 2% voi aiheuttaa kosketusherkistymistä.
markkinoille tulon jälkeen
markkinoille tulon jälkeen Ketokonatsolivaahtoa käytettäessä on havaittu seuraavia haittatapahtumia, 2%:
Ruoansulatuselimistö: huulitulehdus
Yleisoireet ja antopaikassa todettavat haitat: kiinnityskohdan kipu ja kiinnityskohdan palovamma
iho ja ihonalainen kudos: Ihon kirvely ja punoitus
koska nämä tapahtumat on raportoitu vapaaehtoisesti populaatiossa, jonka koko on epävarma, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai osoittaa syy-yhteyttä lääkealtistukseen.
käyttö erityisryhmillä
raskaus
Riskiseloste
Ketokonatsolivaahdosta, 2%: n käytöstä raskaana olevilla naisilla ei ole tietoa, jotta voitaisiin tunnistaa lääkkeeseen liittyvä vakavien sikiövaurioiden, keskenmenon tai äidin tai sikiön haittavaikutusten riski. Eläimillä ei ole tehty lisääntymistutkimuksia Ketokonatsolivaahdolla (2%). Tiineillä hiirillä, rotilla ja kaniineilla tehdyissä lisääntymistutkimuksissa havaittiin sekä alkioon kohdistuvia että kehitykseen kohdistuvia vaikutuksia (rakenteellisia poikkeavuuksia), kun ketokonatsolia annettiin suun kautta organogeneesin aikana. Jos oletetaan, että paikallisesti ja suun kautta otettujen ketokonatsoliannosten ja Ketokonatsolivaahdon systeeminen imeytyminen on yhtä suuri kuin 2%: n ihmiselle suositeltu 8 gramman enimmäisannos (vastaa 160 mg ketokonatsolia), sikiötoksisia vaikutuksia havaittiin 0, 8-2, 4-kertaisesti MRHD: hen verrattuna ja kehityksellisiä vaikutuksia havaittiin 4.8 kertaa MRHD .
vakavien synnynnäisten epämuodostumien ja keskenmenojen riski ei ole tiedossa ilmoitetulla potilasryhmällä. Kaikissa raskauksissa on taustalla syntymävian, menetyksen tai muun haitallisen lopputuloksen riski. Yhdysvalloissa yleisen väestön, arvioitu Tausta riski suurten syntymävaurioiden ja keskenmenon kliinisesti tunnustettu raskauksia on 2-4% ja 15-20%, vastaavasti.
tiedot
tiedot eläimistä
eläinten altistumislaskelmat perustuvat kehon pinta-alan (body surface area, BSA) vertailuihin eläimille annetuista suun kautta annetuista annoksista ja Ketokonatsolivaahdosta, joka on 2% ihmiselle suositeltu enimmäisannos (MRHD) 8 grammaa (vastaa 2, 67 mg ketokonatsolia/kg/vrk 60 kg: n yksilölle tai 98, 8 mg ketokonatsolia/m2/vrk).
alkion / sikiön kehitystä koskevia tutkimuksia on tehty hiirillä, rotilla ja kaniineilla käyttäen suun kautta annettua ketokonatsolia. Kun ketokonatsolia annettiin hiirille suun kautta raskauspäivinä 6-18 (joka kattoi organogeneesin ajan), se oli alkiotoksinen (25 mg/kg tai enemmän; 0, 8-kertainen MRHD: hen verrattuna BSA: n vertailujen perusteella), ja resorptioita esiintyi paljon, kuolleena syntyneiden määrä lisääntyi ja synnytys viivästyi. Myös kypsymisen viivästymistä havaittiin. Merkkejä emoon kohdistuvasta toksisuudesta tai epämuodostumista ei havaittu annostasolla 50 mg/kg (1, 5-kertainen MSHD: hen verrattuna BSA-vertailujen perusteella). Hoitoon liittyviä kehitysvaikutuksia ei havaittu annoksella 10 mg/kg (0, 3-kertainen MSHD: hen verrattuna BSA-vertailujen perusteella).
rotilla suun kautta annettu ketokonatsoli oli emolle toksinen, ja se oli sekä alkiotoksinen (vähintään 40 mg/kg; 2, 4-kertainen RHD: hen verrattuna BSA-vertailujen perusteella), mukaan lukien resorboituneiden sikiöiden ja kuolleena syntyneiden lisääntyminen, että teratogeeninen (vähintään 80 mg/kg; 4, 8-kertainen RHD: hen verrattuna BSA-vertailujen perusteella), mukaan lukien syndaktylia, oligodaktylia, heiluvat kylkiluut ja suulakihalkio. Lisäksi ketokonatsoli oli sikiötoksinen (lisääntynyt resorptio), kun ketokonatsolia annettiin suun kautta yhtenä päivänä tiineyden aikana (raskauspäivät 9-12) 100 mg/kg (6 kertaa MRHD BSA-vertailujen perusteella). Tämä sama oraalinen annos, joka annettiin tiineyspäivänä 12, 13, 14 tai 15, aiheutti ulkoisia epämuodostumia, mukaan lukien suulakihalkio, mikromelia ja digitaaliset poikkeavuudet (brachydactyly, ektrodaktyly, syndactyly).
tiineillä kaniineilla, joille annettiin ketokonatsolia suun kautta, havaittiin alkiotoksisuutta (lisääntyneitä resorptioita) annoksella 10 mg/kg (1, 2-kertainen ihmisen RESORPTIOVERTAILUIHIN verrattuna) ja suurempi ja luustopoikkeavuuksien ilmaantuvuus lisääntyi annoksella 40 mg/kg (4, 8-kertainen verrattuna ihmisen RESORPTIOVERTAILUIHIN).
imetys
Riskikoostumus
tietoa ketokonatsolin esiintymisestä äidinmaidossa, vaikutuksista rintaruokinnassa olevaan lapseen tai vaikutuksista maidontuotantoon ketokonatsolivaahdon paikallisen levittämisen jälkeen ei ole saatavilla 2%: lla imettävistä naisista. Eläinkokeissa ketokonatsolia löytyi maidosta oraalisen annon jälkeen. Imetyksen kehitys-ja terveyshyödyt on otettava huomioon yhdessä äidin kliinisen ketokonatsolivaahdon tarpeen kanssa, 2%: lla Ketokonatsolivaahdosta, 2%: lla tai taustalla olevasta äidin sairaudesta mahdollisesti aiheutuvien haittavaikutusten kanssa.
lisääntymiskykyiset naiset ja miehet
hedelmättömyys
rotilla ja koirilla tehdyissä hedelmällisyystutkimuksissa ketokonatsolin antaminen suun kautta 3 päivän ja 3 kuukauden jaksoissa johti hedelmättömyyteen, joka oli palautuvaa .
lapsipotilaat
Ketokonatsolivaahdon turvallisuutta ja tehokkuutta 2%: lla alle 12-vuotiaista lapsipotilaista ei ole vahvistettu.
672 ketokonatsolivaahdolla hoidetusta potilaasta 2% kliinisissä tutkimuksissa 44 (7%) oli 12-17-vuotiaita. .
geriatrinen käyttö
672 ketokonatsolivaahdolla hoidetusta potilaasta 2% kliinisissä tutkimuksissa 107 (16%) oli vähintään 65-vuotiaita.
Ketokonatsolivaahdolla tehdyissä kliinisissä tutkimuksissa 2%: ssa ei ollut riittävästi 65 vuotta täyttäneitä koehenkilöitä sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat koehenkilöt.
Ketokonatsolivaahto kuvaus
Ketokonatsolivaahto, 2% sisältää 2% ketokonatsolia USP: tä, sienilääkettä, termolabiilissa hydroetanolivaahdossa, jota käytetään paikallisesti.
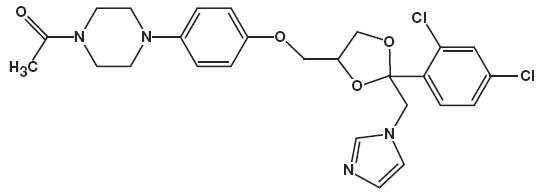
ketokonatsolin Kemiallinen nimi on piperatsiini, 1-asetyyli-4-Metoksi]fenyyli]-, cis – jonka molekyylikaava on C26H28CI2N4O4 ja molekyylipaino 531,43.
kemiallinen rakenne on seuraava:
Ketokonatsolivaahto, 2% sisältää 20 mg ketokonatsolia grammassa termolabiilissa hydroetanolivaahdossa, joka koostuu setyylialkoholista, sitruunahaposta, etanolista (denaturoitu tert-butyylialkoholilla ja brusiinisulfaatilla) 58%, polysorbaatti 60: stä, kaliumsitraatista, propyleeniglykolista, puhdistetusta vedestä ja hiilivetypropaani/butaani-ponneaineella paineistetusta stearyylialkoholista.
Ketokonatsolivaahto – Kliininen farmakologia
vaikutusmekanismi
ketokonatsolin vaikutusmekanismia seborrooisen dermatiitin hoidossa ei tunneta.
farmakodynamiikka
Ketokonatsolivaahdon 2% farmakodynamiikkaa ei ole vahvistettu.
farmakokinetiikka
hyötyosuustutkimuksessa 12 kohtalaista tai vaikeaa seborrooista dermatiittia sairastavaa koehenkilöä levitti Ketokonatsolivaahtoa 3 g, 2% kahdesti vuorokaudessa 4 viikon ajan. Ketokonatsolin pitoisuus plasmassa oli < 6 ng/mL suurimmalla osalla tutkimushenkilöistä (75%) ja enimmäistaso 11 ng/mL yhdellä tutkimushenkilöllä.
mikrobiologia
ketokonatsoli on sienilääke, joka estää Malassezia furfurin solukalvossa olevan keskeisen sterolin ergosterolin in vitro-synteesiä. Antifungaalisen vaikutuksen kliinistä merkitystä seborrooisen dermatiitin hoidossa ei tunneta.
ei-kliininen toksikologia
karsinogeneesi, mutageneesi, Fertiliteetin heikkeneminen
pitkäaikaisia eläinkokeita ei ole tehty ketokonatsolivaahdon karsinogeenisuuden tai valokarsinogeenisuuden arvioimiseksi, 2%.
suun kautta tehdyissä karsinogeenisuustutkimuksissa hiirillä (18 kk) ja rotilla (24 kk) annoksilla 5, 20 ja 80 mg/kg/vrk ketokonatsoli ei ollut karsinogeeninen. Suuri annos näissä tutkimuksissa oli noin 2, 4-4, 8-kertainen MRHD: hen verrattuna BSA-vertailujen perusteella. Bakteereilla tehdyssä käänteismutaatiotestissä ketokonatsolilla ei ollut mutageenisuutta. Kolmessa in vivo-määrityksessä (sisarkromatidinvaihto ihmisillä, dominoiva letaali-ja mikrotumatesti hiirillä) ketokonatsolilla ei ollut genotoksisia vaikutuksia.
eläinten hedelmällisyystutkimuksissa suun kautta annettu ketokonatsoli heikensi sekä urosten että naaraiden hedelmällisyyttä annoksesta ja kestosta riippuvalla tavalla. Naisilla suun kautta annetuilla annoksilla, jotka olivat enintään 40 mg/kg (2, 4-kertaisia verrattuna ihmisen kehon pinta-alaan perustuviin vertailuihin), ei ollut vaikutusta hedelmällisyyteen, kun taas 75 mg/kg (4, 5-kertaiset kehon pinta-alaan perustuviin vertailuihin verrattuna) ja suuremmat annokset vähensivät tiineyttä ja implantaatiopaikkojen määrää. Urosrotilla kolmen päivän ajan suun kautta annettu 200 mg/kg/vrk (12-kertainen vuorokausiannos BSA-vertailuissa) alensi hedelmällisyyttä ja kolmen päivän ajan 400 mg/kg (24-kertainen vuorokausiannos BSA-vertailuissa) johti täydelliseen hedelmällisyyden menetykseen. Pidempiaikaisena (enintään 3 kuukautta) urosrotilla havaittiin hedelmällisyyden heikkenemistä niinkin pienillä annoksilla kuin 24 mg/kg/vrk (1, 4-kertainen MRHD: hen verrattuna BSA-vertailujen perusteella). Urospuolisilla Beagle-koirilla ketokonatsolin oraalinen annos on 25 mg/kg/vrk enintään 4 viikon ajan (5.2 kertaa MRHD BSA-vertailujen perusteella) johti siittiöiden motiliteetin vähenemiseen, siittiöiden määrän vähenemiseen, epänormaalien siittiöiden lisääntymiseen ja kivesten surkastumiseen. Nämä vaikutukset korjaantuivat hoidon lopettamisen jälkeen.
kliiniset tutkimukset
Ketokonatsolivaahdon (2%) turvallisuutta ja tehoa arvioitiin satunnaistetussa, vehikkelikontrolloidussa kaksoissokkotutkimuksessa 12-vuotiailla ja sitä vanhemmilla henkilöillä, joilla oli lievä tai vaikea seborrooinen dermatiitti. Tutkimuksessa 427 koehenkilöä sai Ketokonatsolivaahtoa, 2% ja 420 koehenkilöä sai ajoneuvovaahtoa. Koehenkilöt levittivät Ketokonatsolivaahtoa, 2%: A tai ajoneuvovaahtoa kahdesti päivässä 4 viikon ajan kasvojen, päänahan ja/tai rintakehän hoidettaville alueille. Taudin yleistä vaikeusastetta eryteemana, hilseilynä ja kovettumisena arvioitiin lähtötilanteessa ja viikolla 4 5-pisteisellä tutkijan staattisella Global Assessment (ISGA) – asteikolla.
hoidon onnistuminen määriteltiin siten, että saavutettiin viikolla 4 (hoidon päättyessä) ISGA-pistemäärä 0 (kirkas) tai 1 (suurimmalla osalla leesioista on yksilöllinen skaalauksen, eryteeman ja kovettuman pistemäärä, joka on keskimäärin 1 ) ja vähintään kaksi asteikkoa, jotka paranivat lähtötasosta. Tulokset on esitetty taulukossa 2. Tietokanta ei ollut tarpeeksi suuri arvioidakseen, oliko vaikutuksissa eroja iän, sukupuolen tai rodun alaryhmissä.
Taulukko 2: Tehokkuustulokset
|
koehenkilöiden lukumäärä |
Ketokonatsolivaahto, 2% N = 427 n (%) |
Ajoneuvon vaahto N = 420 n (%) |
|
koehenkilöt hoidon onnistumisessa |
239 (56%) |
176 (42%) |
toimitustapa / varastointi ja käsittely
Ketokonatsolivaahto, 2% sisältää 20 mg ketokonatsolia, USP / gramma. Thermolabile hydroetanolivaahtoa on saatavilla seuraavasti:
NDC 45802-532-32
50 g alumiinipurkkia
NDC 45802-532-33
100 g alumiinipurkkia
säilytä 20° C-25°C (68° – 77°F). .
ei saa säilyttää jääkaapissa.
sisältö on syttyvää. Säiliöitä ei saa pitää kuumina ja/tai säilyttää yli 49°C: n (120°F) lämpötilassa. Säilytä suorassa auringonvalossa.
paineen alaisena. Säiliötä ei saa puhkaista ja/tai polttaa.
ei lasten ulottuville.
Potilasneuvontaa koskevat tiedot
KS.FDA: n hyväksymät potilasmerkinnät (potilaan pakkausseloste).
kehottaa potilaita Ketokonatsolivaahdon asianmukaiseen käyttöön, 2%.
* vältä tulta, liekkiä ja/tai tupakointia levityksen aikana ja välittömästi sen jälkeen. * Älä levitä Ketokonatsolivaahtoa, 2% suoraan käsiin. Annostele viileälle pinnalle ja levitä vaurioituneille alueille sormenpäillä. • Pese kädet levityksen jälkeen * Ketokonatsolivaahto, 2% saattaa aiheuttaa ihoärsytystä (kiinnityskohdan polttamista ja/tai reaktioita) • kehottaa potilasta ottamaan yhteyttä terveydenhuollon tarjoajaan, jos käyttöalueella ilmenee ärsytyksen lisääntymistä, ja ilmoittamaan mahdollisista haittavaikutuksista.
Made in Israel
Manufactured By Perrigo
Yeruham, Israel
Distributed By
Perrigo®
Allegan, MI 49010
www.perrigo.kom
Rev 08-18
5K200RCJ3
käyttöohjeet
Ketokonatsolivaahto, 2%
tärkeää tietoa: Ketokonatsolivaahto, 2% on tarkoitettu käytettäväksi vain iholle. Älä käytä Ketokonatsolivaahtoa 2% silmiin, suuhun tai emättimeen.
Vaihe 1: Poista kirkas korkki Ketokonatsolivaahdosta, 2% tölkkiä.
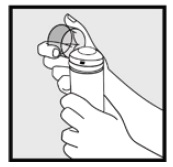
Vaihe 2: pidä tölkkiä pystyasennossa ja paina suutinta lujasti, jotta ketokonatsolivaahto annostellaan 2% kirkkaaseen suojukseen. * Annostele tarpeeksi Ketokonatsolivaahtoa, 2% kattamaan koko teennäinen (s).
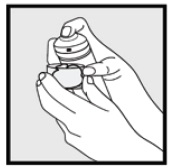
• jos tölkki tuntuu lämpimältä tai vaahto tuntuu valuvan, juoksuta tölkki kylmän veden alle.
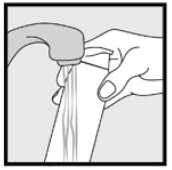
Vaihe 3: Ota sormenpäilläsi pieni määrä Ketokonatsolivaahtoa, 2%, ja hiero vaahtoa varovasti ihoalueille, kunnes vaahto häviää.
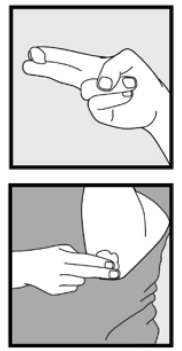
• jos hoidat alueita, kuten päänahkaa, jaa hiukset niin, että Ketokonatsolivaahto, 2% voidaan levittää suoraan iholle.

Vaihe 4: Pese kädet ketokonatsolivaahdon levittämisen jälkeen, 2%. * Heitä pois suojukseen jäänyt käyttämätön lääke.
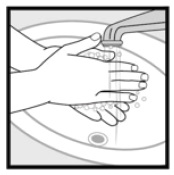
Miten minun pitäisi säilyttää Ketokonatsolivaahtoa, 2%?
* säilytä Ketokonatsolivaahtoa 2% huoneenlämmössä 68°F-77°F (20°C-25°C). * Älä säilytä Ketokonatsolivaahtoa, 2% tölkkiä jääkaapissa tai pakastimessa. * Pidä Ketokonatsolivaahto 2% poissa lämmöstä. Älä koskaan heitä tölkkiä tuleen, vaikka tölkki olisi tyhjä. * Älä säilytä Ketokonatsolivaahtoa 2% yli 120°F (49°C) lämpötilassa. * Älä läpäise (punktio) Ketokonatsolivaahtoa, 2% voi.
pidä Ketokonatsolivaahto, 2% ja kaikki lääkkeet lasten ulottumattomissa.
Yhdysvaltain elintarvike-ja lääkevirasto on hyväksynyt tämän käyttöohjeen.
Rx Only
Made in Israel
Manufactured By Perrigo
Yeruham, Israel
Distributed By
Perrigo®
Alligan, MI 49010
www.perrigo.com
Rev 08-18
potilastiedot
Ketokonatsolivaahto, 2%
tärkeää tietoa: Ketokonatsolivaahto, 2% on tarkoitettu vain iholle. Älä käytä Ketokonatsolivaahtoa 2% silmiin, suuhun tai emättimeen.
mitä Ketokonatsolivaahto on, 2%?
Ketokonatsolivaahto, 2% on reseptilääke, jota käytetään iholla (paikallisesti) taliköhnän hoitoon 12-vuotiailla ja sitä vanhemmilla, joilla on normaali immuunijärjestelmä.
ei tiedetä, onko Ketokonatsolivaahto, 2% turvallinen ja tehokas sieni-infektioiden hoidossa.
ei tiedetä, onko Ketokonatsolivaahto, 2% turvallinen ja tehokas alle 12-vuotiailla lapsilla.
ennen Ketokonatsolivaahdon käyttöä 2% kerro terveydenhuollon tarjoajallesi kaikista sairauksistasi, myös jos:
• olet raskaana tai suunnittelet raskautta. Ei tiedetä, vahingoittaako Ketokonatsolivaahto, 2% sikiötä. * imetät tai aiot imettää. Ei tiedetä, erittyykö Ketokonatsolivaahdosta 2% rintamaitoon. Keskustele terveydenhuollon tarjoajasi kanssa parhaasta tavasta ruokkia vauvaa ketokonatsolivaahtohoidon aikana, 2%.
kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja käsikauppalääkkeet, vitamiinit ja rohdosvalmisteet.
miten Ketokonatsolivaahtoa pitäisi käyttää, 2%?
• käytä Ketokonatsolivaahtoa 2% juuri sen verran kuin lääkärisi on määrännyt. Katso yksityiskohtaiset ”käyttöohjeet”tämän pakkausselosteen lopussa ohjeet siitä, miten ketokonatsolivaahtoa, 2% oikealla tavalla. * Levitä Ketokonatsolivaahtoa 2% hoidettavalle ihoalueelle 2 kertaa päivässä 4 viikon ajan. Sinun tulee levittää tarpeeksi Ketokonatsolivaahtoa, 2% kattamaan koko teennäinen (t). • Keskustele hoitajasi kanssa, jos ihosi ei parane 4 viikon Ketokonatsolivaahdon jälkeen, 2%. * Annostele Ketokonatsolivaahto 2% suoraan korkkiin. Älä annostele Ketokonatsolivaahtoa, 2% suoraan käsiisi, koska vaahto alkaa sulaa kosketuksessa lämpimän ihon kanssa. * Pese kädet Ketokonatsolivaahdon levittämisen jälkeen, 2%.
mitä minun pitäisi välttää käytettäessä Ketokonatsolivaahtoa, 2%?
* Ketokonatsolivaahto, 2% on syttyvää. Vältä tulta, liekkejä tai tupakointia sen aikana ja heti sen jälkeen, kun levität Ketokonatsolivaahtoa, 2% iholle. * Vältä Ketokonatsolivaahdon saamista 2%: lla silmiin, suuhun, huuliin tai emättimeen tai niiden lähelle. Jos saat Ketokonatsolivaahtoa 2% huulillesi tai silmiin, suuhun tai emättimeen, huuhtele hyvin vedellä.
mitkä ovat Ketokonatsolivaahdon mahdolliset haittavaikutukset, 2%?
Ketokonatsolivaahto, 2% voi aiheuttaa vakavia haittavaikutuksia, mukaan lukien:
• ihoärsytys levitysalueella (- alueilla), mukaan lukien valolle altistumisen aiheuttamat ihoreaktiot. Kerro terveydenhuollon tarjoajallesi, jos sinulla ilmenee ihoärsytystä Ketokonatsolivaahtohoidon aikana, 2%.
Ketokonatsolivaahdon yleisimpiä haittavaikutuksia, 2%, ovat polttelu, kuivuus, punoitus, ärsytys, tunnottomuus, kutina, ihottuma ja lämpö levityskohdassa.
nämä eivät ole kaikki Ketokonatsolivaahdon mahdolliset haittavaikutukset, 2%.
kysy lääkäriltäsi neuvoa haittavaikutuksista. Haittavaikutuksista voi ilmoittaa FDA: lle 1-800-FDA-1088: ssa.
miten Ketokonatsolivaahtoa pitäisi säilyttää, 2%?
* säilytä Ketokonatsolivaahtoa 2% huoneenlämmössä 68°F-77°F (20°C-25°C). * Älä säilytä Ketokonatsolivaahtoa, 2% tölkkiä jääkaapissa tai pakastimessa. * Pidä Ketokonatsolivaahto 2% poissa lämmöstä. Älä koskaan heitä Ketokonatsolivaahtoa, 2% tölkkiä tuleen, vaikka tölkki olisi tyhjä. * Älä säilytä Ketokonatsolivaahtoa 2% yli 120°F (49°C) lämpötilassa. * Älä läpäise (punktio) Ketokonatsolivaahtoa, 2% voi. Pidä Ketokonatsolivaahto, 2% ja kaikki lääkkeet poissa lasten ulottuvilta.
yleistä tietoa Ketokonatsolivaahdon turvallisesta ja tehokkaasta käytöstä, 2%.
lääkkeitä määrätään joskus muihin kuin Potilastietoselosteessa mainittuihin tarkoituksiin. Älä käytä Ketokonatsolivaahtoa, 2% tilaan, johon sitä ei ole määrätty. Älä anna Ketokonatsolivaahtoa, 2% muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi aiheuttaa Voit kysyä apteekista tai terveydenhuollon tarjoajalta tietoja Ketokonatsolivaahdosta, 2%, joka on kirjoitettu terveydenhuollon ammattilaisille.
mitä aineita Ketokonatsolivaahdossa on, 2%?
vaikuttava aine: ketokonatsoli
inaktiiviset aineet: setyylialkoholi, sitruunahappo, etanoli (denaturoitu tert-butyylialkoholilla ja brusiinisulfaatilla) 58%, polysorbaatti 60, kaliumsitraatti, propyleeniglykoli, puhdistettu vesi ja stearyylialkoholi, joka on paineistettu hiilivety (propaani/butaani) – ponneaineella
lisätietoja: soita Perrigolle numeroon 1-866-634-9120
us food and Drug Administration.
Pakkaus/etiketti PÄÄNÄYTTÖPANEELI – kotelo
Rx vain
Ketokonatsolivaahto, 2%
vain paikalliseen käyttöön.
Ei Oftalmologiseen, oraaliseen eikä intravaginaaliseen käyttöön.
100 g

seuraavassa kuvassa on merkki, joka edustaa tuotetunnusta, joka on joko kiinnitetty tai painettu lääkepakkauksen etikettiin pakkauksen aikana.

| ketokonatsoli ketokonatsoli-aerosoli, vaahto |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
Labeler-Perrigo New York Inc (078846912)
lisää ketokonatsolin ajankohtaisuudesta)
- haittavaikutukset
- raskauden tai imetyksen aikana
- annostustiedot
- vertaa vaihtoehtoja
- hinnoittelu & Kupongit
- Espanja
- 36 arvostelua
- Lääkeluokka: topical antifungals
Consumer resources
- Patient Information
- Ketoconazole Topical (Advanced Reading)
Professional resources
- Prescribing Information
- Ketoconazole (Topical) (Professional Patient Advice)
- Ketoconazole Cream (FDA)
- Ketoconazole Shampoo (FDA)
Other brands Nizoral Shampoo, Ketodan, Extina, Xolegel
Related treatment guides
- Seborrheic Dermatitis
- Cutaneous Candidiasis
- Androgenetic Alopecia
- Dandruff
- … + 4 Lisää
lääketieteellinen Vastuuvapauslauseke