Le glaucome juvénile à angle ouvert peut être une maladie difficile à attraper tôt et à traiter correctement, en raison de la nature de la maladie elle-même ainsi que des caractéristiques de certains de ses patients plus jeunes. Cependant, si vous savez ce qu’il faut rechercher et que vous répondez avec un traitement rapide et efficace, vous pouvez aider à sauver la vision du patient JOAG. Dans cet article, nous partagerons nos conseils pour diagnostiquer JOAG et comment effectuer une intervention chirurgicale qui donne aux patients les meilleures chances de réussir.
JOAG: Ce que nous savons
Le glaucome juvénile à angle ouvert est considéré comme un sous-ensemble du glaucome primaire à angle ouvert, touchant environ 1 personne sur 50 000 (hommes et femmes également). La définition a été controversée mais prend généralement en compte l’âge d’apparition. La Société européenne du glaucome définit le JOAG comme un glaucome à angle ouvert avec apparition entre l’âge de 10 et 35 ans.
JOAG démontre un modèle d’hérédité autosomique dominante, et la recherche a trouvé des associations entre JOAG et des mutations génétiques sur le chromosome 1-1q21-q23. Ce locus est connu sous le nom de GLC1A, et contient le gène TIGR (réponse glucocorticoïde induite par le maillage trabéculaire) ou MYOC, 1, 2 qui code pour la protéine myociline. La fonction exacte de cette protéine et son implication dans le glaucome sont actuellement inconnues. Quarante mutations du gène TIGR / MYOC ont été identifiées dans le glaucome à angle ouvert juvénile et adulte, et les analyses génétiques ont révélé que 8 à 63% des patients atteints de JOAG présentent une mutation TIGR / MYOC. Les résultats courants chez les patients atteints de JOAG incluent l’apparition précoce de la maladie, une PIO très élevée et de forts antécédents familiaux de glaucome.3,4 L’étude histopathologique du maillage trabéculaire chez des patients JOAG par Akihito Tawara, MD de l’Université de Kyushu, et Hajime Inomata, MD, a révélé un maillage trabéculaire anormalement compact avec une accumulation de matériel extracellulaire dans les espaces trabéculaires.5
Résultats cliniques
Le glaucome juvénile à angle ouvert est généralement asymptomatique à ses premiers stades. Contrairement au glaucome infantile primaire, des signes tels que l’élargissement de la cornée et du globe, les ruptures de la membrane de Descemet, l’œdème cornéen, l’épiphore et la photophobie ne sont pas présents chez les patients présentant un glaucome à angle ouvert plus tard dans l’enfance ou l’adolescence. Les symptômes sont rares, mais peuvent inclure une vision floue et une douleur oculaire due à une pression intraoculaire élevée. La perte visuelle accompagne les derniers stades de la maladie et conduit souvent les patients à demander une évaluation ophtalmique. La myopie axiale a été associée à JOAG. Les signes cliniques incluent une élévation sévère de la PIO, souvent de l’ordre de 40 à 50 mmHg. Compte tenu de l’absence de symptômes précoces, la présentation est souvent tardive et une mise en forme avancée du nerf optique est souvent notée lors de l’évaluation initiale. Les caractéristiques gonioscopiques comprennent un angle de chambre antérieure ouvert avec une insertion élevée de l’iris et des processus proéminents de l’iris.1 Les disques optiques et les angles d’apparence normale n’excluent cependant pas le diagnostic de JOAG.
Le diagnostic de JOAG peut être simple dans le cadre d’une PIO nettement élevée et d’une coupe glaucomateuse du disque optique. Les cas les plus difficiles sont les adolescents qui présentent une élévation modeste de la PIO et un disque d’apparence saine. Pour aider à diagnostiquer ces cas plus difficiles, notez que les facteurs de risque de JOAG comprennent le sexe masculin, la myopie et des antécédents familiaux de glaucome.1 Surveillez de près les adolescents souffrant d’hypertension oculaire avec une évaluation périodique de la PIO, des disques optiques et des champs visuels. Au moment de l’évaluation initiale, obtenir des champs visuels de base, des photographies stéréo du disque optique et une évaluation de l’épaisseur de la couche de fibres nerveuses rétiniennes avec tomographie par cohérence optique. Malgré des données normatives limitées, les mesures de PTOM sont bénéfiques pour l’évaluation longitudinale et l’identification de la progression précoce.
Exclure les causes secondaires de glaucome à angle ouvert lors de l’évaluation de jeunes patients présentant une suspicion de JOAG. Notez que le syndrome de dispersion pigmentaire, l’uvéite, les traumatismes oculaires et l’utilisation de stéroïdes peuvent tous entraîner une PIO et un glaucome élevés, et un bon examen clinique et un examen des systèmes sont importants pour exclure toute preuve de ces conditions.
Traitement
Bien que jusqu’à 83% des patients atteints de JOAG nécessitent éventuellement une intervention chirurgicale7, un traitement médical peut servir de pont vers un traitement chirurgical plus définitif. Le traitement topique de première intention comprend des bêta-bloquants, des analogues des prostaglandines et des inhibiteurs de l’anhydrase carbonique. Utilisez les agonistes alpha avec prudence, ou évitez-les complètement, chez les jeunes patients atteints de JOAG, car des effets indésirables potentiels ont été rapportés chez les nourrissons et les tout-petits, notamment une bradycardie, une hypotension, une hypothermie, une hypotonie, une apnée et une léthargie.8
Lorsque les médicaments ne parviennent pas à contrôler la PIO, le médecin doit se tourner vers la chirurgie. Voici un aperçu de vos options:
* Procédures d’angle. Les interventions chirurgicales basées sur l’angle sont généralement effectuées en premier et sont souvent efficaces pour réduire la PIO et minimiser les complications potentielles à court et à long terme. Le choix entre la goniotomie et la trabéculotomie dépend de la préférence et de l’expérience du chirurgien.
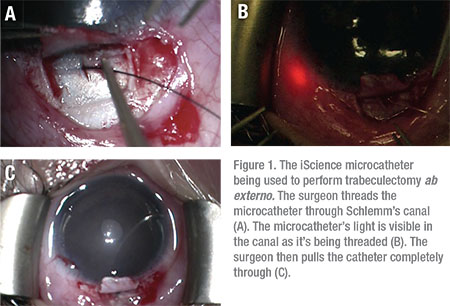
Il a été rapporté que la trabéculotomie, via une approche ab externo, avait un taux de réussite allant jusqu’à 86% dans le traitement de la JOAG, 14% des patients nécessitant une intervention chirurgicale supplémentaire pour contrôler la PIO.9 La trabéculotomie ab externo peut être utilisée pour inciser le maillage trabéculaire sur 360 degrés à l’aide d’une suture ou du microcathéter iScience. (Voir Figure 1)
Des techniques chirurgicales plus récentes, telles que la trabéculotomie transluminale assistée par gonioscopie, ont été développées et se sont également révélées utiles dans cette population de patients. Lors de la procédure du GATT, le chirurgien effectue une petite goniotomie nasale initiale de 1 à 2 mm et avance un microcathéter circonférentiellement à travers le canal de Schlemm. Le cathéter est tiré pour créer une fente à 360 degrés. Le principal avantage des procédures ab interno telles que la goniotomie, le GATT et le Trabectome est qu’elles sont entièrement réalisées par une incision cornéenne, évitant ainsi les incisions conjonctivales et sclérales — et les cicatrices subséquentes —.
Dans les cas où la chirurgie d’angle ne parvient pas à contrôler la PIO, d’autres options chirurgicales incluent des procédures de drainage externe telles que la trabéculectomie avec la mitomycine-C et la chirurgie implantaire de drainage du glaucome, ainsi que des procédures cyclodestructives.
• Trabéculectomie. Les chercheurs ont rapporté des taux de réussite avec une trabéculectomie allant de 50 à 87% chez les patients atteints de JOAG.11-14 Il peut être difficile d’obtenir puis de maintenir un bleb filtrant qui fonctionne bien chez un enfant, car les patients plus jeunes ont une réponse de guérison plus robuste, entraînant souvent une fibrose sous-conjonctivale et épisclérale progressive. La prise en charge postopératoire, y compris l’adhésion aux régimes de gouttes oculaires et aux manipulations telles que la lyse au laser des sutures des lambeaux, est compliquée chez les très jeunes enfants en raison de leur incapacité à coopérer pleinement.
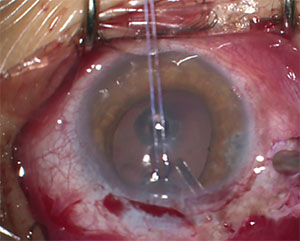
Figure 2. Cet enfant de 13 ans atteint de JOAG a nécessité la mise en place d’un dispositif de drainage du glaucome pour contrôler sa PIO.
Certains cliniciens ont utilisé un traitement antifibrotique par MMC pour réduire la quantité de cicatrices chez les jeunes patients, et cette approche peut entraîner une réduction des IOPs après une trabéculectomie chez les patients atteints de JOAG.11 Cependant, l’utilisation de MMC a également été associée à un risque accru de complications menaçant la vision, y compris une maculopathie hypotonique et une infection liée au bleb. Le taux de maculopathie hypotonique a été rapporté jusqu’à 20%, ce qui peut être dû à l’incidence accrue de la myopie axiale chez ces patients.11 Une étude a révélé une incidence de 17% des infections liées au bleb chez les enfants atteints de bleb fonctionnels.12 Compte tenu de ces résultats, faites preuve de prudence lors de la trabéculectomie avec MMC chez les enfants plus jeunes.
• Implants de drainage du glaucome. En raison de la probabilité plus élevée de cicatrices conjonctivales chez les patients JOAG et du risque accru de complications menaçant la vue avec la trabéculectomie (chez les patients plus jeunes), la chirurgie GDI est une alternative raisonnable. Les GDI les plus couramment utilisés sont la valve du glaucome Ahmed (New World Medical, Rancho Cucamonga, Californie.) et l’implant de glaucome de Baerveldt (Abbott Medical Optics, Santa Ana, Californie.). Des études antérieures avec au moins un an de suivi ont documenté des taux de réussite après une chirurgie pédiatrique GDI allant de 31% à 97%.15 Cependant, les données à long terme concernant l’utilisation du GDI chez les enfants et les jeunes adultes sont limitées.
Un autre problème potentiel avec la DIG chez les enfants est que le positionnement correct du tube dans la chambre antérieure peut être particulièrement difficile. La rigidité sclérale réduite chez ces patients rend la migration antérieure et la rotation de l’extrémité proximale du tube plus fréquentes que chez les adultes.16 La migration du tube peut entraîner un contact direct ou une proximité de l’extrémité du tube avec la surface cornéenne postérieure et peut contribuer à la perte de cellules endothéliales et à une éventuelle décompensation cornéenne. Le positionnement du tube tel qu’illustré à la figure 2 est préférable; notez la longueur plus longue et son angle par rapport à l’endothélium cornéen.
Étant donné que les patients atteints de JOAG sont jeunes et présentent souvent des IOPs très élevées avec des lésions discales avancées, notre préférence est d’utiliser un implant Baerveldt de 350 mm2. Nous utilisons une suture en polyglactine 7-0 pour ligaturer temporairement le tube de ce dispositif non valvé et nous laissons trois à quatre semaines pour qu’une capsule se forme autour de l’explant scléral.
Pour les jeunes enfants, nous effectuons une libération de ligature planifiée en salle d’opération entre les semaines postopératoires trois et quatre à l’aide d’une lentille Hoskins et d’un laser à diode verte.17 Nous facilitons la visualisation de la ligature pour la lyse au laser en utilisant du tissu cornéen comme matériau de greffe de patch. L’élévation fluide de la conjonctive recouvrant la plaque sclérale et le ramollissement profond du globe aident à confirmer la libération de la ligature. Si vous ne savez pas si la ligature a été libérée, vous pouvez utiliser l’échographie en mode B pour démontrer la présence de liquide autour de la plaque de drainage.
Pour remplacer le volume perdu et fournir une résistance accrue à l’écoulement à travers le tube, vous pouvez injecter de l’hyaluronate de sodium (10 mg / ml) dans la chambre antérieure immédiatement après la libération de la ligature. Cela limite la durée et l’ampleur de l’hypotonie et empêche l’effondrement de la chambre antérieure. Pour les enfants plus jeunes, nous laisserons souvent la ligature se libérer spontanément, mais nous les surveillerons de plus près après les premières semaines postopératoires. Pour les enfants et les adultes plus âgés et coopératifs, vous pouvez effectuer une libération de ligature planifiée par lyse au laser suivie d’une injection en chambre antérieure d’hyaluronate de sodium (10 mg / ml) au bureau. Nous préférons maintenir les patients sous atropine à 1% et réduire le nombre de médicaments suppresseurs aqueux dans la mesure du possible après la troisième semaine postopératoire en prévision de l’ouverture du tube. Ces techniques peuvent aider à prévenir les périodes prolongées d’hypotonie et ses complications secondaires après la libération de la ligature.
Bien que la chirurgie GDI et la trabéculectomie aient évolué au fil des ans avec les progrès de la technique chirurgicale et de meilleures façons de moduler la cicatrisation des plaies, des défis uniques existent chez les jeunes patients atteints de JOAG par rapport aux adultes plus âgés. Une évaluation préopératoire et une surveillance postopératoire minutieuses, avec un suivi fréquent et une attention particulière à la détection et à la gestion précoces des événements indésirables, peuvent améliorer les résultats à long terme. REVIEW
Le Dr Menezes est médecin résident à l’infirmerie New-yorkaise des yeux et des oreilles du Mont Sinaï. Dr. Panarelli est professeur adjoint d’ophtalmologie et directeur associé du programme de résidence à l’infirmerie New-yorkaise des yeux et des oreilles du Mont Sinaï. Ils n’ont aucun intérêt financier dans aucun des produits mentionnés.
1. Albert DM, Miller JW, Azar DT, Blodi BA, Cohan JE, Perkins T. Glaucome Juvénile à Angle Ouvert. Dans : Albert & Principes de Jakobiec & Pratique de l’ophtalmologie. 3e éd. Philadelphie: Elsevier 2008.
2. Bruttini M, Longo I, Frezzotti P, et al. Mutations du gène de la myociline dans les familles atteintes de glaucome à angle ouvert primaire et de glaucome à angle ouvert juvénile. Arch Ophthalmol 2003; 121:7:1034-8.
3. Wiggs JL, Allingham RR, Vollrath D, et coll. Prevalence of mutations in TIGR/Myocilin in patients with adult and juvenile primary open-angle glaucome. Am J Hum Genet 1998; 63:5:1549-52.
4. Adam MF, Belmouden A, Binisti P, et coll. Mutation récurrente dans un seul exon codant pour le domaine d’homologie olfactomédine conservé évolutivement du TIGR dans le glaucome familial à angle ouvert. Hum Mol Genet 1997; 6:12:2091-7.
5. Tawara A, Inomata H. Immaturité développementale du maillage trabéculaire dans le glaucome juvénile. Am J Ophthalmol 1984; 15:98:82-97.
6. Ko YC, Liu CJ, Chou JC, et al. Comparaisons des facteurs de risque et des changements du champ visuel entre le glaucome primaire à angle ouvert juvénile et le glaucome primaire à angle ouvert tardif. Ophthalmologica 2002; 216:1:27.
7. Wiggs JL, DelBono EA, Schuman JS, et al. Caractéristiques cliniques de cinq pedigrees génétiquement liés au locus du glaucome juvénile sur le chromosome 1q21-q31. Ophtalmologie 1995; 102:1782-9.
8. Carlsen JO, Zabriskie NA, Kwon YH et coll. Dépression apparente du système nerveux central chez les nourrissons après l’utilisation de brimonidine topique. Am J Ophthalmol 1999; 128:255-256.
9. Ikeda H, Ishigooka H, Muto T, et al. Résultat à long terme de la trabéculotomie pour le traitement du glaucome développemental. Arch Ophthalmol 2004; 122:1122-8.
10. Grover DS, Smith O, Fellman RL et coll. trabéculotomie transluminale assistée par gonioscopie: Une trabéculotomie circonférentielle interne ab pour le traitement du glaucome congénital primaire et du glaucome à angle ouvert juvénile. Br J Ophthalmol 2015; 99:8:1092-6.
11. Tsai JC, Chang HW, Kao CN, et al. Trabéculectomie avec mitomycine C contre trabéculectomie seule pour le glaucome primaire à angle ouvert juvénile. Ophthalmologica 2003; 217:1:24-30.
12. Sidoti PA, Belmonte SJ, Liebmann JM, Ritch R. Trabéculectomie avec mitomycine-c dans le traitement des glaucomes pédiatriques. Ophtalmologie 2000;107:422-9
13. Groh MJ, Behrens A, Haendel A, Kuchle M. Résultats à moyen et long terme après trabéculectomie chez des patients atteints de glaucome à angle ouvert juvénile et juvénile tardif. Klin Monatsbl Augenheilkd 2000;217:71-76
14. Aponte EP, Diehl N, Mohney BG. Résultats médicaux et chirurgicaux dans le glaucome infantile: Une étude basée sur la population. J AAPOS 2011; 15:3:263-7.
15. Chen TC, Chen PP, Francis BA et coll. Chirurgie du glaucome pédiatrique: Un rapport de l’AAO. Ophtalmologie 2014: 121: 11:2107.
16. Netland PA. Walton DS. Implants de drainage du glaucome chez les patients pédiatriques. Ophthalmic Surg 1993; 24:723-729.
17. Sidoti PA, Panarelli, JF, Huruta-Dias R, Jardim J, Leon-Rosen J, Rosen RB. Libération de ligature de tube laser après implantation de shunt aqueux chez les jeunes enfants. Imagerie ophtalmique des lasers Surg 2011; 42: 2: 168-9.