Informations complémentaires
Littérature
Réactions connexes
Synthèse d’Ester Acétoacétique
Synthèse d’Ester malonique

La condensation de composés d’acide carboné avec des aldéhydes pour donner des composés α, β-insaturés.
La Modification de Doebner, qui est possible en présence de groupes acides carboxyliques, comprend une décarboxylation induite par la pyridine.
Mécanisme de la condensation de Knoevenagel
Un intermédiaire énol est formé initialement:

Cet énol réagit avec l’aldéhyde et l’aldol résultant subit une élimination ultérieure induite par les bases:

Une variation raisonnable du mécanisme, dans lequel la pipéridine agit en tant qu’organocatalyseur, implique l’intermédiaire iminium correspondant comme accepteur:
La modification de Doebner dans le reflux des effets de la pyridine décarboxylation et élimination concertées:

Littérature Récente

Synthèse d’Acrylamides par condensation de Doebner-Knoevenagel
M. J. Zacuto, J. Org. Chem., 2019, 84, 6465-6474.

Synthèse Simple et Hautement Stéréosélective d’Alcènes Nitrés (E) ou (Z)
S. Fioravanti, L. Pellacani, P. A. Tardella, M. C. Vergari, Org. Lett., 2008,10, 1449-1451.

Condensation de Knoevenagel Catalysée par le phosphane: Une Synthèse facile des A-Cyanoacrylates et des α-Cyanoacrylonitriles
J. S. Yadav, B. S. S. Reddy, A. K. Basak, B. Visali, A. V. Narsaiah, K. Nagaiah, Eur. J. Org. Chem., 2004, 546-551.

L’Hydrotalcite Reconstruite en tant que Catalyseur de Base Hétérogène Hautement Actif pour les Formations de Liaisons Carbone-Carbone en Présence d’Eau
K. Ebitani, K. Motokura, K. Mori, T. Mizugaki, K. Kaneda, J. Org. Chem., 2006, 71, 5440-5447.

Condensation Knoevenagel Catalysée par l’Indium (III) d’Aldéhydes et de Méthylènes Activés En Utilisant l’Anhydride acétique comme Promoteur
Y. Ogiwara, K. Takahashi, T. Kitazawa, N. Sakai, J. Org. Chem., 2015,80, 3101-3110.

Le tétrafluoroborate BF4 de butyl-1 méthylimidazonium-3 liquide ionique a été utilisé pour la condensation de Knoevenagel catalysée par le diacétate d’éthylènediammonium (EDDA) entre des aldéhydes ou des cétones avec des composés actifs du méthylène. Le catalyseur et le solvant peuvent être recyclés.
C. Su, Z.-C. Chen, Q.-G. Zhen, Synthèse, 2003, 555-559.

Liquide Ionique en tant que Catalyseur et Milieu Réactionnel – Une Procédure Simple, Efficace et Verte pour la Condensation Knoevenagel de Composés Carbonylés Aliphatiques et Aromatiques À l’Aide d’un Liquide Ionique Basique Spécifique à la Tâche
B. C. Ranu, R. Jana, Eur. J. Org. Chem., 2006, 3767-3770.

Condensations Organocatalytiques de Knoevenagel au moyen de Sels d’Ammonium d’Acide Carbamique
N. Mase, T. Horibe, Org. Lett., 2013,15, 1854-1857.

gem-Dibromométhylarènes: Un Substitut pratique des Aldéhydes non commerciaux dans la réaction de Knoevenagel-Doebner pour la Synthèse d’Acides Carboxyliques α, β-Insaturés
J. K. Augustine, Y. A. Naik, A. B. Mandal, N. Chowdappa, V. B. Praveen, J. Org. Chem., 2007,72, 9854-9856.
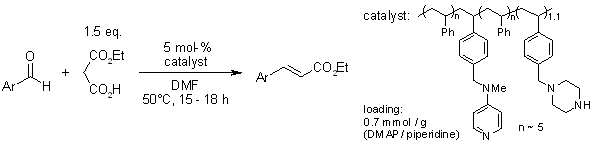
Réactions Organocatalytiques Décarboxylatives de Doebner-Knoevenagel entre les Arylaldéhydes et le Malonate de Monoéthyle Médiées par un Catalyseur Polymère Bifonctionnel
J. Lu, P. H. Toy, Synlett, 2011, 1723-1726.

Approche en Cascade Basée sur la Base pour la Préparation d’Adduits de Knoevenagel Réduits En utilisant des Esters de Hantzsch comme Agent Réducteur dans l’Eau
T. He, R. Shi, Y. Gong, G. Jiang, M. Liu, S. Qian, Z. Wang, Synlett, 2016, 27, 1864-1869.

Un Protocole Pratique et Pratique pour la Synthèse des Acides (E)-α, β-Insaturés
A. R. Mohite, R. G. Bhat, Org. Lett., 2013,15, 4564-4567.

Liquide Ionique en tant que Catalyseur et Milieu Réactionnel – Une Procédure Simple, Efficace et Verte pour la Condensation Knoevenagel de Composés Carbonylés Aliphatiques et Aromatiques À l’Aide d’un Liquide Ionique Basique Spécifique à la Tâche
B. C. Ranu, R. Jana, Eur. J. Org. Chem., 2006, 3767-3770.