- Introduction
- Matériaux et méthodes
- Prélèvement d’œufs
- Quantification des Ecdystéroïdes
- Quantification des hormones juvéniles
- Analyses statistiques
- Résultats
- Discussion
- Ecdystéroïdes
- Hormone juvénile
- Déclaration de disponibilité des données
- Contributions de l’auteur
- Financement
- Conflit d’intérêts
- Remerciements
- Matériel supplémentaire
Introduction
Le rayonnement adaptatif des insectes dans divers climats a été facilité en partie par l’évolution répétée de la diapause, un arrêt anticipé du développement avant des conditions défavorables (par exemple, hiver, saison sèche; Waterhouse et Norris, 1980; Tauber et al., 1986; Danks, 1987; Hodkova et Hodek, 2004). La diapause est généralement déclenchée en réponse à un signal environnemental symbolique (p. ex., changement saisonnier de la photopériode), maintenu pendant une période génétiquement déterminée, puis terminé après le retour de conditions favorables. Ainsi, la diapause permet aux insectes d’aligner leur croissance et leur reproduction sur les cycles saisonniers locaux (Tauber et al., 1986; Danks, 1987). La diapause est un régulateur clé du cycle biologique, de l’aire de répartition géographique et de l’abondance saisonnière de nombreux insectes pollinisateurs (p. ex., Kemp et Bosch, 2005; Fründ et al., 2013), les ravageurs agricoles (p. ex., Pullin et al., 1991; Li et coll., 2012; Levine et coll., 2015) et des vecteurs de maladies (par exemple, Denlinger et Armbruster, 2014; Gray et al., 2016). De plus, la diapause invoque des modifications physiologiques généralisées, notamment l’accumulation de réserves de nutriments, la suppression de l’activité métabolique, un catabolisme anaérobie accru, l’arrêt du cycle cellulaire, des altérations de la signalisation Wnt et la régulation à la hausse de divers mécanismes de tolérance au stress (Denlinger, 2002; Hahn et Denlinger, 2007, 2011; King et MacRae, 2015; Ragland et Keep, 2017). La compréhension des mécanismes de régulation sous-jacents à la diapause est un problème de longue date en biologie des organismes et facilitera le développement de nouvelles approches de gestion des espèces clés.
Les ecdystéroïdes et les hormones juvéniles régulent un large éventail de processus physiologiques et de développement chez les insectes (Gruntenko et Rauschenbach, 2008; Jindra et al., 2013; Palli, 2016), y compris la diapause (Denlinger, 1985; Denlinger et al., 2012). La diapause régulatrice du signal hormonal spécifique a tendance à varier selon le stade d’arrêt du développement (Denlinger et al., 2012). Par exemple, l’arrêt du développement pendant la diapause larvaire ou nymphale est généralement régulé par des changements dans l’abondance des ecdystéroïdes (p. ex., Ohtaki et Takahashi, 1972; Bowen et al., 1984; Richard et coll., 1987). En revanche, l’arrêt du développement pendant la diapause adulte est souvent régulé par des changements dans l’abondance des hormones juvéniles (p. ex. Spielman, 1974; Schooneveld et al., 1977; Saunders et coll., 1990 et voir la revue dans Denlinger et al., 2012).
Une lacune majeure existe dans notre compréhension de la régulation hormonale de la diapause embryonnaire, qui est largement observée chez les lépidoptères, les Orthoptères, les Hémiptères et les diptères. Des recherches antérieures ont largement documenté la régulation endocrinienne de la diapause embryonnaire chez la teigne du ver à soie (Bombyx mori) par l’hormone de la diapause (Hasegawa, 1963; Yamashita et Hasegawa, 1966; Yamashita, 1996). Cependant, ce rôle régulateur de l’hormone de la diapause semble être unique à B. mori et n’a donc fourni que peu de renseignements sur la base hormonale de la diapause embryonnaire chez d’autres espèces (Denlinger et al., 2012). Au-delà de B. mori, la régulation hormonale de la diapause embryonnaire n’a été établie que chez trois espèces. La spongieuse (Lymantria dispar) subit un arrêt de développement initié et maintenu par une abondance plus élevée d’ecdystéroïdes (Lee et al., 1997; Lee et Denlinger, 1997) tandis qu’une faible abondance d’ecdystéroïdes régule la diapause chez deux criquets (Chortoicetes terminifera, Locusta migratoria; Gregg et al., 1987; Tawfik et coll., 2002).
À ce jour, aucune étude n’a caractérisé l’abondance hormonale pendant la diapause embryonnaire d’une espèce de diptère. Ici, nous comblons cette lacune en étudiant la régulation hormonale de la diapause embryonnaire chez le moustique tigre asiatique, Aedes albopictus. Au cours des 30 dernières années, ce vecteur médicalement important (Paupy et al., 2009) a envahi avec succès les régions tempérées du monde entier (Benedict et al., 2007) en partie en raison d’une diapause embryonnaire qui a facilité la survie pendant le transport sur de longues distances (Juliano et Lounibos, 2005; Diniz et al., 2017) et ont évolué rapidement pour aligner le moment de l’arrêt du développement sur les conditions climatiques locales (Urbanski et al., 2012). Populations tempérées d’Ae. les albopictus entrent dans une diapause photopériodique régulée par la mère. Sous de courtes longueurs d’hémérocalles automnales, les femelles produisent des œufs qui terminent le développement embryonnaire mais restent réfractaires aux stimuli d’éclosion sous forme de larves de pharate à l’intérieur du chorion de l’œuf jusqu’au printemps suivant. Au cours de la dernière décennie, la régulation transcriptionnelle de la diapause embryonnaire dans l’Ei. albopictus a été largement caractérisé (Urbanski et al., 2010; Poelchau et coll., 2011, 2013a, b; Huang X. et coll., 2015; Batz et coll., 2017) mais la régulation hormonale de cette adaptation cruciale reste inconnue. Nous avons quantifié la 20-hydroxyecdysone (20HE) et l’hormone juvénile III (JH3) dans des œufs en diapausation et non en diapausation à trois moments clés du développement embryonnaire et interprété nos résultats dans le contexte des RNAseq précédemment collectés (Poelchau et al., 2013a, b) et des données de manipulation (Suman et al., 2015).
Matériaux et méthodes
Prélèvement d’œufs
Toutes les mesures ont utilisé des œufs F11 provenant d’une colonie de laboratoire d’Ae. albopictus établi en août 2015 à partir de plus de 200 larves collectées à Manassas, en Virginie, aux États-Unis. Avant cette expérience, la population était maintenue dans des conditions décrites précédemment. Pour générer des échantillons d’œufs pour cette expérience, les larves F10 ont été maintenues dans des récipients de 5,5 L de sterlite à une densité d’environ 250 larves par 2.5 L d’eau (DI) désionisée avec 5 mL de suspension alimentaire (Armbruster et Conn, 2006) sous photopériode LD à 21 °C et 80% d’humidité relative. Tous les lundis, mercredis et vendredis, les larves ont été filtrées à travers un filet à mailles fines, puis transférées dans un contenant de sterlite propre de 5,5 L. les nymphes ont été réparties dans des cages adultes maintenues sous photopériode LD évitant la diapause ou photopériode de jours courts induisant la diapause (SD, 8:16 L:D).
Les femelles adultes ont reçu des mesures sanguines hebdomadaires et un gobelet de ponte recouvert d’une serviette en papier non blanchie et rempli à moitié d’eau DI jusqu’à ce que la ponte cesse. Les œufs ont été collectés quotidiennement, maintenus sur une serviette en papier humide pendant 48 h, puis séchés à l’air et stockés dans des conteneurs dans des conditions SD. À 5, 7 et 11 jours après la ponte (dpov), les œufs collectés ont été pesés au µg le plus proche (moyenne: 11,460 mg, plage: 9,1-19,5 mg) sur une microbalance MX5 (Mettler-Toledo, Columbia, OH, États-Unis), placés dans des tubes de 1,5 mL, congelés dans de l’azote liquide entre 11 h et 12 h (temps Zeitgeber 3-4 h) et conservés à -80 ° C. Un sous-ensemble d’œufs a été retenu pour confirmer que les conditions de photopériode LD et SD stimulaient la production d’œufs non diapause et de diapause, respectivement (voir Urbanski et al., 2012).
Nous avons échantillonné des œufs à 5, 7 et 11 dpov pour deux raisons. D’abord, Ae. albopictus initie la diapause (sensu Koštál, 2006; Koštál et al., 2017) après l’achèvement du développement embryonnaire (Mori et al., 1981). Dans les conditions utilisées dans nos expériences, Ae. les embryons d’albopictus subissent une segmentation à environ 5 dpov et les embryons non diapause sont capables d’éclore à environ 7 dpov (Poelchau et al., 2013a). À 11 dpov, l’arrêt du développement est fermement établi chez les embryons en diapause (Poelchau et al., 2013b). Ainsi, nous avons choisi de comparer les embryons en diapause et non en diapause à des moments de la période d’éclosion, y compris l’établissement d’un arrêt du développement pendant la diapause. Deuxièmement, nous avons choisi des points temporels similaires à ceux utilisés pour les expériences RNAseq précédentes sur des embryons (Poelchau et al., 2013a, b) afin que ces données puissent être exploitées pour interpréter nos résultats actuels. Ces résultats de RNAseq étaient auparavant bien corrélés avec les résultats d’expression génique obtenus par qRT-PCR (Poelchau et al., 2013a).
Quantification des Ecdystéroïdes
Pour extraire les ecdystéroïdes, des échantillons d’œufs ont été placés dans un tube de broyeur de micro-tissus à fond conique en verre borosilicaté de 0,5 mL (Wheaton, Millville, NJ, États-Unis) avec 1 µg de farnesol (Sigma-Aldrich, St. Louis, MO, États-Unis) ajouté comme étalon interne. Les oeufs ont été homogénéisés manuellement trois fois avec un pilon en téflon dans du MeOH réfrigéré de qualité HPLC de 300 µL puis filés à 12 000 FCR pendant 10 min dans une centrifugeuse réfrigérée (4 ° C). Le surnageant résultant a été mis en commun puis élué à travers des colonnes d’oxyde d’aluminium deux fois avec du MeOH refroidi à 90% et une fois avec du MeOH. Les échantillons ont été séchés dans une centrifugeuse sous vide réfrigérée (4 °C), remis en suspension dans 20 µL de MeOH et stockés à -80 °C jusqu’à l’analyse. Des témoins positifs ont été préparés en ajoutant 1 µg chacun de 20HE (Sigma-Aldrich) et de farnesol dans des tubes vides qui ont été autrement traités de manière identique. L’analyse d’échantillons de concentration d’ecdystéroïdes a été réalisée à l’aide d’une Micromasse Quattro Micro LC-MS/MS (Waters Co., Milford, MA, États-Unis). Les volumes d’injection étaient de 5,0 µL, avec des séparations effectuées à l’aide de colonnes ACQUITY UPLC BEH C18 de 2,1 mm par 50 mm avec une phase stationnaire de 1,7 µm (Waters Co.). Les conditions opératoires pour les essais LC étaient un débit de phase mobile de 0,37 mL min-1 avec une phase mobile binaire de 0,1% d’acide formique dans l’acétonitrile et de 0,1% d’acide formique dans l’eau. Les conditions initiales étaient 1: 99 acétonitrile: eau, suivies d’un écoulement isocratique pendant 0,3 min. À 0,3 min, un gradient linéaire de 1:L’acétonitrile: eau 99 à 99:1 a été appliqué en 4,2 min, suivi d’un écoulement isocratique de 1,0 min à 99:1 acétonitrile: eau, après quoi la phase mobile est revenue à 1:99 acétonitrile: eau. Les réglages du spectromètre de masse ont été électrospray positifs, avec une température de désolvation de 350 °C. 20HE et farnesol élués à 2,89 et 4,97 min, respectivement, et ont été quantifiés en utilisant le suivi de réactions multiples de transitions caractéristiques : 481,22 (m/z) > 445,24 (m/z) et 205,41 (m/z) > 121,09 (m/z), respectivement. La limite de détection du test est d’environ 5 pg.
Quantification des hormones juvéniles
Chaque échantillon d’œuf a été placé dans un tube de broyeur de micro-tissus à fond conique en verre borosilicaté de 0,5 mL (Wheaton) avec 1 µg de farnesol (Sigma-Aldrich) ajouté comme étalon interne. Les œufs ont été homogénéisés manuellement trois fois avec un pilon en téflon dans de l’hexane réfrigéré de qualité HPLC de 500 µL, puis filés à 12 000 FCR pendant 10 min dans une centrifugeuse réfrigérée (4 ° C). Les fractions d’hexane ont été recombinées dans un flacon en verre borosilicaté propre et séchées par centrifugation sous vide. JH a été quantifié par chromatographie en phase gazeuse/spectrométrie de masse comme décrit précédemment (Brent et Vargo, 2003). Brièvement, le résidu a été lavé des flacons avec trois rinçages d’hexane et ajouté sur des colonnes de verre borosilicaté remplies d’oxyde d’aluminium. Pour filtrer les contaminants, les échantillons ont été élués à travers les colonnes successivement avec de l’hexane, de l’éther éthylique-hexane à 10% et de l’éther éthylique-hexane à 30%. Après séchage, les échantillons ont été dérivatisés par chauffage à 60°C pendant 20 min dans une solution d’alcool méthyl-d (Sigma-Aldrich) et d’acide trifluoroacétique (Sigma-Aldrich). Les échantillons ont été séchés, remis en suspension dans de l’hexane et à nouveau élués à travers des colonnes d’oxyde d’aluminium. Les composants non dérivatisés ont été éliminés avec de l’éther éthylique à 30%. Le dérivé JH a été recueilli dans de nouveaux flacons par addition d’éthyl-acétate–hexane à 50%. Après séchage, les échantillons ont été remis en suspension dans de l’hexane, puis analysés à l’aide d’une colonne de CIRE Zebron ZB de la série HP 7890A GC (Agilent Technologies, Santa Clara, CA, États-Unis) équipée d’une colonne de CIRE Zebron ZB de 30 m × 0,25 mm (Phenomenex, Torrance, CA, États-Unis) couplée à un détecteur sélectif de masse inerte HP 5975C. L’hélium a été utilisé comme gaz vecteur. La forme JH a été confirmée par les premiers échantillons d’essai en mode BALAYAGE pour les signatures connues de JH 0, JH I, JH II, JH3 et JH3 éthyle; JH3 a été confirmé comme forme endogène primaire chez cette espèce. Des échantillons subséquents ont été analysés en utilisant le mode MS SIM, suivi à m / z 76 et 225 pour assurer la spécificité du dérivé de d3-méthoxyhydrine de JH3. L’abondance totale a été quantifiée par rapport à une courbe standard de JH3 dérivatisé et ajustée en fonction de la masse initiale des œufs. La limite de détection du test est d’environ 1 pg.
Analyses statistiques
Des analyses ont été effectuées dans R (Équipe de base de R, 2019). L’abondance de JH3 a été transformée en log et analysée à l’aide d’ANOVA pour tester les effets de l’état de la diapause, de l’âge et de leur interaction. 20L’abondance était non linéaire et adaptée à l’aide de deux modèles de régression polynomiale : un modèle complet incluant l’âge et l’état de développement (diapause, non diapause), et un modèle réduit ne contenant que l’âge. Les modèles ont été comparés à l’aide d’ANOVA pour déterminer si l’inclusion du statut de développement améliorait considérablement le pouvoir explicatif.
Les analyses transcriptionnelles ont utilisé des données RNAseq recueillies précédemment à partir d’Ea en diapause et non en diapause. œufs d’albopictus (Jeu de données supplémentaire 1; Poelchau et al., 2013a, b). Des gènes exprimés de manière différentielle à 3, 6 et 11 dpov ont été étudiés par des analyses d’enrichissement d’ensembles de gènes (Mootha et al., 2003) utilisant le paquet de piano (Väremo et al., 2013) réglé sur les paramètres par défaut, suivi d’une correction FDR. Un ensemble de gènes de référence a été annoté avec les termes biological process GO attribués sur VectorBase (Giraldo-Calderón et al., 2015). Les gènes de la voie de synthèse JH3 et ecdystéroïdes ainsi que les récepteurs JH3 et les gènes de dégradation ont été annotés manuellement selon la littérature précédente (Bai et al., 2007; Li et coll., 2011; Nouzova et coll., 2011; Niwa et Niwa, 2014; Matthews et coll., 2016). De plus, nous avons annoté les gènes inductibles JH3 et ecdystéroïdes sur la base des descriptions de gènes fournies dans VectorBase (Giraldo-Calderón et al., 2015). Un aperçu complet de ces ensembles de gènes est fourni dans le jeu de données supplémentaire 1.
Résultats
L’incidence moyenne de la diapause était de 95,9% (plage: 90,5–100%) sous photopériode SD et 5.4% (plage: 1,8–9,5%) sous photopériode LD (Jeu de données supplémentaire 2); ainsi, nos traitements photopériodiques ont induit les réponses attendues à la diapause. 20HE a culminé dans des conditions de diapause et de non-diapause à 7 dpov, mais l’inclusion du statut de diapause comme facteur dans un modèle quadratique pour l’abondance de 20HE n’a pas amélioré le pouvoir explicatif du modèle (Figure 1A et Jeu de données supplémentaire 3; F3, 43 = 0,21, p = 0,890). Ces résultats indiquent que le statut de diapause n’explique pas de manière significative la variation du titre de 20HE. L’analyse de la voie de l’ARNASEQ a indiqué que ni la voie de synthèse de la 20HE ni les gènes inductibles de la 20HE n’étaient significativement modifiés dans des conditions de diapause par rapport à des conditions non diapause à 3, 6 ou 11 dpov (tableau 1).

Tableau 1. Résultats de l’analyse d’enrichissement des ensembles de gènes, voir l’ensemble de données supplémentaire 1 pour un résumé complet de ces ensembles de gènes.
Il a été confirmé que le JH3 était la principale forme d’hormone juvénile chez cette espèce. L’abondance de JH3 a été significativement réduite chez les embryons en diapause (Figure 1B et Jeu de données supplémentaire 3; F1, 64 = 5,08, p = 0,028). Cependant, l’âge (F2, 64 = 0,66, p = 0,518) et l’interaction entre le statut de diapause et l’âge (F2, 64 = 0,13, p = 0,883) n’ont pas affecté les niveaux de JH3. L’analyse de la voie des données RNAseq a indiqué que la voie de synthèse du JH3 était significativement réprimée à 3 dpov et que les gènes inductibles du JH étaient significativement réprimés à 6 dpov (Figure 2 et tableau 1).
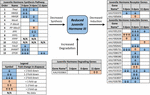
Figure 2. Résumé de l’expression différentielle des gènes impliqués dans la synthèse, la dégradation et l’induction de JH3 pour l’EI. albopictus (Poelchau et al., 2013a, b). Des réductions significatives induites par la diapause (bleu) ou des augmentations (orange) sont indiquées par des cellules ombrées. La grandeur différentielle est indiquée par des flèches comme décrit dans la légende en bas à gauche. ∗Les gènes sans noms communs sont identifiés par un numéro d’identification de base vectorielle.
Discussion
La diapause est une adaptation répandue qui permet aux insectes d’aligner leur croissance et leur reproduction sur des conditions favorables selon les saisons (Tauber et al., 1986; Danks, 1987). Comprendre les changements hormonaux par lesquels les insectes coordonnent la perception des signaux externes induisant la diapause avec les mécanismes physiologiques menant à l’arrêt du développement est un objectif de longue date en biologie (Lees, 1956; Denlinger, 2002). Des décennies de recherche ont mené à l’identification de stratégies hormonales communes pour la diapause aux stades larvaire, nymphal et adulte; cependant, la régulation hormonale de la diapause embryonnaire reste largement inconnue, en particulier chez les diptères (Denlinger, 1985, 2002; Denlinger et al., 2012). Dans cette étude, notre mesure directe de l’abondance réduite de JH3 en diapause est corroborée par un profilage d’expression génique antérieur (Poelchau et al., 2013a, b) et des expériences de manipulation (Suman et al., 2015) soutenant l’hypothèse que JH3 régule la diapause embryonnaire chez cette espèce.
Ecdystéroïdes
Dans la présente étude, nous avons mesuré directement l’abondance des ecdystéroïdes à trois moments dans des conditions de diapause et de non-diapause chez des embryons de moustiques Ae. albopictus. Conformément aux résultats antérieurs de Toxorhynchites amboinensis (Russo et Westbrook, 1986), les niveaux de 20HE ont atteint un sommet vers la fin du développement embryonnaire (7 dpov; Figure 1A). Cependant, le titre 20HE ne différait pas significativement entre les œufs en diapause et les œufs non en diapause. De plus, ni la voie de synthèse de la 20HE ni les gènes inductibles de la 20HE n’ont subi de modifications significatives et coordonnées de l’expression des gènes (tableau 1). Nous concluons que, contrairement aux diapauses embryonnaires précédemment examinées chez les lépidoptères et les orthoptères (Hasegawa, 1963; Yamashita et Hasegawa, 1966; Gregg et al., 1987; Yamashita, 1996; Lee et Denlinger, 1997; Lee et coll., 1997; Tawfik et coll., 2002), 20HE ne réglemente pas l’initiation de la diapause dans l’EI. albopictus.
Hormone juvénile
En revanche, nous avons observé une abondance de JH3 environ deux fois plus faible chez les embryons en diapause (Figure 1B). Bien que de magnitude inférieure aux différences d’abondance de JH3 détectées dans des conditions de diapause par rapport à des conditions non diapause chez les insectes qui diapause à d’autres stades de la vie (p. ex., Yin et Chippendale, 1979; Walker et Denlinger, 1980; Readio et al., 1999), nos mesures directes sont corroborées par des preuves transcriptionnelles (figure 2). Par exemple, la voie de synthèse de JH3 est significativement réprimée lors de la préparation précoce de la diapause (3 dpov). À l’appui de notre interprétation de ces résultats, des études antérieures ont montré qu’une expression réduite des gènes le long de la voie de synthèse du JH3 est fortement corrélée à une abondance plus faible du JH3 chez les deux Aedes aegypti (Nouzova et al., 2011; Rivera-Perez et coll., 2014) et Diploptera punctata (Huang J. et al., 2015). Les gènes inductibles du JH sont également réprimés de manière significative lors de la préparation tardive de la diapause (6 dpov; Tableau 1), ce qui suggère que les embryons destinés à la diapause ont une capacité limitée à répondre à la signalisation du JH3 près du moment où les embryons non diapause deviennent compétents pour éclore. De plus, l’expression génique d’une enzyme dégradant la JH3 (JH estérase) est significativement régulée à la hausse au début du maintien de la diapause (11 dpov; Figure 2) ainsi que plus tard dans le maintien de la diapause (21 et 40 dpov; Poelchau et al., 2013b) suggérant que JH3 pourrait rester à faible abondance tout au long de la diapause chez cette espèce.
Une abondance réduite de JH3 pendant l’arrêt du développement est quelque peu contre-intuitive car un faible titre hormonal juvénile est généralement associé à des mues progressives, en particulier du stade larvaire au stade nymphal (Palli, 2016). Cependant, application d’un analogue de JH3 (pyriproxyfène) à l’Ea diapause. les œufs d’albopictus accélèrent le taux de terminaison de la diapause d’une manière dose-dépendante (Suman et al., 2015). À la dose la plus efficace, environ 80 % des œufs exposés au pyriproxyfène terminent la diapause par 30 dpov, comparativement à seulement 1 % de la diapause par 80 dpov pour les œufs témoins (Suman et al., 2015). Les altérations de l’abondance de JH3 peuvent également générer un phénotype embryonnaire de type diapause chez d’autres espèces. Par exemple, dans B. mori, la réduction expérimentale de la synthèse de JH3 par knockout de JHAMT conduit à des larves de pharate complètement développées qui ne répondent pas aux stimuli d’éclosion; ce phénotype peut être sauvé de manière dose-dépendante par application de JH3 extrait ou de méthoprène, un analogue de JH3 (Nakao et al., 2015). De même, la supplémentation expérimentale d’un autre analogue hormonal juvénile (RO-20-3600) à des œufs de Drosophila melanogaster nouvellement déposés produit des larves de pharate qui sont mobiles à l’intérieur de l’œuf mais ne parviennent pas à éclore (Smith et Arking, 1975). Ensemble, ces données indiquent que l’abondance des hormones juvéniles contribue probablement à la régulation des réponses à l’éclosion chez divers insectes. La diapause embryonnaire au stade larvaire du pharate est définie par une incapacité à répondre aux stimuli d’éclosion. ainsi, les changements dans l’abondance des hormones juvéniles peuvent représenter une stratégie hormonale commune pour réguler cette forme de diapause.
De concert avec les données transcriptionnelles et manipulatrices précédentes, nos résultats impliquent fortement une abondance réduite de JH3 en tant que régulateur probable de la diapause embryonnaire dans l’Ei. albopictus. Cette recherche est la première quantification directe de l’abondance hormonale pendant la diapause embryonnaire chez une espèce de diptère et représente une étape importante vers la clarification de la régulation hormonale de cette adaptation cruciale aux environnements défavorables. Caractériser le lien entre les stimuli externes et l’arrêt du développement via la signalisation hormonale reste un défi majeur (Denlinger, 1985; Denlinger et al., 2012). L’élucidation de ces voies chez une variété d’espèces fournira un aperçu critique des problèmes fondamentaux et appliqués, notamment la compréhension des bases moléculaires et physiologiques de l’évolution du cycle vital, la prédiction des réponses des espèces au changement climatique et l’identification de nouvelles cibles pour la gestion des espèces ravageuses et vectorielles (Denlinger, 2008).
Déclaration de disponibilité des données
Tous les ensembles de données générés pour cette étude sont inclus dans l’article / Matériel supplémentaire.
Contributions de l’auteur
ZB, CB et PA ont contribué à la conception, à la conception de l’étude et à la préparation de l’ébauche initiale du manuscrit. ZB, MM et JS ont effectué l’élevage et collecté les échantillons d’œufs. CB a effectué les analyses LC-MS/MS et GC-MS. ZB a effectué les analyses statistiques. Tous les auteurs ont contribué à la révision du manuscrit et ont approuvé la version soumise.
Financement
Ce travail a été soutenu par les National Institutes of Health (1R15A/111328-01) et le Davis Family Endowment to PA.
Conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions Allan Knopf et Dan Langhorst pour leur aide dans la mesure des titres hormonaux. Nous remercions également David Denlinger pour ses commentaires utiles sur les versions antérieures du manuscrit. L’utilisation de noms commerciaux ou de produits commerciaux dans cet article vise uniquement à fournir des informations spécifiques et n’implique pas une recommandation ou une approbation du département de l’Agriculture des États-Unis. L’USDA est un fournisseur d’égalité des chances et un employeur.
Matériel supplémentaire
R Équipe de base (2019). R : Un Langage et un Environnement pour le Calcul Statistique. Vienne: Équipe de base R.
Google Scholar
Väremo, L., Nielsen, J. et Nookaew, I. (2013). Enrichir l’analyse des ensembles de gènes de données à l’échelle du génome en intégrant la directionnalité de l’expression des gènes et en combinant des hypothèses et des méthodes statistiques. Acides nucléiques Res. 41, 4378-4391. doi: 10.1093/nar/gkt111
Résumé publié / Texte intégral croisé / Google Scholar