
Sur la plupart de ces pages, nous avons parlé de polymères dont les chaînes dorsales sont constituées principalement d’atomes de carbone, sinon entièrement d’atomes de carbone. Ce que nous appelons des polymères organiques. Mais maintenant, nous allons laisser la convention derrière nous et parler de certains polymères qui n’ont pas d’atomes de carbone dans la chaîne dorsale. Ceux-ci sont appelés, comme si vous ne pouviez pas deviner, des polymères inorganiques. Voici un menu si les polymères inorganiques sur cette page pour vous aider à naviguer:
- Silicones Polysilanes Polygermanes et polystannanes Polyphospahazènes
Silicones
Vous avez certainement déjà vu des polymères inorganiques, en particulier ceux appelés silicones. Les silicones sont les polymères inorganiques les plus courants. Ils ressemblent à ceci:
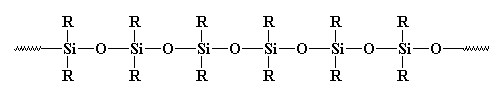
Ils devraient vraiment être appelés polysiloxanes. La liaison entre le silicium et l’oxygène est très forte, mais très flexible. Les silicones peuvent donc supporter des températures élevées sans se décomposer, mais elles ont des températures de transition vitreuse très basses. Vous avez probablement déjà vu du caoutchouc ou du calfeutrage en silicones.
Polysilanes
Regardons un instant l’élément silicium. Vous pouvez voir que c’est juste sous le carbone dans le graphique périodique. Comme vous vous en souvenez peut-être, les éléments d’une même colonne ou d’un même groupe sur le graphique périodique ont souvent des propriétés très similaires. Ainsi, si le carbone peut former de longues chaînes polymères, le silicium devrait également pouvoir le faire.
N’est-ce pas?
Droite. Il a fallu beaucoup de temps pour y arriver, mais les atomes de silicium ont été transformés en longues chaînes de polymères. C’est dans les années 1920 et 30 que les chimistes ont commencé à comprendre que les polymères organiques étaient constitués de longues chaînes carbonées, mais des recherches sérieuses sur les polysilanes n’ont été menées qu’à la fin des années soixante-dix.
Plus tôt, en 1949, à peu près au même moment où le romancier Kurt Vonnegut travaillait pour le département des relations publiques de General Electric, C.A. Burkhard travaillait dans le département de recherche et développement de G.E. Il a inventé un polysilane appelé polydiméthylsilane, mais ce n’était pas très bon pour rien. Cela ressemblait à ceci:
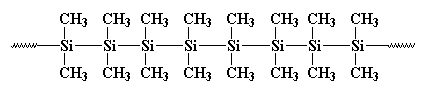
Il a formé des cristaux si forts que rien ne pouvait les dissoudre. Burkhard a essayé de le chauffer, mais il ne fondrait pas en dessous de 250oC, lorsqu’il se décomposait, sans fondre. Cela a rendu le polydiméthylsilane à peu près inutile. Il l’a fait en faisant réagir du métal sodique avec du dichlorodiméthylsilane comme ceci:
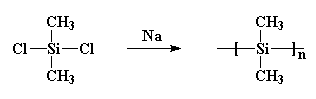
C’est important, car dans les années soixante-dix, certains scientifiques ont eu l’idée qu’ils allaient fabriquer de petits anneaux d’atomes de silicium. Donc, sans le vouloir, a fait quelque chose de similaire à ce que Burkhard avait fait. Ils ont fait réagir du sodium métal avec du dichlorodiméthyl silane, mais ils ont également ajouté du dichlorométhylphénylsilane au breuvage. Et devinez ce qui s’est passé! Je vais vous donner un indice: ils n’ont pas eu les bagues qu’ils voulaient. Ce qu’ils ont obtenu était un copolymère, comme ceci:
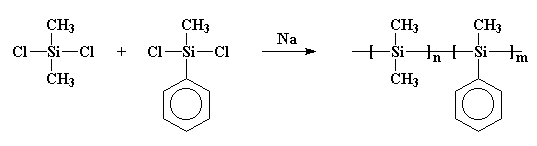
Peut-être que ce polymère est plus clairement dessiné comme ceci:
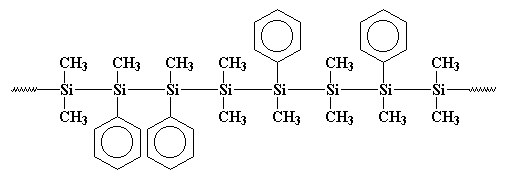
Vous voyez, ces groupes phényles se gênent lorsque le polymère essaie de cristalliser, il n’est donc pas aussi cristallin que le polydiméthylsilane. Cela signifie qu’il est soluble et peut être traité, joué et étudié.
Alors à quoi servent-ils? Les polysilanes sont intéressants car ils peuvent conduire l’électricité. Pas aussi bien que le cuivre, mais beaucoup mieux que ce à quoi vous vous attendez pour un polymère, et mérite d’être étudié. Ils sont également très résistants à la chaleur, presque jusqu’à 300 oC, mais si vous les chauffez beaucoup plus haut, vous pouvez en faire du carbure de silicium, qui est un matériau abrasif utile.
Polygermanes et polystannanes
D’accord, donc si le silicium peut faire de longues chaînes polymères, qu’en est-il des autres éléments du Groupe IV? Pouvez-vous fabriquer des polymères à partir de germanium? Tu ferais mieux de croire que tu peux! Non seulement vous pouvez fabriquer des chaînes polymères à partir de germanium, mais vous pouvez même fabriquer une chaîne polymère à partir d’atomes d’étain. Ces polymères sont appelés polygermanes et polystannanes, respectivement.

Les polystannanes sont uniques et astucieux et merveilleux et fabuleux parce qu’ils sont les seuls polymères connus avec des os arrière entièrement fabriqués à partir d’atomes de métal. Comme les polysilanes, les polygermanes et les polystannanes sont à l’étude pour être utilisés comme conducteurs électriques.
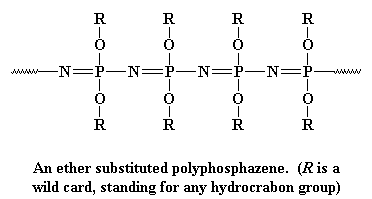
Cette colonne vertébrale est très flexible, comme la chaîne dorsale du polysiloxane, de sorte que les polyphosphazènes font de bons élastomères. Ce sont également de très bons isolants électriques. Les polyphosphazènes sont fabriqués en deux étapes:
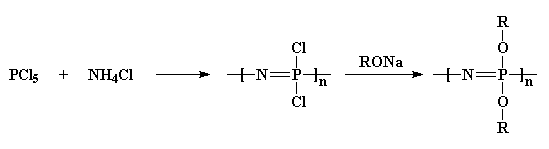
Nous prenons d’abord du pentachlorure de phosphore et le faisons réagir avec du chlorure d’ammonium pour obtenir un polymère chloré. Ensuite, nous le traitons avec un sel d’alcool sodique, ce qui nous donne un polyphosphazène substitué à l’éther.
Eh bien, c’est assez de ce sujet fascinant pour l’instant. Bien qu’il puisse y avoir de nouveaux polymères inorganiques passionnants qui ont été fabriqués (la recherche continue, bien sûr), nous ne pouvons pas tout couvrir dans ces pages. Et n’oubliez pas qu’il existe des combinaisons intéressantes d’hétéroatomes (atomes non carbonés) avec des atomes de carbone dans une variété d’os dorsaux polymères et de groupes pendants. Ceux-ci pourraient être appelés « semi-inorganiques », bien que cela puisse être trop artificiel pour certains.
 |
Retour au Répertoire de niveau Trois |
 |
Retour au répertoire Acrogalleria |