Les chéloïdes sont des néoplasmes fibroprolifératifs cutanés bénins qui surviennent aux sites de lésion cutanée à la suite d’une récupération anormale de la plaie. Ils sont caractérisés par une accumulation excessive de matrice extracellulaire avec des faisceaux de collagène épaissis et désorganisés. Contrairement au tissu cicatriciel normal, les chéloïdes ne régressent pas et peuvent s’étendre au-delà des limites de la plaie d’origine (1). Bien que l’étiologie exacte des chéloïdes soit mal comprise, il est généralement reconnu que la génétique et les facteurs environnementaux contribuent à leur pathogenèse. Les personnes à la peau foncée ayant une prédisposition familiale sont particulièrement sensibles. Nous présentons ici un cas de chéloïdes éruptives associées au cancer du sein et discutons des facteurs de croissance communs associés aux deux.
RAPPORT DE CAS
Un homme afro-américain de 81 ans a été référé en dermatologie en mai 2007 pour une évaluation des lésions éruptives de type chéloïde sur son tronc. Ses antécédents médicaux étaient remarquables pour un carcinome à cellules rénales en 1988 (traité par néphrectomie), une insuffisance cardiaque congestive, une maladie rénale chronique de stade 4 et une longue histoire de chéloïdes typiques à la suite d’un traumatisme léger. Il avait également des antécédents familiaux de chéloïdes. L’examen cutané a révélé une chéloïde typique sur l’hélice de l’oreille gauche. Il a également révélé des plaques hyperpigmentées sclérotiques atypiques avec des formes figurées sur le dos, les aisselles bilatérales, l’aine, les organes génitaux, les jambes, la poitrine et l’abdomen (Fig. 1 BIS). Selon le rapport du patient, ceux-ci augmentaient et devenaient de plus en plus prurigineux. Il a nié tout traumatisme ou blessure à l’un des nouveaux sites. Initialement, le diagnostic différentiel était important, y compris les mycoses fongoïdes, les sarcoïdes et la syphilis, mais une biopsie par perforation a confirmé un diagnostic de chéloïdes.
Le patient est retourné à la clinique au début de 2008 en se plaignant d’une augmentation des lésions et d’un prurit croissant ne répondant pas à la triamcinolone topique 0,1%. Il était maintenant incapable de lever les bras au-dessus de sa tête en raison de chéloïdes axillaires étendues. Un traitement intralésional à la triamcinolone a été administré, mais cela aurait aggravé son état. La pentoxifylline, l’hydroxyzine, le clobétasol topique et l’imiquimod topique n’ont pas apporté de soulagement adéquat. Le patient a été référé à la radio-oncologie pour évaluation et il a été présenté aux grands tours de dermatologie de l’Université de Californie Davis. Un dépistage des tumeurs malignes pour exclure un processus paranéoplasique a été recommandé. Quelques mois plus tard, il s’est présenté aux urgences pour un problème sans rapport, et une radiographie pulmonaire de routine a révélé une masse dans son sein droit. Un diagnostic de cancer du sein a été confirmé par biopsie. Le patient a ensuite subi une mastectomie totale droite. Après l’opération, il a noté une résolution immédiate du prurit sévère qui avait été associé à ses chéloïdes. Quatre mois après l’opération, les chéloïdes couvraient la même zone qu’auparavant, mais étaient maintenant plus minces (Fig. 1B).
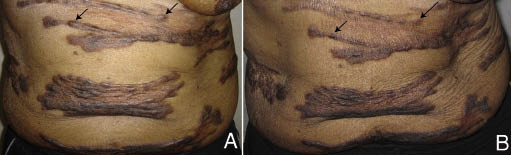
Fig. 1. Amélioration des chéloïdes après l’excision chirurgicale du cancer du sein. (A) Avant la chirurgie, il existe de nombreuses plaques hypertrophiques avec des zones et des nodules ressemblant à des cordons. (B) Après la chirurgie, les plaques restent mais elles sont plus minces et les régions en forme de cordon ont été remplacées par de petits nodules intermittents. Les flèches indiquent des exemples de nodules épais qui se sont aplatis après la chirurgie.
DISCUSSION
Les chéloïdes présentent un défi redoutable car elles sont souvent réfractaires au traitement et peuvent entraîner une morbidité psychologique et physique importante. La façon dont les chéloïdes se forment est actuellement inconnue, mais une expression anormale des facteurs de croissance a été caractérisée dans le tissu chéloïde. Chez notre patiente, nous soupçonnons que le carcinome du sein a modifié les facteurs de croissance et les taux de cytokines, provoquant une exacerbation de ses symptômes chéloïdaux. Plus précisément, une expression accrue du facteur de croissance transformant bêta (TGF-β), du facteur de croissance endothélial vasculaire (VEGF), du facteur de croissance dérivé des plaquettes (PDGF) et d’autres facteurs de croissance ont été associés au cancer du sein. Ces mêmes facteurs pourraient, en théorie, avoir favorisé la croissance des chéloïdes chez notre patient qui, selon des antécédents médicaux et familiaux antérieurs, était particulièrement sensible à leur développement.
Le TGF-β appartient à une famille de protéines homodimériques qui régulent la croissance et la différenciation cellulaires. Des niveaux élevés d’expression du TGF-β peuvent être trouvés dans les tumeurs malignes courantes, y compris le carcinome de l’endomètre et les cancers du sein (2, 3). Dalal et coll. (4) ont rapporté que l’expression à haut niveau de TGF-β1 est corrélée à une incidence plus élevée de métastases sur des sites distants. À l’appui de cette affirmation, Padoue et al. (5) a fourni des preuves que le TGF-β amorce les cancers du sein pour les métastases pulmonaires. Bien que nous n’ayons pas mesuré le taux de TGF-β chez notre patiente, il peut avoir été élevé secondaire au cancer du sein. On pense généralement que le TGF-β joue un rôle clé dans la formation des chéloïdes grâce à ses actions en tant que cytokine profibrotique. Grâce à des cascades de signalisation peu claires, le TGF-β régule l’expression des gènes codant pour les collagènes de type I et VI (6). Des études suggèrent que les fibroblastes dérivés des chéloïdes surexpriment les isoformes TGF-β1 et TGF-β2 (7). Il existe également des preuves impliquant un rôle du TGF-β dans l’angiogenèse, médiée par une production accrue de VEGF (8).
Le VEGF est un mitogène puissant qui induit la formation de vaisseaux sanguins dans les tissus normaux et malins. Étant donné que les chéloïdes sont caractérisées par une densité accrue des vaisseaux sanguins par rapport au derme normal ou au tissu cicatriciel, une expression anormale du VEGF a également été impliquée dans la formation de chéloïdes (9). Le VEGF est surexprimé par le cancer du sein et les cellules stromales du sein (10); ainsi, des niveaux accrus de VEGF pourraient avoir contribué à l’exacerbation des chéloïdes observées chez notre patiente.
Enfin, la surexpression de la signalisation des récepteurs PDGF a été associée à des maladies fibrotiques et vasculoprolifératives et au cancer. Les fibroblastes dérivés des chéloïdes montrent une augmentation de la réactivité au PGDF, probablement par une régulation ascendante des récepteurs PDGF-α (11). Les taux de PDGF sont connus pour être régulés à la hausse par les cellules cancéreuses du sein (12), et une concentration sérique élevée de PDGF est associée à un risque accru de métastases. Il est possible que notre patient ait également eu des taux anormaux de PDGF ou de son récepteur.
Précédemment, Coppa et al. (13) ont signalé un cas de chéloïdes éruptives chez une femme afro–américaine atteinte d’un carcinome de l’endomètre. Ils soupçonnaient que le passage de l’hyperplasie de l’endomètre au carcinome prédisposait le patient aux chéloïdes par altération des taux de cytokines. Bien que notre patiente ait déjà des antécédents de chéloïdes, nous soupçonnons que des altérations des facteurs de croissance favorisant les chéloïdes et des cytokines secondaires à son carcinome mammaire ont pu augmenter la gravité de ses chéloïdes. La preuve la plus forte en est qu’après la résection de sa tumeur, le patient a signalé une résolution immédiate des symptômes associés à ses chéloïdes. Une autre hypothèse, soulignée au cours du processus d’examen, est que le cancer pourrait avoir induit une réponse immunitaire spécifique à la tumeur qui aurait pu affecter la croissance des chéloïdes, soit par reconnaissance croisée des cellules fibroblastiques, soit par un mécanisme passant (14).
REMERCIEMENTS
EM est soutenu par des prix de carrière du Howard Hughes Medical Institute et du Burroughs Wellcome Fund. Cette recherche a été menée dans le système de soins de santé du Département des Anciens combattants de la Californie du Nord.