Forme posologique: aérosol, mousse
Revue médicale par Drugs.com . Dernière mise à jour le 1 septembre 2019.
- Aperçu
- Effets secondaires
- Posologie
- Professionnel
- Grossesse
- Plus
- Indications et utilisation pour la mousse de Kétoconazole
- Dosage et administration de la mousse de Kétoconazole
- Formes posologiques et concentrations
- Contre-indications
- Mises en garde et précautions
- Sensibilisation au contact
- Contenu inflammable
- Effets systémiques
- Effets indésirables
- Expérience des essais cliniques
- Études de sécurité cutanée
- Expérience après la commercialisation
- UTILISATION DANS DES POPULATIONS SPÉCIFIQUES
- Grossesse
- Lactation
- Femelles et Mâles ayant un potentiel reproducteur
- Utilisation pédiatrique
- Utilisation gériatrique
- Mousse de kétoconazole Description
- Mousse de kétoconazole – Pharmacologie clinique
- Mécanisme d’action
- Pharmacodynamique
- Pharmacocinétique
- Microbiologie
- Toxicologie non clinique
- Carcinogenèse, Mutagénèse, Altération de la fertilité
- Études cliniques
- Comment Fourni / Stockage et manipulation
- Information sur le conseil du patient
- Mode d’emploi
- INFORMATION POUR LE PATIENT
- EMBALLAGE / ÉTIQUETTE PANNEAU D’AFFICHAGE PRINCIPAL – CARTON
- En savoir plus sur le kétoconazole topique)
- Consumer resources
- Professional resources
- Related treatment guides
Indications et utilisation pour la mousse de Kétoconazole
Mousse de Kétoconazole, 2% est indiqué pour le traitement topique de la dermatite séborrhéique chez les patients immunocompétents de 12 ans et plus.
Limites d’utilisation
L’innocuité et l’efficacité de la mousse de kétoconazole, 2% pour le traitement des infections fongiques n’ont pas été établies.
Dosage et administration de la mousse de Kétoconazole
La mousse de kétoconazole, 2% doit être appliquée sur la ou les zones touchées deux fois par jour pendant quatre semaines.
Tenez le récipient droit et distribuez de la mousse de kétoconazole à 2% dans le capuchon de la boîte ou toute autre surface froide en une quantité suffisante pour couvrir la ou les zones touchées. La distribution directe sur les mains n’est pas recommandée, car la mousse commencera à fondre immédiatement au contact de la peau chaude. Ramassez de petites quantités de mousse de kétoconazole, 2% du bout des doigts, et massez doucement dans la ou les zones touchées jusqu’à ce que la mousse disparaisse. Pour les zones porteuses de cheveux, séparez les cheveux, de sorte que la mousse de kétoconazole, à 2%, puisse être appliquée directement sur la peau (plutôt que sur les cheveux).
Éviter tout contact avec les yeux et les autres muqueuses. La mousse de kétoconazole, 2%, n’est pas destinée à un usage ophtalmique, oral ou intravaginal.
Formes posologiques et concentrations
Mousse de kétoconazole, 2% contient 20 mg de kétoconazole, USP par gramme, fournis dans des récipients de 50 g et 100 g.
Contre-indications
Aucune.
Mises en garde et précautions
Sensibilisation au contact
La mousse de kétoconazole, 2% peut entraîner une sensibilisation au contact, y compris une photoallergénicité.
Contenu inflammable
Le contenu de la mousse de kétoconazole, à 2%, comprend de l’alcool et du propane / butane, qui sont inflammables. Évitez le feu, la flamme et / ou le tabagisme pendant et immédiatement après l’application. Ne pas perforer et/ou incinérer les récipients. Ne pas exposer les contenants à la chaleur et/ou les conserver à des températures supérieures à 49 °C (120 °F).
Effets systémiques
Une hépatite a été observée avec le kétoconazole administré par voie orale (incidence rapportée de 1:10 000). Des taux sériques réduits de testostérone et de corticostéroïdes induits par l’ACTH ont été observés avec des doses élevées de kétoconazole administré par voie orale. Ces effets n’ont pas été observés avec le kétoconazole topique.
Effets indésirables
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d’effets indésirables observés dans les essais cliniques d’un médicament ne peuvent pas être directement comparés aux taux observés dans les essais cliniques d’un autre médicament et peuvent ne pas refléter les taux observés dans la pratique. Les informations sur les effets indésirables des essais cliniques fournissent toutefois une base pour identifier les effets indésirables qui semblent être liés à l’utilisation de médicaments et pour approximer les taux.
Les données de sécurité présentées dans le tableau 1 reflètent l’exposition à la mousse de kétoconazole, 2 % chez 672 sujets de 12 ans et plus atteints de dermatite séborrhéique. Les sujets ont appliqué de la mousse de kétoconazole, 2% ou de la mousse de véhicule deux fois par jour pendant 4 semaines sur les zones touchées du visage, du cuir chevelu et / ou de la poitrine. Les effets indésirables survenant chez > 1% des sujets sont présentés dans le tableau 1.
Tableau 1: Effets indésirables rapportés par > 1 % des sujets dans les essais cliniques
|
Effets Indésirables |
Mousse de kétoconazole, 2% N = 672 n (%) |
Mousse de véhicule N = 497 n (%) |
|
Sujets présentant un effet indésirable |
188 (28%) |
122 (25%) |
|
Gravure sur site d’application |
67 (10%) |
49 (10%) |
|
Réaction au site d’application |
41 (6%) |
24 (5%) |
Les réactions au site d’application rapportées chez < 1% des sujets étaient une sécheresse, un érythème, une irritation, une paresthésie, un prurit, une éruption cutanée et une chaleur.
Études de sécurité cutanée
Dans une étude de photoallergénicité, 9 des 53 sujets (17%) ont eu des réactions au cours de la période de défi aux sites irradiés et non irradiés traités avec de la mousse de kétoconazole, soit 2%. Mousse de kétoconazole, 2% peut provoquer une sensibilisation par contact.
Expérience après la commercialisation
Les effets indésirables suivants ont été identifiés lors de l’utilisation de la mousse de kétoconazole après la commercialisation, 2%:
Troubles gastro-intestinaux: Chéilite
Troubles généraux et conditions au site d’administration: Douleur au site d’application et brûlure au site d’application
Troubles cutanés et tissulaires sous-cutanés: Sensation de brûlure cutanée et érythème
Étant donné que ces événements sont signalés volontairement dans une population de taille incertaine, il n’est pas toujours possible d’estimer de manière fiable leur fréquence ou d’établir une relation de cause à effet avec l’exposition au médicament.
UTILISATION DANS DES POPULATIONS SPÉCIFIQUES
Grossesse
Résumé des risques
Il n’y a pas de données disponibles sur la mousse de kétoconazole, utilisation de 2% chez les femmes enceintes pour identifier un risque associé au médicament de malformations congénitales majeures, de fausse couche ou de résultats maternels ou fœtaux défavorables. Aucune étude de reproduction chez l’animal n’a été réalisée avec de la mousse de kétoconazole, 2%. Dans les études de reproduction chez l’animal avec des souris gravides, des rats et des lapins, des effets embryotoxiques et développementaux (anomalies structurelles) ont été observés après l’administration orale de kétoconazole au cours de l’organogenèse. En supposant une absorption systémique équivalente de doses topiques et orales de kétoconazole et d’une mousse de kétoconazole, la dose maximale recommandée chez l’homme (DMRH) de 2% de 8 grammes (équivalent à 160 mg de kétoconazole), des effets embryotoxiques ont été observés à 0,8 à 2,4 fois la DMRH et des effets sur le développement ont été observés à 4.8 fois le MRHD.
Le risque de fond de malformations congénitales majeures et de fausses couches pour la population indiquée est inconnu. Toutes les grossesses présentent un risque de malformation congénitale, de perte ou d’autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausses couches dans les grossesses cliniquement reconnues est de 2 à 4% et de 15 à 20%, respectivement.
Données
Données animales
Les multiples animaux des calculs d’exposition humaine sont basés sur des comparaisons de la surface corporelle (ASB) des doses orales administrées aux animaux et d’une mousse de kétoconazole, dose maximale recommandée pour l’homme (DMRH) de 2 % de 8 grammes (équivalent à 2,67 mg de kétoconazole/kg/jour pour un individu de 60 kg ou à 98,8 mg de kétoconazole/m2/jour).
Des études sur le développement embryofétal ont été menées chez des souris, des rats et des lapins avec du kétoconazole administré par voie orale. Lorsqu’il a été administré par voie orale à des souris des jours de gestation 6 à 18 (couvrant la période d’organogenèse), le kétoconazole était embryotoxique (25 mg / kg et plus; 0,8 fois la DMRH basée sur des comparaisons BSA) avec une incidence élevée de résorptions, un nombre accru de mortinaissances et une mise bas retardée. Des retards de maturation ont également été observés. Il n’y avait aucune preuve de toxicité ou de malformations maternelles jusqu’à 50 mg / kg (1,5 fois la DMRH sur la base des comparaisons de BSA). Aucun effet sur le développement lié au traitement n’a été observé à la dose de 10 mg/kg (0,3 fois la DMRH sur la base des comparaisons de BSA).
En présence de toxicité maternelle chez le rat, le kétoconazole administré par voie orale était à la fois embryotoxique (40 mg / kg et plus; 2,4 fois la DMRH sur la base des comparaisons BSA), y compris une augmentation de la résorption des fœtus et des mortinaissances, et tératogène (80 mg / kg et plus; 4,8 fois la DMRH sur la base des comparaisons BSA), y compris syndactylie, oligodactylie, côtes ondulées et fente palatine. De plus, le kétoconazole administré par voie orale à 100 mg/ kg (6 fois la DMRH sur la base de comparaisons avec la BSA) en une seule journée pendant la gestation (jours gestationnels 9 à 12) était embryotoxique (résorptions accrues). Cette même dose orale administrée au jour 12, 13, 14 ou 15 de la gestation a induit des malformations externes incluant une fente palatine, une micromélie et des anomalies numériques (brachydactylie, ectrodactylie, syndactylie).
Chez les lapines gravides administrées par voie orale de kétoconazole, des signes d’embryotoxicité (résorptions accrues) ont été observés à 10 mg/kg (1,2 fois la DMRH sur la base des comparaisons de BSA) et plus, et une incidence accrue d’anomalies squelettiques a été observée à 40 mg/kg (4,8 fois la DMRH sur la base des comparaisons de BSA).
Lactation
Résumé du risque
Aucune information n’est disponible sur la présence de kétoconazole dans le lait maternel, ni sur les effets sur l’enfant allaité, ni sur la production de lait après application topique de mousse de kétoconazole, 2% chez les femmes qui allaitent. Lors d’études chez l’animal, le kétoconazole a été trouvé dans le lait après administration orale. Les avantages pour le développement et la santé de l’allaitement doivent être pris en compte, de même que les besoins cliniques de la mère en mousse de kétoconazole (2%) et tout effet indésirable potentiel sur le nourrisson allaité provenant de la mousse de kétoconazole (2%) ou de la condition maternelle sous-jacente.
Femelles et Mâles ayant un potentiel reproducteur
Infertilité
Dans les études de fertilité chez l’animal chez le rat et le chien, l’administration de doses orales de kétoconazole entre 3 jours et 3 mois a entraîné une infertilité réversible.
Utilisation pédiatrique
L’innocuité et l’efficacité de la mousse de kétoconazole, 2% chez les patients pédiatriques de moins de 12 ans, n’ont pas été établies.
Sur les 672 sujets traités avec de la mousse de kétoconazole, 2% dans les essais cliniques, 44 (7%) étaient âgés de 12 à 17 ans. .
Utilisation gériatrique
Sur les 672 sujets traités avec de la mousse de kétoconazole, 2% dans les essais cliniques, 107 (16%) avaient 65 ans et plus.
Les essais cliniques sur la mousse de kétoconazole, 2% n’incluaient pas un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s’ils répondaient différemment des sujets plus jeunes.
Mousse de kétoconazole Description
Mousse de kétoconazole, 2% contient 2% de kétoconazole USP, un agent antifongique, dans une mousse hydroéthanolique thermolabile pour application topique.
Le nom chimique du kétoconazole est pipérazine, 1-acétyl-4-méthoxy] phényl]-, cis- de formule moléculaire C26H28CI2N4O4 et de poids moléculaire de 531,43.
Voici la structure chimique:
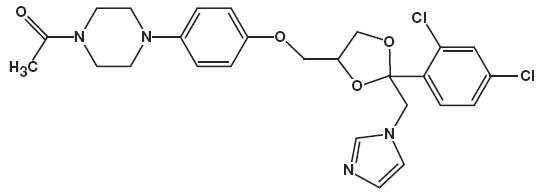
La mousse de kétoconazole, 2% contient 20 mg de kétoconazole par gramme dans un véhicule mousse hydroéthanolique thermolabile constitué d’alcool cétylique, d’acide citrique, d’éthanol (dénaturé avec de l’alcool tert-butylique et du sulfate de brucine) à 58%, de polysorbate 60, de citrate de potassium, de propylène glycol, d’eau purifiée et d’alcool stéarylique sous pression avec un propulseur hydrocarboné (propane / butane).
Mousse de kétoconazole – Pharmacologie clinique
Mécanisme d’action
Le mécanisme d’action du kétoconazole dans le traitement de la dermatite séborrhéique n’est pas connu.
Pharmacodynamique
La pharmacodynamique de la mousse de kétoconazole, 2% n’a pas été établie.
Pharmacocinétique
Dans une étude de biodisponibilité, 12 sujets atteints de dermatite séborrhéique modérée à sévère ont appliqué 3 g de mousse de kétoconazole, 2% deux fois par jour pendant 4 semaines. Les taux plasmatiques circulants de kétoconazole étaient < 6 ng / mL pour la majorité des sujets (75%), avec un taux maximum de 11 ng /mL observé chez un sujet.
Microbiologie
Le kétoconazole est un agent antifongique qui inhibe la synthèse in vitro de l’ergostérol, un stérol clé dans la membrane cellulaire de Malassezia furfur. La signification clinique de l’activité antifongique dans le traitement de la dermatite séborrhéique n’est pas connue.
Toxicologie non clinique
Carcinogenèse, Mutagénèse, Altération de la fertilité
Aucune étude à long terme chez l’animal n’a été réalisée pour évaluer le potentiel cancérigène ou photo-cancérigène de la mousse de kétoconazole, 2%.
Dans les études de cancérogénicité par voie orale chez la souris (18 mois) et le rat (24 mois) à des doses de 5, 20 et 80 mg /kg/jour, le kétoconazole n’était pas cancérogène. La dose élevée dans ces études était d’environ 2,4 à 4,8 fois la DMRH sur la base des comparaisons de BSA. Dans un essai de mutation inverse bactérienne, le kétoconazole n’a exprimé aucun potentiel mutagène. Dans trois essais in vivo (échange de chromatides sœurs chez l’homme, tests létaux dominants et micronoyaux chez la souris), le kétoconazole n’a présenté aucun potentiel génotoxique.
Dans les études sur la fertilité animale, le kétoconazole oral a altéré la fertilité masculine et féminine chez le rat de manière dépendante de la dose et de la durée. Chez les femelles, des doses orales allant jusqu’à 40 mg / kg (2,4 fois la DMRH sur la base des comparaisons de BSA) n’ont eu aucun effet sur la fertilité, tandis que des doses de 75 mg / kg (4,5 fois la DMRH sur la base des comparaisons de BSA) et plus élevées ont diminué le taux de grossesse et le nombre de sites d’implantation. Chez les rats mâles, l’administration orale de 200 mg / kg / jour (12 fois la DMRH sur la base des comparaisons BSA) pendant trois jours a diminué la fertilité et de 400 mg / kg / jour (24 fois la DMRH sur la base des comparaisons BSA) pendant trois jours a entraîné une perte complète de fertilité. Lorsqu’il est administré pendant des durées plus longues (jusqu’à 3 mois), une diminution de la fertilité chez les rats mâles a été observée à des doses aussi faibles que 24 mg / kg / jour (1,4 fois la DMRH basée sur des comparaisons BSA). Chez les chiens beagles mâles, une dose orale de 25 mg / kg / jour de kétoconazole jusqu’à 4 semaines (5.2 fois la DMRH basée sur des comparaisons BSA) ont entraîné une diminution de la motilité des spermatozoïdes, une diminution du nombre de spermatozoïdes, une augmentation des spermatozoïdes anormaux et une atrophie des testicules. Ces effets ont été inversés après l’arrêt du traitement.
Études cliniques
L’innocuité et l’efficacité de la mousse de kétoconazole, 2% ont été évaluées dans un essai randomisé, en double aveugle, contrôlé par un véhicule chez des sujets de 12 ans et plus atteints de dermatite séborrhéique légère à sévère. Dans l’essai, 427 sujets ont reçu de la mousse de kétoconazole, 2% et 420 sujets ont reçu de la mousse de véhicule. Les sujets ont appliqué de la mousse de kétoconazole, 2% ou de la mousse de véhicule deux fois par jour pendant 4 semaines sur les zones touchées du visage, du cuir chevelu et / ou de la poitrine. La gravité globale de la maladie en termes d’érythème, de mise à l’échelle et d’induration a été évaluée au départ et à la semaine 4 sur une échelle d’Évaluation globale statique (ISGA) de l’Investigateur en 5 points.
Le succès du traitement a été défini comme l’atteinte d’un score ISGA de la semaine 4 (fin du traitement) de 0 (clair) ou de 1 (la majorité des lésions ont des scores individuels pour l’écaillage, l’érythème et l’induration qui sont en moyenne de 1) et au moins deux niveaux d’amélioration par rapport à l’inclusion. Les résultats sont présentés dans le tableau 2. La base de données n’était pas assez grande pour évaluer s’il y avait des différences d’effets dans les sous-groupes d’âge, de sexe ou de race.
Tableau 2: Résultats D’Efficacité
|
Nombre de Sujets |
Mousse de kétoconazole, 2% N = 427 n (%) |
Mousse de véhicule N = 420 n (%) |
|
Sujets Atteignant Le Succès du Traitement |
239 (56%) |
176 (42%) |
Comment Fourni / Stockage et manipulation
Mousse de kétoconazole, 2% contient 20 mg de kétoconazole, USP par gramme. La mousse hydroéthanolique thermolabile est disponible comme suit:
NDC 45802-532-32
Boîte en aluminium de 50 g
NDC 45802-532-33
Boîte en aluminium de 100 g
Conserver à 20 ° à 25 °C ( 68 ° à 77 °F). .
Ne pas conserver au réfrigérateur.
Le contenu est inflammable. Ne pas exposer les contenants à la chaleur et/ou les conserver à des températures supérieures à 49 °C (120 °F). Ne pas stocker en plein soleil.
Contenu sous pression. Ne pas perforer et /ou incinérer le récipient.
Tenir hors de portée des enfants.
Information sur le conseil du patient
Voir l’étiquetage du patient approuvé par la FDA (Notice du patient).
Instruire les patients sur une utilisation appropriée de la mousse de kétoconazole, 2%.
• Éviter le feu, la flamme et /ou le tabagisme pendant et immédiatement après l’application. * N’appliquez pas de mousse de kétoconazole à 2% directement sur les mains. Répartir sur une surface fraîche et appliquer sur les zones touchées du bout des doigts. * Lavez-vous les mains après l’application * La mousse de kétoconazole, 2% peut provoquer une irritation de la peau (brûlure au site d’application et / ou réactions) • Demandez au patient de contacter un fournisseur de soins de santé si la zone d’application présente des signes d’irritation accrue et signalez tout signe d’effets indésirables.
Fabriqué en Israël
Fabriqué Par Perrigo
Yeruham, Israël
Distribué Par
Perrigo®
Allegan, MI 49010
www.perrigo.com
Rev 08-18
5K200RCJ3
Mode d’emploi
Mousse de kétoconazole, 2%
Informations importantes: La mousse de Kétoconazole, 2% doit être utilisée uniquement sur la peau. N’utilisez pas de mousse de kétoconazole, à 2% dans les yeux, la bouche ou le vagin.
Étape 1: Retirez le capuchon transparent de la mousse de kétoconazole, bidon à 2%.
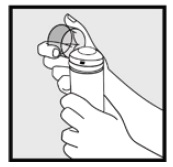
Étape 2: Tenez la boîte en position verticale et appuyez fermement sur la buse pour distribuer de la mousse de kétoconazole à 2% dans le capuchon transparent. * Distribuer suffisamment de mousse de kétoconazole, 2% pour couvrir toute la ou les zones touchées.
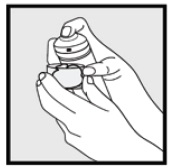
• Si la boîte semble chaude ou que la mousse semble liquide, faites passer la boîte sous l’eau froide.
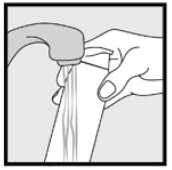
Étape 3: Ramassez de petites quantités de mousse de kétoconazole à 2% du bout des doigts et frottez doucement la mousse dans la ou les zones touchées jusqu’à ce que la mousse disparaisse.
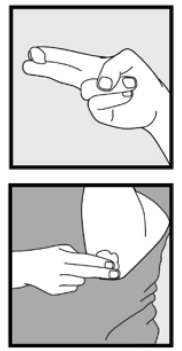
• Si vous traitez des zones telles que votre cuir chevelu, séparez les cheveux de sorte que la mousse de kétoconazole, 2%, puisse être appliquée directement sur la peau.

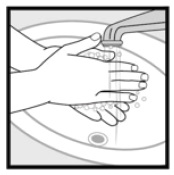
Étape 4: Lavez-vous les mains après l’application de la mousse de kétoconazole, 2%. * Jetez tout médicament inutilisé qui reste dans le capuchon.
Comment conserver la Mousse de Kétoconazole, 2%?
• Conserver la mousse de kétoconazole à 2 % à la température ambiante entre 20 °C et 25 °C (68 °F à 77 °F). * Ne conservez pas la mousse de kétoconazole, bidon de 2% au réfrigérateur ou au congélateur. * Conserver la mousse de kétoconazole à 2 % de la chaleur. Ne jetez jamais la boîte dans un feu, même si elle est vide. * Ne pas conserver la mousse de kétoconazole à 2 % à des températures supérieures à 49 °C (120 °F). * Ne pas percer (perforer) la mousse de kétoconazole, 2% peut.
Gardez la mousse de kétoconazole, 2% et tous les médicaments hors de la portée des enfants.
Ce mode d’emploi a été approuvé par la Food and Drug Administration des États-Unis.
Rx Uniquement
Fabriqué en Israël
Fabriqué Par Perrigo
Yeruham, Israël
Distribué Par
Perrigo®
Allegan, MI 49010
www.perrigo.com
Rev 08-18
INFORMATION POUR LE PATIENT
Mousse de kétoconazole, 2%
Informations importantes: La mousse de kétoconazole, 2% doit être utilisée uniquement sur la peau. N’utilisez pas de mousse de kétoconazole, à 2% dans les yeux, la bouche ou le vagin.
Qu’est-ce que la mousse de kétoconazole, 2%?
La mousse de kétoconazole, 2% est un médicament sur ordonnance utilisé sur la peau (topique) pour traiter la dermatite séborrhéique chez les personnes de 12 ans et plus ayant un système immunitaire normal.
On ne sait pas si la mousse de kétoconazole, 2%, est sûre et efficace lorsqu’elle est utilisée pour traiter les infections fongiques.
On ne sait pas si la mousse de kétoconazole, 2%, est sûre et efficace chez les enfants de moins de 12 ans.
Avant d’utiliser la mousse de kétoconazole, 2%, informez votre professionnel de la santé de toutes vos conditions médicales, y compris si vous:
• êtes enceinte ou prévoyez de le devenir. On ne sait pas si la mousse de kétoconazole, 2% nuira à votre bébé à naître. * allaitez ou prévoyez d’allaiter. On ne sait pas si la mousse de kétoconazole, 2% passe dans votre lait maternel. Parlez à votre fournisseur de soins de santé de la meilleure façon de nourrir votre bébé pendant le traitement avec de la mousse de kétoconazole, 2%.
Informez votre professionnel de la santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes.
Comment dois-je utiliser la Mousse de kétoconazole, 2%?
• Utilisez de la mousse de kétoconazole à 2% exactement comme votre professionnel de la santé vous l’a dit. Voir les « Instructions d’utilisation » détaillées à la fin de cette notice pour savoir comment appliquer la mousse de kétoconazole, 2% de la bonne façon. * Appliquez de la mousse de kétoconazole à 2% sur la ou les zones cutanées touchées 2 fois par jour pendant 4 semaines. Vous devez appliquer suffisamment de mousse de kétoconazole, soit 2%, pour couvrir toute la ou les zones touchées. * Parlez à votre professionnel de la santé si votre peau ne s’améliore pas après 4 semaines de traitement avec de la mousse de kétoconazole, 2%. * Distribuer la mousse de kétoconazole à 2% directement dans le capuchon. Ne distribuez pas de mousse de kétoconazole à 2% directement sur vos mains, car la mousse commencera à fondre au contact de la peau chaude. * Lavez-vous les mains après l’application de la mousse de kétoconazole, 2%.
Que dois-je éviter lors de l’utilisation de la Mousse de kétoconazole, 2%?
• Mousse de kétoconazole, 2% est inflammable. Évitez le feu, les flammes ou le tabagisme pendant et juste après l’application de la mousse de kétoconazole, 2% sur votre peau. * Évitez de recevoir de la mousse de kétoconazole à 2% dans ou près de vos yeux, de votre bouche, de vos lèvres ou de votre vagin. Si vous recevez de la mousse de kétoconazole, 2% sur vos lèvres ou dans vos yeux, votre bouche ou votre vagin, rincez bien à l’eau.
Quels sont les effets secondaires possibles de la mousse de kétoconazole, 2%?
La mousse de kétoconazole, 2% peut provoquer des effets indésirables graves, notamment :
• Irritation cutanée au niveau de la ou des zones d’application, y compris les réactions cutanées causées par l’exposition à la lumière. Informez votre professionnel de la santé si vous développez une irritation de la peau pendant le traitement avec de la mousse de kétoconazole, 2%.
Les effets secondaires les plus courants de la mousse de kétoconazole, 2% comprennent des brûlures, une sécheresse, une rougeur, une irritation, un engourdissement, des démangeaisons, des éruptions cutanées et de la chaleur au site d’application.
Ce ne sont pas tous les effets secondaires possibles de la mousse de kétoconazole, 2%.
Appelez votre médecin pour obtenir un avis médical sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment conserver la Mousse de kétoconazole, 2%?
• Conserver la mousse de kétoconazole à 2 % à la température ambiante entre 20 °C et 25 °C (68 °F à 77 °F). * Ne conservez pas la mousse de kétoconazole, bidon de 2% au réfrigérateur ou au congélateur. * Conserver la mousse de kétoconazole à 2 % de la chaleur. Ne jetez jamais la mousse de kétoconazole, boîte de 2% dans un feu, même si la boîte est vide. * Ne pas conserver la mousse de kétoconazole à 2 % à des températures supérieures à 49 °C (120 °F). * Ne pas percer (perforer) la mousse de kétoconazole, 2% peut. Gardez la mousse de kétoconazole, 2% et tous les médicaments hors de la portée des enfants.
Informations générales sur l’utilisation sûre et efficace de la mousse de kétoconazole, 2%.
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans une notice d’information pour le patient. N’utilisez pas de mousse de kétoconazole, à 2% pour une affection pour laquelle elle n’a pas été prescrite. Ne donnez pas de mousse de kétoconazole, 2% à d’autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire. Vous pouvez demander à votre pharmacien ou à votre professionnel de la santé des informations sur la mousse de kétoconazole, 2% qui est écrite pour les professionnels de la santé.
Quels sont les ingrédients de la mousse de kétoconazole, 2%?
Ingrédient actif: kétoconazole
Ingrédients inactifs: alcool cétylique, acide citrique, éthanol (dénaturé avec de l’alcool tert-butylique et du sulfate de brucine) à 58%, polysorbate 60, citrate de potassium, propylène glycol, eau purifiée et alcool stéarylique sous pression avec un propulseur hydrocarboné (propane/butane)
Pour plus d’informations, appelez Perrigo au 1-866-634-9120
Cette notice d’information pour le patient a été approuvée par le Food and Drug Administration des États-Unis.
EMBALLAGE / ÉTIQUETTE PANNEAU D’AFFICHAGE PRINCIPAL – CARTON
Rx Uniquement
Mousse De Kétoconazole, 2%
Pour Usage topique Uniquement.
Ne Doit Pas Être utilisé par voie ophtalmique, orale ou Intravaginale.
100 g

L’image suivante est un espace réservé représentant l’identificateur du produit qui est apposé ou imprimé sur l’étiquette de l’emballage du médicament pendant l’opération d’emballage.

| KÉTOCONAZOLE aérosol de kétoconazole, mousse |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
Étiqueteuse – Perrigo New York Inc (078846912)
En savoir plus sur le kétoconazole topique)
- Effets secondaires
- Pendant la grossesse ou l’allaitement
- Informations posologiques
- Comparer les alternatives
- Prix & Coupons
- Espagnol
- 36 Avis
- Classe de médicament: topical antifungals
Consumer resources
- Patient Information
- Ketoconazole Topical (Advanced Reading)
Professional resources
- Prescribing Information
- Ketoconazole (Topical) (Professional Patient Advice)
- Ketoconazole Cream (FDA)
- Ketoconazole Shampoo (FDA)
Other brands Nizoral Shampoo, Ketodan, Extina, Xolegel
Related treatment guides
- Seborrheic Dermatitis
- Cutaneous Candidiasis
- Androgenetic Alopecia
- Dandruff
- … + 4 plus
Avertissement médical