Nom générique: polystyrène sulfonate de sodium
Forme posologique: poudre rectale orale
Revue médicale par Drugs.com . Dernière mise à jour le 21 septembre 2020.
- Aperçu
- Effets secondaires
- Posologie
- Professionnel
- Interactions
- Plus
- Poudre de Kalexate Description
- Poudre de Kalexate – Pharmacologie clinique
- Indications et utilisation pour la poudre de Kalexate
- Contre-indications
- Mises en garde
- Précautions
- Interactions médicamenteuses
- Mères allaitantes
- Utilisation pédiatrique
- Effets indésirables
- Surdosage
- Dosage et administration de la poudre de Kalexate
- Comment la poudre de Kalexate est-elle fournie
- ÉTIQUETTE DE L’EMBALLAGE.PANNEAU D’AFFICHAGE PRINCIPAL
- En savoir plus sur le Kalexate (polystyrène sulfonate de sodium)
- Ressources pour les consommateurs
- Ressources professionnelles
- Guides de traitement connexes
Poudre de Kalexate Description
Polystyrène Sulfonate de sodium, L’USP, est un polymère de benzène diéthényle, avec un sel de sodium sulfoné d’éthénylbenzène et a la formule structurale suivante:
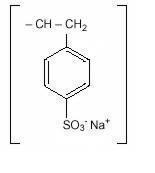
Le médicament est une crème à brun clair finement broyée, sous forme de poudre de polystyrène sulfonate de sodium, une résine échangeuse de cations préparée dans la phase sodique avec une capacité d’échange in vitro d’environ 3.1 mEq (in vivo environ 1 mEq) de potassium par gramme. La teneur en sodium est d’environ 100 mg (4,1 mEq) par gramme de médicament. Il peut être administré par voie orale ou en lavement.
Poudre de Kalexate – Pharmacologie clinique
Lorsque la résine passe le long de l’intestin ou est retenue dans le côlon après administration par lavement, les ions sodium sont partiellement libérés et sont remplacés par des ions potassium. Pour la plupart, cette action se produit dans le gros intestin, qui excrète les ions potassium à un degré supérieur à celui de l’intestin grêle. L’efficacité de ce processus est limitée et variable de manière imprévisible. Il se rapproche généralement de l’ordre de 33%, mais la plage est si grande que les indices définitifs de l’équilibre électrolytique doivent être clairement surveillés.
Les données métaboliques ne sont pas disponibles.
Indications et utilisation pour la poudre de Kalexate
Sulfonate de polystyrène sodique, USP est indiqué pour le traitement de l’hyperkaliémie.
Contre-indications
Le polystyrène sulfonate de sodium, USP est contre-indiqué dans les conditions suivantes: patients présentant une hypokaliémie, des antécédents d’hypersensibilité aux résines de polystyrène sulfonate, une maladie obstructive de l’intestin, des nouveau-nés présentant une motilité intestinale réduite (postopératoire ou induite par un médicament) et une administration orale chez les nouveau-nés (voir PRÉCAUTIONS).
Mises en garde
Nécrose intestinale: Des cas de nécrose intestinale pouvant être fatale et d’autres événements indésirables gastro-intestinaux graves (saignements, colite ischémique, perforation) ont été rapportés en association avec le polystyrène Sulfonate de sodium, utilisation USP. La majorité de ces cas ont signalé l’utilisation concomitante de sorbitol. Des facteurs de risque d’effets indésirables gastro-intestinaux étaient présents dans de nombreux cas, notamment la prématurité, des antécédents de maladie ou d’intervention chirurgicale intestinale, une hypovolémie et une insuffisance et une insuffisance rénales. L’administration concomitante de sorbitol n’est pas recommandée (voir PRÉCAUTIONS, Interactions médicamenteuses).
• Utiliser uniquement chez les patients dont la fonction intestinale est normale. Évitez l’utilisation chez les patients qui n’ont pas eu de selles après la chirurgie.
• Évitez l’utilisation chez les patients à risque de constipation ou d’impaction (y compris ceux qui ont des antécédents d’impaction, de constipation chronique, de maladie inflammatoire de l’intestin, de colite ischémique, d’athérosclérose intestinale vasculaire, de résection intestinale antérieure ou d’obstruction intestinale).
• Cesser l’utilisation chez les patients souffrant de constipation.
Traitement alternatif dans l’Hyperkaliémie sévère
Étant donné qu’une diminution efficace de la kaliémie avec du Polystyrène Sulfonate de sodium, l’USP peut prendre des heures à des jours, le traitement par ce médicament seul peut être insuffisant pour corriger rapidement l’hyperkaliémie sévère associée à des états de dégradation rapide des tissus (par exemple, brûlures et insuffisance rénale) ou une hyperkaliémie marquée de manière à constituer une urgence médicale. Par conséquent, d’autres mesures définitives, y compris la dialyse, doivent toujours être envisagées et peuvent être impératives.
Hypokaliémie
Une carence grave en potassium peut survenir à la suite d’un traitement au polystyrène sulfonate de sodium, USP. L’effet doit être soigneusement contrôlé par des déterminations fréquentes du potassium sérique dans chaque période de 24 heures. Étant donné que la carence en potassium intracellulaire n’est pas toujours reflétée par les taux de potassium sérique, le niveau auquel le traitement par Polystyrène sulfonate de sodium, USP doit être arrêté doit être déterminé individuellement pour chaque patient. L’état clinique et l’électrocardiogramme du patient sont des aides importantes à cette détermination. Les premiers signes cliniques d’hypokaliémie sévère comprennent un schéma de confusion irritable et des processus de pensée retardés.
Sur le plan électrocardiographique, une hypokaliémie sévère est souvent associée à un intervalle Q-T allongé, à un élargissement, à un aplatissement ou à une inversion de l’onde T et à des ondes U proéminentes. En outre, des arythmies cardiaques peuvent survenir, telles que des contractions auriculaires, nodales et ventriculaires prématurées et des tachycardies supraventriculaires et ventriculaires. Les effets toxiques de la digitale sont susceptibles d’être exagérés. Une hypokaliémie marquée peut également se manifester par une faiblesse musculaire sévère, s’étendant parfois jusqu’à une paralysie franche.
Perturbations électrolytiques
Comme toutes les résines échangeuses de cations, le polystyrène Sulfonate de sodium, l’USP n’est pas totalement sélective (pour le potassium) dans ses actions, et de petites quantités d’autres cations tels que le magnésium et le calcium peuvent également être perdues pendant le traitement. En conséquence, les patients recevant du polystyrène sulfonate de sodium, USP doivent être surveillés pour toutes les perturbations électrolytiques applicables.
Alcalose systémique
Une alcalose systémique a été rapportée après administration orale de résines échangeuses de cations en association avec des antiacides et des laxatifs non absorbables donnant des cations tels que l’hydroxyde de magnésium et le carbonate d’aluminium. L’hydroxyde de magnésium ne doit pas être administré avec du polystyrène Sulfonate de sodium, USP. Un cas de crise de grand mal a été rapporté chez un patient présentant une hypocalcémie chronique d’insuffisance rénale à qui on a administré du polystyrène sulfonate de sodium, USP avec de l’hydroxyde de magnésium comme laxatif. (Voir PRÉCAUTIONS, Interactions médicamenteuses.)
Précautions
La prudence est recommandée lorsque le polystyrène sulfonate de sodium USP est administré à des patients qui ne tolèrent même pas une légère augmentation de la charge en sodium (c.-à-d. insuffisance cardiaque congestive sévère, hypertension sévère ou œdème marqué). Dans de tels cas, une restriction compensatoire de l’apport en sodium provenant d’autres sources peut être indiquée.
En cas de constipation cliniquement significative, le traitement au Polystyrène Sulfonate de sodium, USP doit être interrompu jusqu’à la reprise des mouvements intestinaux normaux (voir MISES en GARDE, Nécrose intestinale).
Interactions médicamenteuses
Antiacides
L’administration orale simultanée de Polystyrène Sulfonate de sodium, USP avec des antiacides et des laxatifs non absorbables donnant des cations peut réduire la capacité d’échange de potassium de la résine.
Des antiacides et des laxatifs non absorbables donnant des cations
Une alcalose systémique a été rapportée après l’administration orale de résines échangeuses de cations en association avec des antiacides et des laxatifs non absorbables donnant des cations tels que l’hydroxyde de magnésium et le carbonate d’aluminium. L’hydroxyde de magnésium ne doit pas être administré avec du polystyrène Sulfonate de sodium, USP. Un cas de crise de grand mal a été rapporté chez un patient présentant une hypocalcémie chronique d’insuffisance rénale à qui on a administré du polystyrène sulfonate de sodium, USP avec de l’hydroxyde de magnésium comme laxatif.
Obstruction intestinale due à des concrétions d’hydroxyde d’aluminium lorsqu’elle est utilisée en association avec du polystyrène Sulfonate de sodium, l’USP a été rapportée.
Digitale
Les effets toxiques de la digitale sur le cœur, en particulier diverses arythmies ventriculaires et dissociation nodale A-V, sont susceptibles d’être exagérés par l’hypokaliémie, même face à des concentrations sériques de digoxine dans la « plage normale ». (Voir AVERTISSEMENTS).
Sorbitol
L’utilisation concomitante de Sorbitol avec du Polystyrène Sulfonate de sodium, USP a été impliquée dans des cas de nécrose intestinale, pouvant être fatale. Par conséquent, l’administration concomitante n’est pas recommandée. (Voir AVERTISSEMENTS).
Lithium
Polystyrène sulfonate de sodium, USP peut diminuer l’absorption du lithium.
Thyroxine
Polystyrène sulfonate de sodium, USP peut diminuer l’absorption de la thyroxine.
Carcinogenèse, Mutagénèse, Altération de la fertilité
Aucune étude n’a été réalisée.
Grossesse Catégorie C
Aucune étude de reproduction animale n’a été menée avec du Polystyrène Sulfonate de sodium, USP. On ne sait pas non plus si le polystyrène sulfonate de sodium, l’USP peut causer des dommages fœtaux lorsqu’il est administré à une femme enceinte ou peut affecter la capacité de reproduction. Le polystyrène sulfonate de sodium, USP ne doit être administré à une femme enceinte que si cela est clairement nécessaire.
Mères allaitantes
On ne sait pas si ce médicament est excrété dans le lait maternel. Étant donné que de nombreux médicaments sont excrétés dans le lait maternel, il convient de faire preuve de prudence lorsque le polystyrène sulfonate de sodium, USP, est administré à une femme qui allaite.
Utilisation pédiatrique
L’efficacité du polystyrène sulfonate de sodium, USP chez les patients pédiatriques n’a pas été établie. Chez les nouveau-nés, le polystyrène sulfonate de sodium, USP ne doit pas être administré par voie orale. Chez les enfants et les nouveau-nés, une attention particulière doit être observée lors de l’administration rectale, car une dose excessive ou une dilution inadéquate pourrait entraîner une impaction de la résine.
En raison du risque d’hémorragie digestive ou de nécrose intestinale, une attention particulière doit être observée chez les prématurés ou les nourrissons de faible poids à la naissance.
Effets indésirables
Sulfonate de polystyrène sodique, USP peut provoquer une certaine irritation gastrique. L’anorexie, les nausées, les vomissements et la constipation peuvent survenir, surtout si des doses élevées sont administrées. En outre, une hypokaliémie, une hypocalcémie, une hypomagnésémie et une rétention de sodium significative, ainsi que leurs manifestations cliniques connexes, peuvent survenir (voir MISES en GARDE). Parfois, la diarrhée se développe. De fortes doses chez les personnes âgées peuvent provoquer une impaction fécale (voir PRÉCAUTIONS). De rares cas de nécrose intestinale ont été rapportés. Une occlusion intestinale due à des concrétions d’hydroxyde d’aluminium, lorsqu’il est utilisé en association avec du polystyrène sulfonate de sodium, USP, a été rapportée.
Les événements suivants ont été rapportés dans le monde entier après la commercialisation:
Surdosage
Le surdosage peut entraîner des troubles électrolytiques, notamment une hypokaliémie, une hypocalcémie et une hypomagnésémie.Les perturbations biochimiques résultant d’un surdosage peuvent donner lieu à des signes et symptômes cliniques d’hypokaliémie, notamment: irritabilité, confusion, processus de pensée retardés, faiblesse musculaire, hyporéflexie, pouvant évoluer vers une paralysie franche et / ou une apnée. Une tétanie peut survenir. Des modifications électrocardiographiques peuvent être compatibles avec une hypokaliémie ou une hypercalcémie; des arythmies cardiaques peuvent survenir. Des mesures appropriées doivent être prises pour corriger les électrolytes sériques (potassium, calcium, magnésium) et la résine doit être retirée des voies alimentaires par l’utilisation appropriée de laxatifs ou de lavements.
Dosage et administration de la poudre de Kalexate
La suspension de ce médicament doit être fraîchement préparée et ne pas être conservée au-delà de 24 heures.
La dose quotidienne moyenne de résine chez l’adulte est de 15 g à 60 g. Ceci est mieux fourni en administrant 15 g (environ 4 cuillères à café de niveau) de polystyrène sulfonate de sodium, USP une à quatre fois par jour. Un gramme de Polystyrène Sulfonate de sodium, USP contient 4,1 mEq de sodium; une cuillère à café de niveau contient environ 3,5 g de Polystyrène Sulfonate de sodium, USP et 15 mEq de sodium. (Une cuillère à café en tas peut contenir jusqu’à 10 g à 12 g de polystyrène sulfonate de sodium, USP.) Étant donné que l’efficacité in vivo des résines échangeuses de sodium et de potassium est d’environ 33%, environ un tiers de la teneur réelle en sodium de la résine est délivrée à l’organisme.
Chez les petits enfants et les nourrissons, des doses plus faibles doivent être utilisées en utilisant comme guide un taux de 1 mEq de potassium par gramme de résine comme base de calcul.
Chaque dose doit être administrée sous forme de suspension dans une petite quantité d’eau ou, pour une plus grande appétence, dans du sirop. La quantité de liquide varie généralement de 20 mL à 100 mL, selon la dose, ou peut être simplement déterminée en autorisant 3 mL à 4 mL par gramme de résine. Les professionnels de la santé doivent suivre toutes les précautions d’aspiration lors de l’administration de ce produit, telles que placer et maintenir le patient en position verticale pendant l’administration de la résine.
La résine peut être introduite dans l’estomac à travers un tube en plastique et, si désiré, mélangée à un régime alimentaire approprié pour un patient en insuffisance rénale.
La résine peut également être administrée, bien qu’avec des résultats moins efficaces, dans un lavement constitué (pour les adultes) de 30 g à 50 g toutes les six heures. Chaque dose est administrée sous forme d’émulsion chaude (à température corporelle) dans 100 mL de véhicule aqueux. L’émulsion doit être agitée doucement pendant l’administration. Le lavement doit être conservé le plus longtemps possible et suivi d’un lavement nettoyant.
Après un lavement nettoyant initial, un tube en caoutchouc souple de grande taille (français 28) est inséré dans le rectum sur une distance d’environ 20 cm, avec la pointe bien dans le côlon sigmoïde, et scotché en place. La résine est ensuite mise en suspension dans la quantité appropriée de véhicule aqueux à température corporelle et introduite par gravité, tandis que les particules sont maintenues en suspension par agitation. La suspension est rincée avec 50 mL ou 100 mL de fluide, après quoi le tube est serré et laissé en place. En cas de fuite du dos, les hanches sont surélevées sur les oreillers ou une position genou-poitrine est prise temporairement. Une suspension un peu plus épaisse peut être utilisée, mais il faut veiller à ce qu’aucune pâte ne se forme, car cette dernière a une surface d’échange très réduite et sera particulièrement inefficace si elle est déposée dans l’ampoule rectale. La suspension est conservée dans le côlon sigmoïde pendant plusieurs heures, si possible. Ensuite, le côlon est irrigué avec une solution contenant du non-sodium à température corporelle afin d’éliminer la résine. Deux litres de solution de rinçage peuvent être nécessaires. Les retours sont drainés en permanence par une connexion de tube en Y. Bien que l’utilisation de sorbitol ne soit pas recommandée, une attention particulière doit être portée à ce lavement nettoyant si du sorbitol a été utilisé
L’intensité et la durée du traitement dépendent de la gravité et de la résistance de l’hyperkaliémie.
Le sulfonate de polystyrène de sodium, USP ne doit pas être chauffé car cela peut altérer les propriétés d’échange de la résine.
Comment la poudre de Kalexate est-elle fournie
Sulfonate de polystyrène de sodium, USP est disponible sous forme de poudre crème à brun clair finement broyée dans des pots de 454 g (1 livre),
NDC 10702-036-45.
Conserver à une température de 20 à 25 °C (68 à 77 °F) avec des excursions permises entre 15 et 30 °C (59 à 86 °F).
Rx Seulement
Fabriqué par:
KVK-TECH INC.
110 Terry Drive
Newtown, PA 18940 États-Unis.
Numéro D’article 006067/04
Code fabricant: 10702 10/13
ÉTIQUETTE DE L’EMBALLAGE.PANNEAU D’AFFICHAGE PRINCIPAL
454 g Étiquette DU pot
NDC 10702-036-45
POLYSTYRÈNE SULFONATE DE SODIUM, USP
RÉSINE ÉCHANGEUSE DE CATIONS
454 g
Rx Uniquement
Dose moyenne chez l’adulte: 15 g (environ 4 cuillères à café de niveau) une à quatre fois par jour dans l’eau. Voir les renseignements thérapeutiques complets.
L’effet doit être soigneusement contrôlé par des déterminations fréquentes de potassium sérique dans chaque période de 24 heures. Teneur en sodium d’environ 60 mEq par 15 g. La suspension
doit être fraîchement préparée et ne doit pas être conservée au-delà de 24 heures. Distribuer dans des récipients étanches et résistants à la lumière tels que définis dans les recueils officiels.
Conserver à une température de 20 à 25 °C (68 à 77 °F) avec des excursions permises entre 15 et 30 °C (59 à 86 °F).
KVK-TECH, INC.

| KALEXATE sodium polystyrene sulfonate powder |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Étiqueteuse – KVK-Tech, Inc. (173360061)
Accueil – KVK-Tech, Inc. (173360061)
| Établissement | |||
| Nom | Adresse | ID/FEI | Opérations |
| Accueil > Produits > KVK-Tech | 173360061 | FABRICATION(10702-036) | |
En savoir plus sur le Kalexate (polystyrène sulfonate de sodium)
- Effets secondaires
- Pendant la grossesse ou l’allaitement
- Informations posologiques
- Interactions médicamenteuses
- Prix & Coupons
- Espagnol
- Classe de médicament: Résines échangeuses de cations
- Alertes FDA (2)
Ressources pour les consommateurs
- Informations sur le patient
Ressources professionnelles
- Informations sur la prescription
- Poudre orale de Polystyrène Sulfonate de sodium (FDA)
Autres marques Kayexalate, Kionex
Guides de traitement connexes
- Hyperkaliémie
Avertissement médical