INTRODUCTION
Une tachycardie ectopique jonctionnelle aiguë (JET) peut apparaître après une intervention chirurgicale pour des malformations cardiaques congénitales. Bien qu’elle soit auto-limitante dans les 48-72 h, la mortalité en l’absence de traitement rapide est de 40%1 en raison de la fréquence cardiaque élevée (HR) et de la dissociation auriculo-ventriculaire (DAV). La mauvaise réponse au traitement pharmacologique a conduit à la recherche d’autres options de traitement, y compris une hypothermie modérée.2 Ce traitement, décrit pour la première fois en 19873, a été rarement rapporté dans la littérature, et tous les rapports concernent un faible nombre de patients.
PATIENTS ET MÉTHODE
Patients
Nous avons examiné les dossiers cliniques de patients opérés pour des malformations cardiaques congénitales entre septembre 1999 et octobre 2001 à l’Área Infantil del Corazón (Service Cardiaque Pédiatrique) du Complexe Hospitalier Juan Canalejo à A Coruña, dans le nord-ouest de l’Espagne. Des électrocardiogrammes standard ont été examinés, de même que des électrogrammes auriculaires enregistrés lors d’épisodes d’arythmie avec les électrodes auriculaires placées pendant la chirurgie ou avec des électrodes œsophagiennes. Seuls les patients avec un JET confirmé ou probable qui ont été traités avec une hypothermie ont été inclus dans cette étude.
Critères diagnostiques
– JET confirmé: a) tachycardie avec un complexe QRS similaire au traçage basal ou à un traçage obtenu par stimulation auriculaire, ainsi que b) AVD avec une vitesse auriculaire plus lente que la vitesse ventriculaire.
– JET probable: enregistré lorsque le critère 1 comme indiqué ci-dessus était satisfait mais qu’il n’était pas possible de démontrer une MAV, ou lorsqu’il y avait une conduction rétrograde 1: 1 et une arythmie ne répondait pas à une cardioversion électrique ou à une surstimulation auriculaire.
Traitement
Le traitement du JET était basé sur: a) des mesures de base (diminution de l’utilisation d’agents inotropes, sédation, correction du déséquilibre électrolytique); b) un stimulateur cardiaque (pour restaurer la synchronie auriculo-ventriculaire en établissant une HR plus rapide que celle causée par le JET); c) l’hypothermie et d) des médicaments antiarythmiques. La digoxine a été utilisée pour le soutien inotrope et diurétique chez certains patients.
L’hypothermie a commencé lorsque l’état hémodynamique s’est détérioré malgré les mesures de base, ou lorsqu’il n’était pas possible de maintenir un rythme cardiaque plus rapide que le débit du JET. Tous les patients ont été sédatifs et placés sous ventilation mécanique avec des myorelaxants. Des ventilateurs, des compresses froides placées sur la peau et un lavage avec une solution saline physiologique froide via une sonde nasogastrique ont été utilisés. La température a été abaissée jusqu’à ce que le débit du JET diminue, mais jamais en dessous de 33 ºC tel que mesuré avec un thermomètre rectal. Les patients ont été réarmés lentement (1 ºC / 8 h) après au moins 36 h de stabilité hémodynamique (pression veineuse centrale adéquate, pression artérielle et diurèse) en augmentant les sources de chaleur externes sous surveillance électrocardiographique constante. Chez les patients traités avec un stimulateur cardiaque, ce traitement a été interrompu lorsque le rythme sinusal normal est apparu ou lorsque le débit du JET a diminué en dessous du 75e centile de normalité selon l’âge.
Analyse statistique
Les variables quantitatives sont exprimées en moyenne± écart-type, et la médiane est également indiquée pour les variables dont la distribution était nettement asymétrique. Les variables catégorielles sont exprimées en valeurs absolues (pourcentages). Les variations des valeurs hémodynamiques obtenues à 1, 2, 4, 8, 12 et 24 h du début de l’hypothermie ont été analysées avec MANOVA pour des tendances linéaires pour des mesures répétées; la distribution normale des données a été vérifiée au préalable avec le test de Shapiro-Wilks. Les différences ont été considérées comme significatives aux RÉSULTATS P
Un total de 138 patients ont subi une chirurgie cardiaque pédiatrique avec pontage cardiopulmonaire; 21 (15,2%) ont développé un JET confirmé ou probable, et une hypothermie a été utilisée chez 12 patients analysés ici (9 filles, âge moyen 2,1 ±2,0 mois) (tableau 1). Le début du JET a été enregistré 6,3±11,9 h après l’opération (médiane, 2 h). À ce moment, la température était de 37,0 ±0,7 °C (tableau 2). L’hypothermie a commencé 1,5 ±0,5 h après le début du JET (médiane, 1,0 h) et a duré 74 ±42 h (plage, 36-144 h). Pendant l’hypothermie, la digoxine a été utilisée chez 6 patients, et chez 4 de ces patients, l’amiodarone a également été administrée pour le soutien pendant l’hypothermie. Un stimulateur cardiaque a été utilisé chez 10 patients: chez 9, des électrodes épicardiques ont été placées dans la salle d’opération et chez 1, une électrode œsophagienne a été utilisée.
Les changements de température centrale et d’état hémodynamique au cours des 24 premières heures sont illustrés à la figure 1. Les plus grandes améliorations ont été obtenues au cours des 4 premières heures d’hypothermie, après quoi les patients sont restés stables.
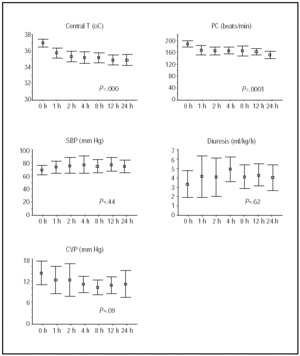
Fig. 1. Cours pendant les 24 premières heures d’hypothermie. Les lignes illustrent les moyennes et les intervalles de confiance à 95%. Les valeurs P se réfèrent aux tests de tendances linéaires de MANOVA pour les mesures répétées. HR indique la fréquence cardiaque; battements / min, battements par minute; T, température; SBP, pression artérielle systolique; CVP, pression veineuse centrale.
Tous les patients sauf un ont survécu. Le nourrisson décédé avait un faible taux de production secondaire au JET, qui était réfractaire au traitement. Il n’y a pas eu de complications directement attribuables à l’hypothermie. Au moment du réchauffement, 5 patients continuaient d’avoir un JET; un a nécessité un refroidissement à nouveau en raison d’une augmentation significative de l’HR. Le rythme sinusal prédominant est réapparu 65 ± 38 h après le début de l’hypothermie. Deux des 6 patients qui ont retrouvé un rythme sinusal normal pendant l’hypothermie ont nécessité un rafraîchissement car JET et rapid HR sont réapparus.
Les 11 patients qui ont reçu leur congé sont restés en vie et n’ont présenté aucune séquelle neurologique après une période de suivi moyenne de 15 ±12 mois (intervalle, 2-36 mois). Le rythme sinusal a été maintenu sans arythmie pendant le suivi.
DISCUSSION
Le JET postopératoire provient d’un foyer ectopique situé dans le tissu nodal ou le faisceau de His, et est induit par une irritation mécanique pendant la chirurgie.2 Sa nature ectopique le rend sensible à l’équilibre sympathique-vagal et résistant à la surstimulation auriculaire ou à la cardioversion électrique. La HR élevée et la MAV diminuent le débit cardiaque, ce qui accélère l’arythmie en raison de l’augmentation du tonus adrénergique, créant ainsi un cercle vicieux.1,2 Parce que le processus est auto-limitant dans les 48-72 h,2 l’objectif principal du traitement est le maintien d’un débit cardiaque approprié jusqu’à ce que l’arythmie disparaisse spontanément.
Le traitement doit comprendre1, 2,4, 5 correction du déséquilibre électrolytique et du déséquilibre acido-basique, élimination des stimuli adrénergiques (douleur, irritation, anxiété), sédation appropriée et diminution des niveaux d’agents inotropes et vasodilatateurs, qui accélèrent l’HR et le JET.2 La réponse aux antiarythmiques est médiocre, 2 et la digoxine n’est pas efficace.5 La propafénone semble avoir un certain bénéfice, 6 malgré le fait qu’il s’agit d’un agent inotrope négatif. L’amiodarone est utile7,8 bien que, selon notre expérience, elle puisse nécessiter une expansion volumique en raison de l’apparition d’une hypotension. Le procaïnamide n’est efficace en association avec l’hypothermie que lorsque l’hypothermie seule est insuffisante.5 Le rôle des bêta-bloquants est controversé,2 et les antagonistes du calcium ne sont pas recommandés. D’autres options de traitement sont différents modes de stimulation avec des stimulateurs cardiaques et une ablation rapide du faisceau de His dans les cas réfractaires.1,2
Un diagnostic précoce est fondamental. En cas de suspicion de JET, un électrocardiogramme à 12 fils et un électrogramme auriculaire doivent être effectués.9 Dans notre série de patients, l’électrographie auriculaire a permis de démasquer la MAV chez 2 patients et de confirmer la suspicion chez 6 patients chez lesquels l’électrocardiogramme de surface suggérait une MAV (Figure 2).
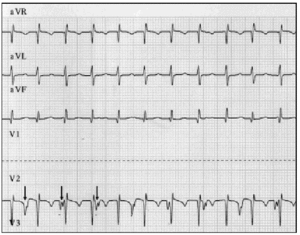
Fig. 2. Traçage électrocardiographique du JET, y compris les dérivations aVR, aVL et aVF. Le tracé inférieur montre l’électrogramme auriculaire et a été obtenu en connectant la sonde habituellement utilisée pour l’électrode V2 à l’électrode épicardique auriculaire. Ce traçage montre une activité auriculaire accrue (flèches); la dissociation auriculo-ventriculaire est évidente à partir de la vitesse auriculaire plus lente par rapport à la vitesse ventriculaire.
Le traitement par hypothermie est basé sur l’observation qu’une diminution de la température centrale réduit l’automaticité des cellules du stimulateur cardiaque. Depuis que le premier rapport de ce traitement a été publié par Bash et al., en 1987,3 des rapports épars sont apparus sur l’utilisation réussie de l’hypothermie chez un petit nombre de patients.9,10 Le but de ces interventions était d’atteindre une température centrale de 32-35 °C. Notre objectif était de réduire la RH jusqu’à ce qu’un traitement pacemaker approprié devienne possible, et d’éviter ainsi l’hypothermie profonde et ses éventuels effets secondaires. Chez 2 patients, les stimulateurs cardiaques n’ont pas été utilisés car les électrodes épicardiques auriculaires n’étaient pas disponibles. Compte tenu de leur bonne évolution clinique, nous avons décidé de ne pas utiliser d’électrode œsophagienne. En raison de notre conception d’étude, il n’a pas été possible de juger de l’utilité relative de la digoxine et de l’amiodarone administrées pendant l’hypothermie dans le contrôle de la RH.
Dans cette série de patients, l’hypothermie associée à l’utilisation d’un stimulateur cardiaque était une option efficace et sûre. Des changements hémodynamiques se sont produits en quelques heures et aucun effet secondaire directement attribuable à l’hypothermie n’a été observé. Bien que le petit nombre de patients que nous avons étudiés ne nous permette pas de généraliser, le taux de mortalité dans notre série de 8,3% était clairement inférieur au chiffre de 40% rapporté pour un traitement conservateur.1 Le nourrisson décédé était l’un des premiers patients de la série et présentait une tachycardie très rapide, ce qui pourrait expliquer l’échec de l’hypothermie.
Le réchauffement a commencé après au moins 36 h de stabilité hémodynamique sans attendre la récupération d’un rythme sinusal stable. La probabilité qu’un rafraîchissement soit nécessaire (27%) n’était pas liée au rythme sinusal ou au JET, et nous pensons donc que le réchauffement peut être chronométré sur la seule base de critères hémodynamiques.
Les limites de notre étude sont celles inhérentes à toute analyse rétrospective et observationnelle basée sur un petit nombre de patients sans groupe témoin. Néanmoins, nous pensons que nos résultats, ainsi que d’autres rapports publiés, soutiennent l’utilisation de l’hypothermie comme traitement efficace et sûr pour la gestion du JET postopératoire.