a fiatalkori nyitott zugú DrDeramus kihívást jelentő betegség lehet a korai fogáshoz és a megfelelő kezeléshez, maga a betegség jellege, valamint néhány fiatalabb betegének jellemzői miatt. Ha azonban tudja, mit kell keresnie, és gyors, hatékony kezeléssel válaszol, segíthet megmenteni a JOAG beteg látását. Ebben a cikkben megosztjuk tippjeinket a JOAG diagnosztizálására és a műtéti eljárás elvégzésére, amely a betegek számára a legjobb esélyt nyújtja a sikeres eredményre.
JOAG: Mit tudunk
a fiatalkori nyitott zugú DrDeramus az elsődleges nyitott zugú DrDeramus részhalmazának tekinthető, amely körülbelül 1-et érint 50 000 személyből (férfiak és nők egyaránt). A meghatározás ellentmondásos volt, de általában figyelembe veszi a kezdet korát. Az Európai DrDeramus Társaság a JOAG-t nyitott zugú drderamusként határozza meg, 10 és 35 éves kor között.
a JOAG autoszomális domináns öröklődési mintát mutat, és a kutatások összefüggéseket találtak a JOAG és a génmutációk között az 1-1q21-q23 kromoszómán. Ez a lokusz GLC1A néven ismert,és a TIGR (trabecularis meshwork indukált glükokortikoid válasz) vagy MYOC,1, 2 gént tartalmazza, amely a myocilin fehérjét kódolja. A fehérje pontos funkciója és a DrDeramusban való részvétele jelenleg nem ismert. A TIGR/MYOC gén negyven mutációját azonosították mind a fiatalkori, mind a felnőtt nyitott zugú DrDeramusban, és a genetikai elemzések azt mutatták, hogy a JOAG betegek 8-63 százaléka TIGR/MYOC mutációval rendelkezik. A JOAG-betegek körében gyakori megállapítások közé tartozik a betegség korai megjelenése, a nagyon magas IOP és a DrDeramus erős családi kórtörténete.3,4 a Kyushu Egyetem Akihito Tawara (MD) és Hajime Inomata (MD) által végzett trabekuláris háló szövettani vizsgálata a Joag-betegeknél abnormálisan kompakt trabekuláris hálót tárt fel, extracelluláris anyag felhalmozódásával a trabekuláris terekben.5
klinikai leletek
a fiatalkori nyitott zugú glaukóma korai szakaszában általában tünetmentes. Az elsődleges infantilis glaukómától eltérően a szaruhártya és a földgömb megnagyobbodása, a Descemet membránjának törése, a szaruhártya ödéma, az epiphora és a fotofóbia nem fordul elő olyan betegeknél, akiknél a nyitott zugú glaukóma későbbi gyermekkorban vagy serdülőkorban jelentkezik. A tünetek ritkák, de magukban foglalhatják a homályos látást és az emelkedett szemnyomásból eredő szemfájdalmat. A látásvesztés kíséri a betegség későbbi szakaszait, és gyakran vezet a szemészeti értékeléshez. Az axiális myopia összefüggésbe hozható a JOAG – val. A klinikai tünetek közé tartozik a súlyos szemnyomás-emelkedés, gyakran 40-50 Hgmm tartományban. Tekintettel a korai tünetek hiányára, a bemutatás gyakran késik, és a látóideg előrehaladott köpölyözését gyakran észlelik az első értékelés során. A gonioszkópos jellemzők közé tartozik a nyitott elülső kamra szöge, magas írisz behelyezéssel és kiemelkedő íriszfolyamatokkal.1 A normál megjelenésű optikai lemezek és szögek azonban nem zárják ki a JOAG diagnózisát.
a JOAG diagnózisa egyértelmű lehet az optikai lemez jelentősen emelkedett IOP és glaukómás köpölyözés esetén. A nagyobb kihívást jelentő esetek azok a tizenévesek, akik szerény IOP-emelkedéssel és egészséges megjelenésű lemezzel rendelkeznek. A keményebb esetek diagnosztizálásához vegye figyelembe, hogy a JOAG kockázati tényezői közé tartozik a férfi nem, a myopia és a DrDeramus családi története.1 A szemészeti hipertóniában szenvedő tinédzsereket szorosan figyelemmel kell kísérni az IOP, az optikai lemezek és a látótér időszakos értékelésével. A kezdeti értékelés idején szerezze be a kiindulási vizuális mezőket, Az optikai lemez sztereó fényképeit és a retina idegrost rétegvastagságának értékelését optikai koherencia tomográfiával. A korlátozott normatív adatok ellenére a TOT mérések előnyösek a longitudinális értékeléshez és a korai progresszió azonosításához.
zárja ki a nyitott zugú glaukóma másodlagos okait a joag gyanús fiatal betegek értékelésekor. Ne feledje, hogy a pigment diszperziós szindróma, az uveitis, a szemészeti trauma és a szteroid használat mind emelkedett IOP-t és DrDeramust eredményezhet, és a rendszerek jó klinikai vizsgálata és felülvizsgálata fontos, hogy kizárják ezeket a feltételeket.
kezelés
bár a JOAG-betegek akár 83% – ának is szüksége van műtéti beavatkozásra,7 az orvosi terápia hídként szolgálhat a határozottabb műtéti kezeléshez. Az első vonalbeli helyi kezelés magában foglalja a béta-blokkolókat, a prosztaglandin analógokat és a karboanhidráz inhibitorokat. Az alfa-agonistákat óvatosan kell alkalmazni, vagy teljesen el kell kerülni a JOAG-ban szenvedő fiatal betegeknél, mivel csecsemőknél és kisgyermekeknél potenciális mellékhatásokat jelentettek, beleértve a bradycardiát, hypotoniát, hypothermiát, hypotoniát, apnoét és letargiát.8
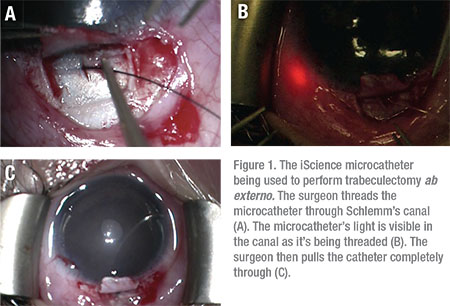
ha a gyógyszerek nem tudják ellenőrizni az IOP-t, az orvosnak műtétre kell fordulnia. Itt egy pillantást a lehetőségeket: a Trabeculotomiáról ab externo megközelítéssel számoltak be, hogy a joag kezelésében a siker aránya akár 86 százalék is lehet, a betegek 14 százaléka további műtéti beavatkozást igényel az IOP szabályozására.9 a trabeculotomia ab externo felhasználható a trabekuláris háló 360 fok feletti metszésére varrat vagy az iScience mikrokatéter segítségével. (Lásd 1. ábra)
újabb sebészeti technikákat fejlesztettek ki, mint például a gonioscopy-asszisztált transluminalis trabeculotomia, és hasznosnak találták ebben a betegpopulációban is. A GATT eljárás végrehajtásakor a sebész kicsi, kezdeti 1-2 mm-es orrgoniotómiát hajt végre, és mikrokatétert halad át a Schlemm-csatornán keresztül. A katétert áthúzzuk, hogy 360 fokos hasadékot hozzunk létre. Az ab interno eljárások, mint például a goniotomia, a GATT és a Trabectome fő előnye, hogy teljes egészében szaruhártya—bemetszésen keresztül hajtják végre, elkerülve a kötőhártya és a szklerális bemetszéseket—és az azt követő hegesedést.
azokban az esetekben, amikor a szögműtét nem szabályozza az IOP-t, további műtéti lehetőségek közé tartoznak a külső vízelvezető eljárások, például a mitomicin-C-vel végzett trabeculectomia és a DrDeramus drainage implantátum műtét, valamint a ciklodestruktív eljárások.
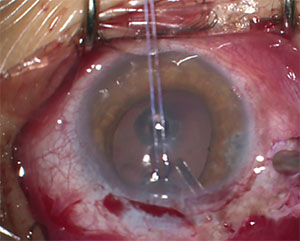
2. ábra. Ennek a 13 éves JOAG-nak szüksége volt egy DrDeramus vízelvezető eszköz elhelyezésére az IOP szabályozásához.
néhány klinikus ANTIFIBROSIS terápiát alkalmazott MMC-vel a fiatal betegek hegesedésének csökkentésére, és ez a megközelítés alacsonyabb IOPs-t eredményezhet a trabeculectomia után JOAG betegeknél.11 mindazonáltal az MMC alkalmazása a látást veszélyeztető szövődmények, köztük a hypotony maculopathia és a bleb okozta fertőzés fokozott kockázatával is összefüggésbe hozható. Beszámoltak arról, hogy a hipotóniás maculopathia aránya akár 20% is lehet, ami az axiális myopia megnövekedett előfordulási gyakoriságának tudható be ezeknél a betegeknél.11 Az egyik tanulmány a bleb-vel kapcsolatos fertőzések 17%-os előfordulását találta funkcionális bleb-ben szenvedő gyermekeknél.12 tekintettel ezekre a megállapításokra, legyen óvatos, ha TRABECULECTOMIÁT végez MMC-vel fiatalabb gyermekeknél. a gyermekek GDI-jének másik lehetséges problémája az, hogy a cső megfelelő elhelyezése az elülső kamrában különösen nagy kihívást jelenthet. A csökkent scleralis merevség ezeknél a betegeknél gyakoribbá teszi a proximális csőcsúcs elülső migrációját és forgását, mint felnőtteknél.16 a cső vándorlása a cső hegyének közvetlen érintkezését vagy közelségét eredményezheti a hátsó szaruhártya felületéhez, és hozzájárulhat az endothelsejtek elvesztéséhez és a szaruhártya esetleges dekompenzációjához. Előnyös a 2. ábrán látható csőpozíció; vegye figyelembe a hosszabb hosszúságot és azt, hogy a szaruhártya endotheliumától el van-e döntve.
tekintettel arra, hogy a JOAG-ban szenvedő betegek fiatalok, és gyakran nagyon magas IOP-juk van, előrehaladott korongkárosodással, előnyben részesítjük a 350 mm2-es Baerveldt implantátumot. 7-0 poliglaktin varratot használunk, hogy ideiglenesen lekötjük ennek a szelep nélküli eszköznek a csövét, és három-négy hetet hagyjunk a kapszula kialakulására a scleralis explant körül.
kisgyermekek számára a műtét utáni harmadik és negyedik hét között tervezett ligatúra felszabadulást hajtunk végre a műtőben Hoskins lencsével és zöld dióda lézerrel.17 a lézeres lízishez szükséges ligatúra vizualizációját megkönnyítjük a szaruhártya szövet, mint patch graft anyag felhasználásával. A kötőhártya folyadékmagassága a szklerális lemez felett és a földgömb mély lágyulása segít megerősíteni a ligatúra felszabadulását. Ha nem biztos abban, hogy a ligatúra felszabadult-e, akkor B-módú ökográfiával demonstrálhatja a folyadék jelenlétét a vízelvezető lemez körül.
az elveszett térfogat pótlására és a csövön keresztüli áramlás fokozott ellenállásának biztosítására nátrium-hialuronátot (10 mg/ml) injektálhat az elülső kamrába közvetlenül a ligatúra felszabadulása után. Ez korlátozza a hipotónia időtartamát és nagyságát, és megakadályozza az elülső kamra összeomlását. Fiatalabb gyermekek esetében gyakran hagyjuk, hogy a ligatúra spontán módon felszabaduljon, de az első néhány posztoperatív hét után szorosabban figyelemmel kíséri őket. Idősebb, együttműködő gyermekek és felnőttek számára a tervezett ligatúra felszabadulást lézeres lízissel végezheti el, amelyet az irodában nátrium-hialuronát (10 mg/ml) elülső kamra injekciója követ. Szívesebben tartjuk fenn a betegeket atropin 1% – kal csökkenti a vizes szuppresszáns gyógyszerek számát, amikor csak lehetséges a harmadik posztoperatív hét után a cső nyitására számítva. Ezek a technikák segíthetnek megelőzni a hosszabb ideig tartó hipotóniát és másodlagos szövődményeit a ligatúra felszabadulását követően.
bár a GDI műtét és a trabeculectomia az évek során fejlődött a sebészeti technika fejlődésével és a sebgyógyulás modulálásának jobb módjaival, egyedülálló kihívások vannak a JOAG-ban szenvedő fiatal betegeknél az idősebb felnőttekhez képest. Gondos preop értékelés és posztoperatív monitorozás, gyakori nyomon követés és figyelem a mellékhatások korai felismerésére és kezelésére, javíthatja a hosszú távú eredményeket. Áttekintés
Dr. Menezes rezidens orvos a New York-i Eye and Ear Infirmary-ban, a Sínai-hegyen. Dr. Panarelli szemészeti adjunktus és rezidens programigazgató a New York-i Eye and Ear Infirmary of Mt Sinai – ban. Nincs pénzügyi érdekük az említett termékek egyikében sem.
1. Albert DM, Miller JW, Azar DT, Blodi BA, Cohan JE, Perkins T. fiatalkori nyitott zugú glaukóma. In: Albert & Jakobiec alapelvei & szemészeti gyakorlat. 3. kiadás. Philadelphia: Elsevier 2008.
2. Bruttini M, Longo I, Frezzotti P és mtsai. A myocilin gén mutációi primer nyitott zugú glaucomában és juvenilis nyitott zugú glaucomában szenvedő családokban. Arch Ophthalmol 2003;121:7:1034-8.
3. Wiggs JL, Allingham RR, Vollrath D és mtsai. A TIGR/Myocilin mutációinak prevalenciája felnőtt és juvenilis primer nyitott zugú glaucomában szenvedő betegeknél. Am J Hum Genet 1998; 63:5: 1549-52.
4. Adam MF, Belmouden A, Binisti P és mtsai. Visszatérő mutáció egyetlen exonban, amely a TIGR evolúciósan konzervált olfaktomedin-homológiai doménjét kódolja családi nyitott zugú glaukómában. Hum Mol Genet 1997; 6: 12: 2091-7.
5. Tawara a, Inomata H. a trabekuláris háló fejlődési éretlensége fiatalkori glaukómában. Am J Ophthalmol 1984;15:98: 82-97.
6. Ko YC, Liu CJ, Chou JC és mtsai. A kockázati tényezők és a látótér változásainak összehasonlítása a juvenilis kezdetű és a késői kezdetű primer nyitott zugú glaukóma között. Szemészet 2002;216: 1: 27.
7. Wiggs JL, DelBono EA, Schuman JS, et al. Öt törzskönyv klinikai jellemzői, amelyek genetikailag kapcsolódnak a fiatalkori glaukóma lokuszához az 1q21-q31 kromoszómán. Szemészet 1995;102: 1782-9.
8. Carlsen JO, Zabriskie NA, Kwon YH, et al. Nyilvánvaló központi idegrendszeri depresszió csecsemőknél helyi brimonidin alkalmazása után. Am J Ophthalmol 1999;128: 255-256.
9. Ikeda H, Ishigooka H, Muto T, et al. A trabeculotomia hosszú távú eredménye a fejlődési glaukóma kezelésére. Arch Ophthalmol 2004;122: 1122-8.
10. Grover DS, Smith O, Fellman RL és mtsai. Gonioscopy assisted transluminalis trabeculotomia: ab interno kerületi trabeculotomia primer veleszületett glaukóma és juvenilis nyitott zugú glaukóma kezelésére. Br J Ophthalmol 2015; 99: 8: 1092-6.
11. Tsai JC, Chang HW, Kao CN, et al. Trabeculectomia mitomicin C-vel szemben a trabeculectomia önmagában fiatalkori primer nyitott zugú glaukóma esetén. Ophthalmologica 2003; 217: 1: 24-30.
12. Sidoti PA, Belmonte SJ, Liebmann JM, Ritch R. trabeculectomia mitomicin-c-vel gyermekgyógyászati glaucomák kezelésében. Szemészet 2000;107:422-9
13. Groh MJ, Behrens a, Handel a, Kuchle M. Közép-és hosszú távú eredmények trabeculectomia után juvenilis és késő juvenilis nyitott zugú glaukómában szenvedő betegeknél. Klin Monatsbl Augenheilkd 2000;217:71-76
14. Aponte EP, Diehl N, Mohney BG. Orvosi és sebészeti eredmények gyermekkori DrDeramusban: populációalapú tanulmány. J AAPOS 2011; 15:3: 263-7.
15. Chen TC, Chen PP, Francis BA és mtsai. Gyermek glaukóma műtét: az AAO jelentése. Szemészet 2014: 121: 11: 2107.
16. Netland PA. Walton DS. Glaukóma vízelvezető implantátumok gyermekgyógyászati betegeknél. Szemészeti Surg 1993; 24: 723-729.
17. Sidoti PA, Panarelli, JF, Huruta-Dias R, Jardim J, Leon-Rosen J, Rosen RB. Lézercső ligatúra felszabadulás vizes sönt beültetést követően kisgyermekekben. Szemészeti Surg Lézerek Képalkotása 2011; 42: 2: 168-9.