- Bevezetés
- anyagok és módszerek
- tojásgyűjtés
- Ecdysteroid Kvantifikáció
- juvenilis hormon mennyiségi meghatározása
- statisztikai elemzések
- eredmények
- Vita
- Ecdysteroids
- fiatalkori hormon
- Data Availability Statement
- szerzői hozzájárulások
- finanszírozás
- összeférhetetlenség
- Köszönetnyilvánítás
- Kiegészítő Anyag
Bevezetés
a rovarok adaptív sugárzását a különböző éghajlatokon részben elősegítette a diapause ismételt fejlődése, a kedvezőtlen körülmények előtti előzetes fejlődési megállás (pl. tél, száraz évszak; Waterhouse and Norris, 1980; Tauber et al., 1986; Danks, 1987; Hodkova és Hodek, 2004). A Diapause általában egy jelképes környezeti jelre (pl., szezonális változás a fotoperiódusban), genetikailag meghatározott ideig fenntartják, majd a kedvező feltételek visszatérése után megszüntetik. Így a diapause lehetővé teszi a rovarok számára, hogy növekedésüket és szaporodásukat a helyi szezonális ciklusokhoz igazítsák (Tauber et al., 1986; Danks, 1987). A Diapause az élettörténet, a földrajzi kiterjedés és a szezonális bőség kulcsfontosságú szabályozója számos rovar beporzója számára (pl. Kemp and Bosch, 2005; fr., 2013), mezőgazdasági kártevők (pl., 1991; Li et al., 2012; Levine et al. Denlinger and Armbruster, 2015; Gray et al., 2016). Ezenkívül a diapause széles körű fiziológiai módosításokat idéz elő, beleértve a tápanyagtartalékok felhalmozódását, az anyagcsere-aktivitás elnyomását, a megnövekedett anaerob katabolizmust, a sejtciklus leállítását, a Wnt jelátvitel változásait és a különböző stressztűrési mechanizmusok szabályozását (Denlinger, 2002; Hahn and Denlinger, 2007, 2011; King and MacRae, 2015; Ragland and Keep, 2017). A diapause alapjául szolgáló szabályozási mechanizmusok megértése régóta fennálló probléma a szervezetbiológiában, és megkönnyíti a kulcsfontosságú Fajok új irányítási megközelítéseinek kidolgozását.
az Ecdysteroidok és a fiatalkori hormonok a rovarok fiziológiai és fejlődési folyamatainak széles skáláját szabályozzák (Gruntenko and Rauschenbach, 2008; Jindra et al., 2013; Palli, 2016), beleértve a diapauzát (Denlinger, 1985; Denlinger et al., 2012). A diapauzát szabályozó specifikus hormonális jel általában a fejlődési megállás stádiumától függően változik (Denlinger et al., 2012). Például a lárva vagy a pupilla diapauza során bekövetkező fejlődési leállást általában az ecdysteroid abundancia változásai szabályozzák (például Ohtaki and Takahashi, 1972; Bowen et al., 1984; Richard et al., 1987). Ezzel szemben a felnőttkori diapauza során bekövetkező fejlődési leállást gyakran a fiatalkori hormonbőség változásai szabályozzák (pl. Spielman, 1974; Schooneveld et al., 1977; Saunders et al., 1990 és lásd felülvizsgálat Denlinger et al., 2012).
jelentős különbség van az embrionális diapauza hormonális szabályozásának megértésében, amely széles körben megfigyelhető a Lepidoptera, Orthoptera, Hemiptera és Diptera esetében. Korábbi kutatások széles körben dokumentálták az embrionális diapauza endokrin szabályozását a selyemhernyómolyban (Bombyx mori) diapause hormon által (Hasegawa, 1963; Yamashita és Hasegawa, 1966; Yamashita, 1996). A diapause hormonnak ez a szabályozó szerepe azonban úgy tűnik, hogy egyedülálló a B. mori számára, ezért kevés betekintést nyújtott az embrionális diapause hormonális alapjába más fajokban (Denlinger et al., 2012). A B. mori-n túl az embrionális diapauza hormonális szabályozását mindössze három fajban állapították meg. A cigány lepke (Lymantria dispar) fejlődési leálláson megy keresztül, amelyet az ecdysteroidok nagyobb bősége kezdeményez és tart fenn (Lee et al., 1997; Lee és Denlinger, 1997), míg az alacsony ecdysteroid abundancia két sáskában szabályozza a diapauzát (Chortoicetes terminifera, Locusta migratoria; Gregg et al., 1987; Tawfik et al., 2002).
a mai napig egyetlen tanulmány sem jellemezte a hormon bőségét bármely dipterán faj embrionális diapauzája során. Itt kezeljük ezt a rést az embrionális diapauza hormonális szabályozásának vizsgálatával az ázsiai tigrisszúnyogban, az Aedes albopictusban. Az elmúlt 30 évben ez az orvosilag fontos vektor (Paupy et al., 2009) világszerte sikeresen betört a mérsékelt égövi régiókba (Benedict et al., 2007) részben egy embrionális diapauza miatt, amely megkönnyítette a túlélést a távolsági szállítás során (Juliano and Lounibos, 2005; Diniz et al., 2017), és gyorsan fejlődött, hogy összehangolja a fejlődési megállás időzítését a helyi éghajlati viszonyokkal (Urbanski et al., 2012). Az AE mérsékelt populációi. az albopictus maternálisan szabályozott, fotoperiodikus diapauzába lép. Rövid, őszi nappali hosszúság alatt a nőstények olyan petesejteket termelnek, amelyek befejezik az embrionális fejlődést, de a következő tavaszig a tojás korionjában lévő farátlárvákként ellenállnak a keltetési ingereknek. Az elmúlt évtizedben az embrionális diapauza transzkripciós szabályozása az Ae – ben. az albopictust széles körben jellemezték (Urbanski et al., 2010; Poelchau et al., 2011, 2013a,b; Huang X. et al., 2015; Batz et al., 2017), de ennek a döntő adaptációnak a hormonális szabályozása továbbra sem ismert. Számszerűsítettük a 20-hidroxiekdizont (20he) és a juvenilis III hormont (JH3) diapausing és nem diapausing petesejtekben három olyan időpontban, amelyek az embrionális fejlődés kulcsfontosságú szakaszait tartalmazzák, és eredményeinket a korábban összegyűjtött RNAseq összefüggésében értelmeztük (Poelchau et al., 2013a, b) és manipulatív adatok (Suman et al., 2015).
anyagok és módszerek
tojásgyűjtés
minden mérés ae laboratóriumi kolóniából származó F11 tojásokat használt. az albopictus 2015 augusztusában jött létre több mint 200 lárvából, amelyeket Manassasban (VA, Egyesült Államok) gyűjtöttek össze. A kísérlet előtt a populációt korábban leírt körülmények között tartottuk fenn . A kísérlethez petesejtminták előállításához az F10 lárvákat 5,5 literes Sterlittartályokban tartottuk, körülbelül 250 lárva / 2 sűrűséggel.5 L ionmentesített (DI) víz 5 mL élelmiszer-hígtrágyával (Armbruster and Conn, 2006) LD fotoperiódus alatt, 21 Kb C és 80% RH értéken. Minden hétfőtől szerdától péntekig a lárvákat finom hálón szűrjük át, majd tiszta, 5,5 literes Sterlittartályba helyezzük; a bábokat felnőtt ketrecekbe osztottuk, amelyeket bármelyik alatt tartottak fenn diapauza-elhárító LD fotoperiódus vagy diapauza-indukáló, rövid napos fotoperiódus (SD, 8:16 L:D).
a felnőtt nőstényeknek hetente vérétkeztetést és fehérítetlen papírtörlővel bélelt, félig DI vízzel töltött petesejtpoharat biztosítottak, amíg a peteérés meg nem szűnt. A tojásokat naponta összegyűjtöttük, 48 órán át nedves papírtörlőn tartottuk, majd levegőn szárítottuk és SD körülmények között tartályokban tároltuk. 5, 7 és 11 nappal az ovipozíció után (Dpov) a begyűjtött tojásokat mx5 mikromérlegen (Mettler–Toledo, Columbia, OH, Egyesült Államok) 1, 460 mg pontossággal megmérjük (átlag: 11,460 mg, tartomány: 9,1-19,5 mg), 1, 5 mL-es csövekbe helyezzük, folyékony nitrogénben fagyasztva 11 óra és 12 óra között (Zeitgeber idő 3-4 óra), és -80 C-on tároljuk. A tojások egy részhalmazát megtartották annak megerősítésére, hogy az LD és az SD fotoperiódus körülmények stimulálták a nem diapauzás, illetve a diapauzás tojások termelését (lásd Urbanski et al., 2012).
két okból vettünk mintát 5, 7 és 11 dpov-on. Először Is, Ae. az albopictus kezdeményezi a diapause-t (sensu Ko Enterprises, 2006; Ko Enterprises et al., 2017) az embrionális fejlődés befejezése után (Mori et al., 1981). A kísérleteink során alkalmazott körülmények között, Ae. az albopictus embriók körülbelül 5 dpov-nál szegmentálódnak, a nem diapauzás embriók pedig körülbelül 7 dpov-nál képesek kikelni (Poelchau et al., 2013a). 11 dpov-ra a fejlődési letartóztatás szilárdan megalapozott a diapause embriókban (Poelchau et al., 2013b). Ezért úgy döntöttünk, hogy összehasonlítjuk a diapause és a nem diapause embriókat a keltetési kompetencia időszakát követő időpontokban, beleértve a fejlődés leállítását a diapause alatt. Másodszor, olyan időpontokat választottunk, amelyek hasonlóak voltak az embriók korábbi rnaseq kísérleteihez (Poelchau et al., 2013a, b) Annak érdekében, hogy ezeket az adatokat felhasználhassuk jelenlegi eredményeink értelmezéséhez. Ezek az rnaseq eredmények korábban jól korreláltak a qRT-PCR-rel kapott génexpressziós eredményekkel (Poelchau et al., 2013a).
Ecdysteroid Kvantifikáció
az ecdysteroidok kivonásához tojásmintákat helyeztünk egy boroszilikát üveg 0,5 mL kúpos fenekű mikroszövet-daráló csőbe (Wheaton, Millville, NJ, Egyesült Államok), belső standardként hozzáadva 1 db farnesolt (Sigma-Aldrich, St. Louis, MO, Egyesült Államok). A tojásokat manuálisan homogenizáltuk háromszor egy Teflon mozsárral 300-ban 600l HPLC-fokozatú hűtött MeOH majd 12 000 RCF-en 10 percig hűtött (4C) centrifugában forgattuk. A kapott felülúszót összegyűjtöttük, majd alumínium-oxid oszlopokon kétszer eluáltuk hűtött 90% MeOH-val, egyszer pedig MeOH-val. A mintákat hűtött (4 db C) vákuumcentrifugában szárítottuk, 20 ml MeOH-ban reszuszpendáltuk, és -80 db C-on tároltuk az elemzésig. A pozitív kontrollokat úgy állítottuk elő, hogy egyenként 1 db 20he-t (Sigma-Aldrich) és farnesolt adtunk az üres csövekhez, amelyeket egyébként azonos módon dolgoztunk fel. Az ecdiszteroid koncentráció mintaelemzését Mikromassz Quattro Micro LC-MS/MS (Waters Co., Milford, MA, Egyesült Államok). A befecskendezési térfogat 5,0 6L volt, az elválasztásokat az ACQUITY UPLC BEH C18 2,1 mm-es 50 mm-es oszlopokkal, 1,7 mm-es állófázissal (Waters Co.). Az LC futások működési feltételei a mozgófázis áramlási sebessége 0,37 mL min–1 volt, a bináris mozgófázis 0,1% hangyasav acetonitril és 0,1% hangyasav vízben. A kezdeti feltételek 1:99 acetonitril voltak: víz, majd izokratikus áramlás 0,3 percig. 0,3 percnél lineáris gradiens 1-től:99-99: 1 acetonitril: vizet alkalmaztunk 4,2 perc alatt, majd 1,0 perc izokratikus áramlást 99:1 acetonitril:víz mellett, majd a mobil fázis visszatért 1:99 acetonitril:vízhez. A tömegspektrométer beállításai elektrospray pozitívak voltak, a deszolvatációs hőmérséklet 350 KB C. 20he és a farnezol eluált értéke 2,89 és 4,97 perc volt, és a jellemző átmenetek többszörös reakciómonitorozásával számszerűsítették: 481,22 (m/z) > 445,24 (m/z) és 205,41 (m/z) > 121,09 (m/z). A vizsgálat kimutatási határa körülbelül 5 pg.
juvenilis hormon mennyiségi meghatározása
minden petesejtmintát 0,5 mL-es kúpos fenekű mikroszövet-daráló csőbe (Wheaton) helyeztünk, belső standardként 1 Ft farnesolt (Sigma-Aldrich) adva hozzá. A tojásokat manuálisan homogenizáltuk háromszor egy Teflon mozsárral 500 6L HPLC fokozatú hűtött hexánban, majd 12 000 RCF-en 10 percig hűtött (4 c) centrifugában forgattuk. A hexánfrakciókat tiszta boroszilikát injekciós üvegben rekombináltuk, majd vákuumcentrifugálással szárítottuk. A JH-t gázkromatográfiával/tömegspektrometriával határoztuk meg a korábban leírtak szerint (Brent and Vargo, 2003). Röviden, a maradékot három öblítő hexánnal kimossuk az injekciós üvegekből, majd alumínium-oxiddal töltött boroszilikát üvegoszlopokhoz adjuk. A szennyeződések kiszűrésére a mintákat az oszlopokon egymás után hexánnal, 10% etil-éter-hexánnal és 30% etil-éter-hexánnal eluáltuk. A szárítást követően a mintákat 60 6CC-on 20 percen keresztül metil-d-alkohol (Sigma-Aldrich) és trifluor-ecetsav (Sigma-Aldrich) oldatában történő hevítéssel derivatizáltuk. A mintákat kiszárítottuk, hexánban reszuszpendáltuk, majd ismét alumínium-oxid oszlopokon keresztül eluáltuk. A nem derivatizált komponenseket 30% etil-éterrel távolítottuk el. A JH-származékot 50% etil-acetát–hexán hozzáadásával új injekciós üvegekbe gyűjtöttük. Szárítás után a mintákat hexánban reszuszpendáltuk, majd egy HP 7890a sorozatú GC (Agilent Technologies, Santa Clara, CA, Egyesült Államok) segítségével elemeztük, amely egy 30 m-es 0,25 mm-es zebron ZB-viasz oszloppal (Fenomenex, Torrance, CA, Egyesült Államok) volt felszerelve egy HP 5975c inert tömegszelektív detektorral. A héliumot vivőgázként használták. A JH formát a JH 0, JH I, JH II, JH3 és JH3 etil ismert aláírására vonatkozó első vizsgálati mintákkal igazolták; a JH3 mint elsődleges endogén forma megerősítést nyert ebben a fajban. Az ezt követő mintákat MS SIM módban elemeztük, m/z 76 és 225-nél monitorozva, hogy biztosítsuk a JH3 D3-metoxi-hidrin származékának specifitását. A teljes abundanciát a származtatott JH3 standard görbéjével számszerűsítettük, és a tojások kiindulási tömegéhez igazítottuk. A vizsgálat kimutatási határa körülbelül 1 pg.
statisztikai elemzések
elemzéseket végeztünk R-ben (R Core Team, 2019). A JH3 abundanciát log-transzformáltuk és Anova segítségével elemeztük a diapauza állapotának, életkorának és kölcsönhatásának hatásainak tesztelésére. 20az abundancia nem lineáris volt, és két polinom regressziós modellt használt: egy teljes modellt, amely tartalmazza az életkorot és a fejlődési státuszt (diapauza, nem diapauza), és egy csökkentett modellt, amely csak az életkorot tartalmazza. A modelleket ANOVA segítségével hasonlítottuk össze annak meghatározására, hogy a fejlődési állapot is jelentősen javította-e a magyarázó erőt.
a transzkripciós elemzések korábban gyűjtött rnaseq adatokat használtak fel diapause és nem diapause Ae-ből. albopictus tojás (kiegészítő adatkészlet 1; Poelchau et al., 2013a, b). A 3, 6 és 11 dpov-nál differenciálisan expresszált géneket génkészlet-dúsítási elemzésekkel vizsgáltuk (Mootha et al., 2003) a Zongoracsomag használatával (V., 2013) alapértelmezett paraméterekre állítva, majd FDR korrekcióval. Egy referencia génkészletet kommentáltunk a biológiai folyamattal GO a Vektorbázhoz rendelt kifejezések(Giraldo-Calder)., 2015). A JH3 és az ecdysteroid szintézis útvonal génjeit, valamint a JH3 receptorokat és a degradációs géneket kézzel jegyezték fel a korábbi szakirodalom szerint (Bai et al., 2007; Li et al., 2011; Nouzova et al., 2011; Niwa és Niwa, 2014; Matthews et al., 2016). Ezenkívül a VEKTORBÁZBAN megadott génleírások alapján JH3 és ecdysteroid-induktív géneket jegyeztünk fel(Giraldo-Calder stb., 2015). Ezen génkészletek teljes áttekintését a kiegészítő adatkészlet tartalmazza 1.
eredmények
az átlagos diapause incidencia 95,9% volt (tartomány: 90,5–100%) SD fotoperiódus és 5 alatt.4% (tartomány: 1,8–9,5%) LD fotoperiódus alatt (kiegészítő adatkészlet 2); így fotoperiodikus kezeléseink indukálták a várt diapauzás válaszokat. 20A diapause és nem diapause körülmények között is 7 dpov-nál tetőzött, de a diapause státuszt a 20he abundancia kvadratikus modelljének tényezőjeként figyelembe véve nem javította a modell magyarázó erejét (1a Ábra és 3.Kiegészítő adatkészlet; F3,43 = 0,21, p = 0,890). Ezek az eredmények azt mutatják, hogy a diapauza állapota nem magyarázza szignifikánsan a 20he titer változását. Az RNAseq útvonal-elemzése azt mutatta, hogy sem a 20he szintézis útvonala, sem a 20he-indukálható gének nem változtak szignifikánsan diapauza alatt, szemben a nem diapauza állapotokkal 3, 6 vagy 11 dpov-nál (1.táblázat).

táblázat 1. Génkészlet dúsítási elemzési eredmények, Lásd a kiegészítő adatkészletet 1 e génkészletek teljes összefoglalásához.
megerősítették, hogy a JH3 a fiatalkori hormon elsődleges formája ebben a fajban. A JH3 előfordulási gyakorisága szignifikánsan csökkent a diapauzás embriókban (1b.Ábra és 3. Kiegészítő adatkészlet; F1,64 = 5,08, p = 0,028). Azonban az életkor (F2,64 = 0, 66,p = 0, 518) és a diapauza státusz és az életkor kölcsönhatása (F2, 64 = 0, 13, p = 0, 883) nem befolyásolta a JH3 szintet. Az rnaseq adatok útvonal-elemzése azt mutatta, hogy a JH3 szintézis útvonala szignifikánsan elnyomódott 3 dpov-nál, a JH-indukálható gének pedig szignifikánsan elnyomódtak 6 dpov-nál (2.ábra és 1. táblázat).
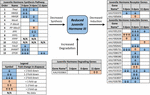
2. ábra. A JH3 szintézisében, lebomlásában és az AE indukciójában részt vevő gének differenciális expressziójának összefoglalása. albopictus (Poelchau et al., 2013a, b). A diapauza által kiváltott jelentős csökkenéseket (kék) vagy növekedéseket (narancssárga) árnyékolt sejtek jelzik. A különbség nagyságát nyilak jelzik, a bal alsó sarokban található jelmagyarázat szerint. A közönséges nevek nélküli géneket a vectorbase ID számmal azonosítják.
Vita
a Diapause egy széles körben elterjedt adaptáció, amely lehetővé teszi a rovarok számára, hogy növekedésüket és szaporodásukat szezonálisan kedvező feltételekhez igazítsák (Tauber et al., 1986; Danks, 1987). A hormonális változások megértése, amelyek révén a rovarok összehangolják a külső, diapauzát kiváltó jelek észlelését a fejlődés leállításához vezető fiziológiai mechanizmusokkal, a biológia régóta fennálló célja (Lees, 1956; Denlinger, 2002). Több évtizedes kutatás vezetett a diapauza közös hormonális stratégiáinak azonosításához a lárva, a pupula és a felnőtt szakaszokban; az embrionális diapauza hormonális szabályozása azonban nagyrészt ismeretlen, különösen a Diptera esetében (Denlinger, 1985, 2002; Denlinger et al., 2012). Ebben a tanulmányban a csökkent JH3 közvetlen mérése a diapauzában a korábbi génexpressziós profilozás megerősíti (Poelchau et al., 2013a, b) és manipulatív kísérletek (Suman et al., 2015) alátámasztva azt a hipotézist, miszerint a JH3 szabályozza az embrionális diapauzát ebben a fajban.
Ecdysteroids
ebben a tanulmányban közvetlenül mértük az ecdysteroid abundanciát három időpontban diapause és nem diapause körülmények között a szúnyog ae embrióiban. albopictus. A Toxorhynchites amboinensis (Russo and Westbrook, 1986) korábbi eredményeivel összhangban a 20he szintje az embrionális fejlődés végéhez közeledett (7 dpov; 1a ábra). A 20he titer azonban nem különbözött szignifikánsan a diapause és a nem diapause tojások között. Ezenkívül sem a 20he szintézis út, sem a 20he-indukálható gének nem mentek át jelentős, összehangolt változásokon a génexpresszióban (1.táblázat). Megállapítottuk, hogy ellentétben a Lepidoptera és Orthoptera korábban vizsgált embrionális diapauszaival (Hasegawa, 1963; Yamashita és Hasegawa, 1966; Gregg et al., 1987; Yamashita, 1996; Lee és Denlinger, 1997; Lee et al., 1997; Tawfik et al., 2002), 20NEM szabályozza a diapauza megindítását az Ae-ben. albopictus.
fiatalkori hormon
ezzel szemben körülbelül kétszer alacsonyabb JH3-abundanciát figyeltünk meg a diapause embriókban (1b ábra). Míg kisebb nagyságrendű, mint különbségek JH3 abundancia alatt észlelt diapause vs. nem diapause feltételek rovarok diapause más életszakaszokban (pl. Yin és Chippendale, 1979; Walker és Denlinger, 1980; Readio et al., 1999), közvetlen méréseinket transzkripciós bizonyítékok támasztják alá (2.ábra). Például a JH3 szintézis útvonala jelentősen elnyomódik a korai diapause előkészítés során (3 dpov). Alátámasztva ezen eredmények értelmezését, korábbi tanulmányok azt találták, hogy a gének csökkent expressziója a JH3 szintézis út mentén erősen korrelál az alacsonyabb JH3 bőséggel mindkét Aedes aegypti (Nouzova et al., 2011; Rivera-Perez et al., 2014) és Diploptera punctata (Huang J. et al., 2015). A JH-indukálható gének szintén jelentősen elnyomódnak a késői diapause előkészítés során (6 dpov; 1.táblázat), ami arra utal, hogy a diapause-nak szánt embriók korlátozott kapacitással reagálnak a JH3 jelzésre annak az időnek a közelében, amikor a nem diapause embriók kompetenssé válnak a kikelésre. Ezenkívül a JH3-lebontó enzim (JH-észteráz) génexpressziója jelentősen fel van szabályozva a diapauza korai fenntartásában (11 dpov; 2.ábra), valamint később a diapauza fenntartásában (21 és 40 Dpov; Poelchau et al., 2013b) arra utal, hogy a JH3 alacsony mennyiségben maradhat a diapauza során ebben a fajban.
a csökkent JH3-bőség a fejlődési leállás során kissé ellentmondásos, mert az alacsony fiatalkori hormon titer jellemzően progresszív moltokkal jár, különösen a lárva a pupilla stádiumig (Palli, 2016). Azonban egy JH3 analóg (piriproxifen) alkalmazása a diapause Ae-re. az albopictus tojás felgyorsítja a diapause megszűnésének sebességét dózisfüggő módon (Suman et al., 2015). A leghatékonyabb adagolás esetén a piriproxifennek kitett tojások körülbelül 80% – a 30 dpov-mal szünteti meg a diapauzát, szemben a kontrolltojások mindössze 1% – ával 80 dpov-mal (Suman et al., 2015). A JH3 bőség változásai embrionális diapauza-szerű fenotípust is generálhatnak más fajokban. Például a B-ben. mori, a JH3 szintézis kísérleti csökkentése a JHAMT knockout segítségével teljesen kifejlett farátlárvákat eredményez, amelyek nem reagálnak a keltetési ingerekre; ez a fenotípus dózisfüggő módon megmenthető akár extrahált JH3, akár metoprén, egy JH3 analóg alkalmazásával (Nakao et al., 2015). Hasonlóképpen, egy másik fiatalkori hormon analóg (RO-20-3600) kísérleti kiegészítése az újonnan lerakódott Drosophila melanogaster tojásokhoz pharate lárvákat eredményez, amelyek mozgékonyak a tojásban, de nem kelnek ki (Smith and Arking, 1975). Ezek az adatok együttesen azt mutatják, hogy a fiatalkori hormonok bősége valószínűleg hozzájárul a keltetési válaszok szabályozásához a különféle rovarokban. Az embrionális diapauzát a pharate lárva stádiumában az határozza meg, hogy nem reagál a keltetési ingerekre, a fiatalkori hormonbőség változásai közös hormonális stratégiát jelenthetnek a diapauza ezen formájának szabályozására.
a korábbi transzkripciós és manipulatív adatokkal összhangban eredményeink erősen befolyásolják a csökkent JH3 bőséget, mint az embrionális diapauza valószínű szabályozóját az Ae – ben. albopictus. Ez a kutatás az első közvetlen számszerűsítése hormon bőség során embrionális diapauza bármely Dipterán faj, és egy fontos lépés tisztázása felé a hormonális szabályozás e döntő alkalmazkodás kedvezőtlen környezetben. A külső ingerek és a hormonális jelátvitelen keresztüli fejlődési leállás közötti kapcsolat jellemzése továbbra is nagy kihívás (Denlinger, 1985; Denlinger et al., 2012). Ezeknek az utaknak a különböző fajokban történő tisztázása kritikus betekintést nyújt az alapvető és alkalmazott problémákba, beleértve az élettörténet evolúciójának molekuláris és fiziológiai alapjainak megértését, a fajok éghajlatváltozásra adott válaszainak előrejelzését és a kártevők és a vektorfajok kezelésének új céljainak azonosítását (Denlinger, 2008).
Data Availability Statement
a tanulmányhoz létrehozott összes adatkészlet megtalálható a cikkben/kiegészítő anyagban.
szerzői hozzájárulások
a ZB, a CB és a PA hozzájárult a tanulmány koncepciójához, megtervezéséhez és elkészítette a kézirat eredeti vázlatát. ZB, MM és JS végezte az állattenyésztést és gyűjtötte a tojásmintákat. A CB elvégezte az LC-MS / MS és a GC-MS elemzéseket. A ZB elvégezte a statisztikai elemzéseket. Minden szerző hozzájárult a kézirat átdolgozásához, és jóváhagyta a benyújtott változatot.
finanszírozás
ezt a munkát támogatta a National Institutes of Health (1r15a|111328-01) és a Davis Család Alapítvány PA.
összeférhetetlenség
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
Köszönetnyilvánítás
köszönjük Allan Knopf és Dan Langhorst segítségét a hormon titerek mérésében. Köszönjük David Denlingernek a kézirat korábbi verzióival kapcsolatos hasznos megjegyzéseket is. A kereskedelmi nevek vagy kereskedelmi termékek használata ebben a cikkben kizárólag konkrét információk szolgáltatására szolgál, és nem jelenti az Egyesült Államok Mezőgazdasági Minisztériumának ajánlását vagy jóváhagyását. Az USDA esélyegyenlőségi szolgáltató és munkáltató.
Kiegészítő Anyag
R Core Team (2019). R: a statisztikai Számítástechnika nyelve és környezete. Bécs: R Core Csapat.
Google Scholar
V: Incontinremo, L., Nielsen, J. és Nookaew, I. (2013). A genom egészére kiterjedő adatok génkészlet-elemzésének gazdagítása a génexpresszió irányultságának beépítésével, valamint statisztikai hipotézisek és módszerek kombinálásával. Nukleinsavak Res. 41, 4378-4391. doi: 10.1093/nar/gkt111
PubMed absztrakt | CrossRef teljes szöveg | Google Tudós