Bevezetés
a Kruppel-szerű 4-es faktor (KLF4) a cink-ujj transzkripciós faktor családjának tagja,amelyet különféle emberi szövetekben fejeznek ki. Jól ismert, mint a pluripotens őssejtek (IPSC) indukciójának négy tényezője (Ghaleb and Yang, 2017). A KLF4 számos fontos biológiai folyamatot képes szabályozni, mint például a neuroinflammáció, az oxidatív stressz, a proliferáció, a differenciálódás és az apoptózis (Kaushik et al., 2010; Mamonkin et al., 2013; Zhang et al., 2015; Miao et al., 2017; Xu et al., 2017). Korábbi tanulmányok a KLF4 szerepére összpontosítottak a rák fejlődésében és progressziójában (Karam et al., 2017; Yadav et al., 2018). A KLF4 egy kettős funkciójú transzkripciós faktor, amely onkogénként vagy tumorszuppresszor génként töltheti be szerepét a rák típusától vagy a rák stádiumától függően (Evans and Liu, 2008). Aktiválhatja vagy gátolhatja a sejtproliferációban, differenciálódásban és apoptózisban részt vevő gének transzkripcióját (Ding et al., 2015). A KLF4 képes együttműködni más újraprogramozó tényezőkkel, hogy a szomatikus sejteket IPSC-kké alakítsa, és gátolja az őssejtek differenciálódását (Takahashi and Yamanaka, 2006; van Schaijik et al., 2018). Ez terápiás kilátásokat biztosít az érrendszeri betegségek, az immunbetegségek, az anorexia és más betegségek számára (Imbernon et al., 2014; Liu Y. et al., 2015; Murgai et al., 2017). Ezenkívül a KLF4 széles körben szabályozó szerepet játszhat a központi idegrendszerben (CNS). Számos tanulmány azt mutatja, hogy a KLF4 számos neurológiai rendellenességhez kapcsolódik, beleértve az Alzheimer-kórt (AD), az epilepsziát, a Parkinson-kórt, a hydrocephalust és a skizofréniát (Qin et al., 2011; Xie et al., 2013; Han et al., 2015; Nishiguchi et al., 2015; Li L. et al., 2017).
az AD az egyik leggyakoribb krónikus neurodegeneratív betegség, amely kognitív és memóriazavarokhoz, különböző mentális tünetekhez és viselkedési rendellenességekhez vezet, és a progresszív demencia a leggyakoribb klinikai jellemző (Jiang et al., 2018). Az AD jelenlegi megerősített patogén tényezői közé tartozik az abnormális amiloid-6 (a) lerakódás által kiváltott szenilis plakkok kialakulása, valamint a tau felhalmozódása által kiváltott neurofibrilláris gubancok vagy dystrophiás neuritis (Querfurth and LaFerla, 2010; Shinohara et al., 2014). Ezenkívül az AD-t genetikai tényezők is befolyásolhatják. A kiváltó patogenezis azonban még mindig homályos. Az AD-kezelés legelterjedtebb gyógyszerei közé tartoznak a neurotranszmitter-fokozók, az anti-amiloid szerek, a neuroprotektív peptidek és más gyógyszerek (Cacabelos, 2018). Nevezetesen számos tanulmány kimutatta, hogy a KLF4 jelentős szerepet játszott az AD patogenezisében. Ebben az áttekintésben a KLF4 szabályozó szerepére összpontosítunk a neuroinflammációban, a neuronális apoptózisban, az axonális regenerációban és a vas felhalmozódásában, hogy megmagyarázzuk a KLF4 és az AD patogenezise közötti összefüggést, amely betekintést nyújthat a neurodegeneratív rendellenességek sejtes és molekuláris mechanizmusaiba.
a Klf4 biológiai jellemzői
a KLF4 egy NIH 3T3 könyvtárból izolált cinkujj-tartalmú nukleáris fehérje, amely a sejtmagban található. Először Shields et al. (1996). Az emberi KLF4 molekulatömege 55kD, a 9q31 kromoszómán található. A KLF4 egy 6,3 kb-os génszegmenst fed le, és öt exonnal rendelkezik. CDNS-kódoló régiója 470 aminosavmaradékból álló polipeptidet kódol (mégis et al., 1998; Ghaleb és Yang, 2017). A klf4 karboxi-terminálisának DNS-kötő szerkezeti régiója van, amely három Cys2His2 (C2H2) típusú cinkujjszerkezetet tartalmaz, amelyeket 81 erősen konzervált aminosav képez. Szabályozza a transzkripciót nagy affinitással a CACCC elemekkel és a GC-ben gazdag célgén DNS-szekvenciákkal (Shields and Yang, 1998; Pearson et al., 2008). A KLF4 DNS-kötő helyeinek többsége a cinkujj régióban található, beleértve az N-terminális transzkripciós aktivációs domént a fehérjék kölcsönhatásához, a C-terminális cinkujj struktúrát a DNS-kötéshez és a transzkripció gátló zónát (Bieker, 2001). A KLF4 számos endogén gén expressziójának szabályozásában vesz részt (Shields and Yang, 1998). A klf4 amino terminálisán nagyon változó transzkripciós szabályozó domén található. A 91 és 117 amino között elhelyezkedő aminosavmaradékok transzkripciós aktivációs domént alkotnak, amely prolinban és szerinben gazdag, míg transzkripciós elnyomó domén is létezik. Ezért a KLF4-nek két káros hatása van: a gén transzkripció aktiválása és gátlása (mégis et al., 1998; Wei et al., 2006).
az embrionális fejlődés során a KLF4 magasabb volt az embrionális fejlődés késői szakaszában. Míg az érett szövetekben és szervekben a KLF4 főleg a gyomor-bél traktusban, a szájüregben, a bőr epidermiszében, a vaszkuláris endotheliumban és a vesében expresszálódik, és kevésbé expresszálódik az agyban (Segre et al., 1999; Ghaleb et al., 2011; Liu et al., 2013; Chen et al., 2015; ő et al., 2015; Bin et al., 2016). Úgy gondolják, hogy jelentős szerepet játszik a sejtproliferáció és a differenciálódás szabályozásában. Ezenkívül a KLF4 szabályozhatja a sejtciklust is. A KLF4 aktiválhatja a P21-et P53-függő módon (Zhang et al., 2000). Ezenkívül azt találták, hogy a KLF4 (–/–) sejtek korábban léptek be az öregedési fázisba, mint a KLF4 (+/+) sejtek, ami a klf4 ( – / – ) sejtek kevésbé antioxidáns génexpressziójával és magasabb reaktív oxigénfajokkal (ros) magyarázható. A ROS növelheti a p53 és a p21 expressziót, és ezt követően elősegítheti a DNS károsodását (Liu C. et al., 2015). Megállapították, hogy a PRMT5 növelheti a klf4 expresszióját a fehérje szintjén. PRMT5 számoltak be, hogy növelje a transzkripció a p21 és csökkenti a bax expresszióját keresztül gátolja KLF4 ubiquitylation (Hu et al., 2015). Ezenkívül számos tanulmány kimutatta, hogy a KLF4 részt vesz a neuronok apoptózisának szabályozásában (Kong et al., 2016; Cui et al., 2017; Song et al., 2018). A KLF4 eddig ismert fiziológiai szabályozó szerepe még mindig kevés, és további vizsgálatokra van szükség.
a KLF4 szerepe az AD-ben
jól megalapozott, hogy az AD-t elsősorban memória és kognitív zavarok, valamint végrehajtó diszfunkció jellemzi (Goedert and Spillantini, 2006). Számos tanulmány kimutatta, hogy a neuronális apoptózis és a szinaptikus diszfunkció a kognitív funkció csökkenésének kóros alapja (Caccamo et al., 2017; Guo et al., 2017; Yoon et al., 2018). A felhalmozódó károsodás, melyet az a-lerakódás, az oxidatív stressz és a vas felhalmozódása okoz, neuronális diszfunkcióhoz és apoptózishoz vezethet az AD-ben szenvedő betegeknél. Számos tanulmány kimutatta, hogy a KLF4 szabályozó szerepe kulcsfontosságúnak tűnik a központi idegrendszerben. Figyelembe véve, hogy a KLF4 a jelentések szerint szabályozza a neuronális apoptózist, a szinaptikus regenerációt, az oxidatív stresszt és a neuroinflammációt, a KLF4 és az AD patogenezise közötti kapcsolat potenciális új célpont lehet az AD kezelésében.
a KLF4 szerepe a Neuroinflammációban
számos klinikai vizsgálat kimutatta, hogy az AD-ben szenvedő betegek agyszövetének extracelluláris lerakódásainak fő alkotóeleme az A, amely károsíthatja a környező szinapszisokat és neuronokat, és neuronális halálhoz vezethet. Az abnormális szekréció vagy a túlzott mértékű termelés az Ad kóros változásaihoz vezet, így a 6db lerakódás az AD központi láncszeme (Rajmohan and Reddy, 2017). Ezenkívül a vizsgálatok kimutatták, hogy a túlzott a-lerakódás stimulálhatja a gliasejteket A ROS és más befolyásoló tényezők kiválasztására, ami oxidatív stresszhez vezet. Ismert volt, hogy az oxidatív stressz stimulálhatja az a termelését. Ezért az A és az oxidatív stressz kölcsönhatásba léphet egymással és befolyásolhatja az AD progresszióját (Cheignon et al., 2018).
a KLF4-et potenciális modulátorként jelentették, és nagy hatással van a gyulladásra a makrofágok és az endothel sejtek közvetítésével (1.ábra) (Yoshida et al., 2014; Kapoor et al., 2015; Yang et al., 2018). A központi idegrendszerben a túlzott és krónikus gyulladásos reakciók a neuron és a neurogliocita károsodását okozhatják. Nemrégiben bebizonyították, hogy a KLF4 expresszió pozitívan Korrelált egy A-val a 62 által kiváltott neuroinflammáció. A mikroglia BV2 sejtekben az oligomer a-A-42 növelheti a KLF4 expressziót, amelyet az aktivált P53 közvetít (Li L. et al., 2017). Gyulladásos körülmények között, mint pl. a .. -felhalmozódás, a gyulladásgátló citokinek felszabadulása stimulálható az AD generálásában (Griffin and Barger, 2010). Neurotoxicitás potencia és pro-inflammatorikus potencia oldható a-A-42 oligomerek viszonylag magasabb, mint az oldhatatlan rost betét (Selkoe, 1991; Weinberg et al., 2018). A KLF4 csendje képes helyreállítani a 642 által közvetített Neuroinflammációt, a KLF4 túlzott expressziója pedig súlyosbíthatja a 42 által közvetített Neuroinflammációt (Li L. et al., 2017). Az a-féle felhalmozódás az asztrociták és a mikroglia aktiválódását idézi elő (Rod-Okguez et al., 2016). Az aktivált asztrociták fokozhatják a neuroinflammációt olyan gyulladásgátló faktorok felszabadításával, mint az IL-1, IL-6 és a TNF-6 (Rubio-Perez and Morillas-Ruiz, 2012; Dom., 2016). A gyulladásos válaszok ördögi köre végül diszfunkcióhoz és neuronális apoptózishoz vezet.
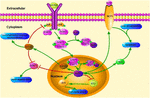
1. ÁBRA. A klf4-hez kapcsolódó jelátviteli utak vázlatosillusztrációja. Ez a szám kiemeli a KLF4 szerepét a neuroprotekcióban és az axon regenerációban. Az ábrán látható nyilak az aktiválást vagy a promóciót, az egyenes vonalak pedig a kapcsolódó gátlást jelzik. KLF4, Kruppel-szerű faktor 4; STAT3, jelátalakító és a transzkripció aktivátora 3; JAK, Janus kináz; SOCS3, a citokin signaling 3 szuppresszora; HCP1, hem hordozó fehérje 1; ERK5, mitogén-aktivált protein kináz 5.
a KLF4 döntő szerepet játszik a gyulladásgátló jelek szabályozásában. A gliasejtekben a gemfibrozil által indukált KLF4 aktiváció növeli a citokin 3 jel (SOCS3) szuppresszorát a PI3-kináz-AKT útvonalon keresztül (Ghosh and Pahan, 2012). A KLF4 siRNS által közvetített leütése csökkentheti az egerek asztroglia és mikroglia SOC szintjét, ami később befolyásolhatja a gyulladásos gén expresszióját (Kaushik et al., 2010; Ghosh és Pahan, 2012). Ezenkívül a SOCS deléció elősegítheti a sérült neuronok túlélését és elősegítheti az axon regenerálódását (Smith et al., 2009; Sun et al., 2011). A KLF4 pedig pozitívan szabályozza az IL-1-es (vagy más gyulladásgátló) markerek termelődését. Pozitívan szabályozza a ciklooxigenáz-2-t (Cox-2), és negatívan szabályozza az indukálható nitrogén-monoxid-szintázt (Inos) (Kaushik et al., 2013). Ezenkívül a KLF4 fontos szabályozó tényező a monocita differenciálódásban és az immunszabályozás potenciális célpontja (Alder et al., 2008). Ezért a KLF4 elősegítheti a neuroinflammációt ezen negatív szabályozók szabályozásával.
érdemes megemlíteni, hogy a Parkinson-kór modelljében a KLF4 elősegítheti az MPP+által kiváltott oxidatív stresszt és neurotoxicitást, majd növelheti a neuronális apoptózist és késleltetheti a sejtproliferációt (Chen et al., 2013). Az oxidatív stressz a peroxidáció és az antioxidáció közötti egyensúlyhiány. A szabad gyökök változásokat okozhatnak a különböző makromolekulákban, ami sejtkárosodáshoz, sejtöregedéshez és szövetkárosodáshoz vezethet (Parajuli et al., 2013; Nie et al., 2015). Az oxidatív stressz súlyosbíthatja a korai gyulladást és az a-termelést, majd súlyosbíthatja az AD-t (Cai et al., 2011). Ezért a KLF4 részt vehet az AD oxidatív stresszében.
ezek az eredmények arra utalnak, hogy a KLF4 kulcsszerepet játszik a neuroinflammáció közvetítésében a mikroglia aktiválásával, következésképpen a gyulladásgátló citokinek felszabadulásával. Potenciálisan fokozza a neuroinflammációt. Eddig számos tanulmány az AD patogeneziséről a neuroinflammációra összpontosított. Az immunszabályozás potenciális célpontjaként a KLF4 elősegítheti a mikroglia gyulladásos válaszait a kapcsolódó negatív szabályozók befolyásolásával, ami nagy hatással van az AD kialakulására.
a KLF4 szerepe az Apoptózisban
a neurodegeneratív változások közé tartozik a neuronok és szinapszisok fokozatos elvesztése a reprezentatív agyi régiókban, például az agykéregben, a hippokampuszban és más szubkortikális régiókban. A neuronális veszteség által kiváltott központi idegrendszeri funkcionális károsodások állandóak (Citron, 2010). A tartós oxidatív stressz neuronális apoptózishoz vezethet (Wu et al., 2010). Számos tanulmány megerősítette, hogy az AD szorosan kapcsolódik az oxidatív stresszhez (Lee et al., 2012; Yui et al., 2015). Megállapítást nyert, hogy a krónikus oxidatív stressz fokozhatja a foszfolipáz A2 csoport 3 (Pla2g3) expresszióját az asztrocitákban, és megzavarhatja az A-egyensúlyt, következésképpen AD kialakulásához vezethet (Yui et al., 2015).
számos tanulmány kimutatta, hogy a KLF4 fontos szerepet játszik az oxidatív stressz kialakulásának gátlásában (Shi et al., 2014; Liu C. et al., 2015). Megállapították, hogy a KLF4 elősegítheti a H2O2 által kiváltott sejtek apoptózisát, ezt a hatást valószínűleg a megnövekedett bax expresszió és a csökkent bcl-2 expresszió okozza (Li et al., 2010). A kvercetin csökkentheti a KLF4 expressziót a humán neuroblastoma SH-SY5Y sejtekben, és növelheti a bcl-2/bax Arány expresszióját. Ezenkívül a kvercetin mérsékelheti az SH-5ysy sejt apoptózisát és csökkentheti a kaszpáz – 3 enzim aktivitását (Xi et al., 2012). Egy nemrégiben készült tanulmány a mitogén-aktivált fehérje (MAP) kináz 5 (ERK5) neuroprotektív hatását vizsgálta az oxidatív stressz ellen. Az ERK5 aktiválása részben csökkentheti a H2O2 által kiváltott hippokampusz neuronok halálát, és növelheti az NGF és PC által kiváltott neuroprotekciót (Su et al., 2014). Nils et al. a MEK5 mutánsát (MEK5D) használta az ERK5-aktivált transzkripció és funkcionális válaszok tanulmányozására emberi endothel sejtekben, és azonosította a KLF4-et egy új ERK5 célpont (Ohnesorge et al., 2010). Megállapították, hogy a KLF4 túlzott expressziója elnyomhatja a TNF által közvetített gyulladásos válaszokat, és csökkentheti a leukocyta adhéziót és a bazális sejtes apoptózist. Ezek az eredmények megerősítik, hogy a KLF4 gyulladáscsökkentő és anti-apoptotikus tulajdonságokkal rendelkezik (Ohnesorge et al., 2010). A későbbi kísérletek kimutatták, hogy az agyi cavernous malformation 1 (CCM1) eltűnése az endothel sejtekben aktiválja az ERK5-et a MEKK3-MEK5 jelútvonalon keresztül, és növeli a KLF4 expressziót (Cuttano et al., 2016). Az ERK5 közvetítő szerepet játszik az előkondicionálásban (PC) és az idegnövekedési Faktorban (NGF)-szabályozza a KLF4 expresszióját (Su et al., 2014). Ezenkívül a KLF4 RNAi által közvetített leütése szintén csökkentheti az NGF vagy a PC által kiváltott neuroprotekciót. A KLF4 túlzott expressziója magasabb bcl-2/bax arányhoz vezet a H2O2-stresszelt sejtekben (Su et al., 2014). A túlexpresszált KLF4 felgyorsítja a Bcl-2 és a bax változásait a megfelelő promóterrel (Li et al., 2010). ERK5 / KLF4 kaszkád működhet, mint egy pivot különböző utak, amelyek védik a neuronok oxidatív stressz okozta halál (Su et al., 2014).
az oxidatív stresszt számos degeneratív betegséggel szorosan összefüggőnek tekintik. A KLF4 jelentős szerepet játszik az oxidatív stressz genomiális stabilitásának fenntartásában. A KLF4 és ERK5 együttesen védik a neuronokat az oxidatív stressz okozta apoptózistól. Ezért a KLF4 terápiás célpontként működhet az oxidatív stressz ellen, amikor aktiválódik. Beszámoltak arról, hogy a sztatin gyógyszerek aktiválhatják az ERK5-et, ami a KLF4 és a függő gének expressziójához vezet (Ohnesorge et al., 2010), de a mechanizmus továbbra sem tisztázott, és a KLF4-hez kapcsolódó upstream és downstream célgéneket kevésbé tanulmányozzák az oxidatív stresszben, további vizsgálatokra van szükség.
a KLF4 szerepe az Axonregenerációban
a korai axonvesztés a neurodegeneratív betegségek közös jellemzője. Az AD szinaptikus vesztesége és közlekedési károsodása kognitív károsodást okozhat (Holtzman et al., 2011; Coleman, 2013). A deklaratív memória károsodásának mértéke összefügg a hippokampusz és a kéreg szinaptikus sűrűségével. Az oldható a-ons oligomerek csökkentik a glutamát felvételét és elősegítik a szinaptikus diszfunkciót, megzavarva a szinaptikus plaszticitást (Li et al., 2009). Ezért különösen fontos megvizsgálni, hogyan lehet javítani az axonokat a központi idegrendszerben. A retina ganglionsejtjeiben az axonok erősen képesek növekedni és regenerálódni a korai fejlődés során, de a felnőtt Emlősök központi idegrendszerében az axonok elveszítik regenerációs képességüket, és a neuronok elhalhatnak vagy atrófiát okozhatnak (Goldberg and Barres, 2000; Goldberg et al., 2002).
a KLF4 fontos szerepet játszik az axon növekedésének gátlásában. Az embrionális RGC-kben a KLF4 túlzott expressziója csökkentheti a neurit megnyúlásának százalékos arányát, az axonok és a dendritek hosszát, valamint a neurit elágazását. Ezenkívül azt találták, hogy a KLF4 túlzott expressziója csökkentheti a hosszú távú postnatalis axon növekedési rátákat, de nem csökkentette a rövid távú axon növekedési rátákat (Moore et al., 2009; Steketee et al., 2014). Későbbi vizsgálatok azt találták, hogy a KLF4–cKO egerek axonkötegei vastagabbak voltak, mint a kontroll egerek (Fang et al., 2016). Ezenkívül a KLF4 expresszió eltávolítása a fejlődés során növelheti a felnőtt RGC-k reproduktív potenciálját. Ezenkívül a c-terminális DNS-kötő domén nélküli KLF4 nem volt hatással az axon növekedésére. Nem volt hatással a sejtek túlélésére, miután a retina ganglionsejtek megsérültek, ha a KLF4 kiütötte (Moore et al., 2009).
a KLF4 az axonális regenerációt is befolyásolhatja. Egy nemrégiben készült tanulmány arról számolt be, hogy a klf4 expresszió csökkenése felnőtt retina ganglionsejtekben elősegítette az axon regenerálódását a JAK-STAT3 útvonalon keresztül (Qin et al., 2013). A KLF4 növelte a STAT3 foszforilációját, és Jak-STAT jelátvitel útján szabályozta az axon növekedését (Qin and Zhang, 2012). A citokinek kezelése során a STAT fehérjecsalád tagjait a sejten belüli karboxi-terminális tirozin és szerin helyeken foszforilálják, hogy stabil dimert képezzenek. Ez a módosítás fokozza a sejthez kapcsolódó gének transzkripcióját (Yuan et al., 2005). A klf4 és a STAT3 közötti kölcsönhatás a tirozin705 citokin által indukált foszforilációján gátolja a STAT3 expresszióját azáltal, hogy gátolja a STAT3 DNS-hez való kötődését (Qin et al., 2013). A KLF4 leütése nyilvánvalóan javítja az axon regenerálódását a retina ganglionsejtekben a látóideg sérülése után, és megakadályozza az ideg sérülését enyhe agyi sérülés után. A hatásokat a p-p53 csökkenése és a pSTAT3 szint emelkedése közvetíti. A KLF4 pozitívan szabályozza a neuronális apoptózist a p53 és a JAK-STAT3 útvonalakon keresztül, és a KLF4 negatívan szabályozza az axonális javítást a JAK-STAT3 útvonalon keresztül (Cui et al., 2017).
ezért feltételeztük, hogy az AD-ben az axonális regeneráció megvalósítható a KLF4 expressziójának megváltoztatásával vagy az intracelluláris kapcsolódó jelátviteli utak megváltoztatásával, valamint az AD progressziójának szabályozásával a hiányzó axonok csökkentésével vagy az axonális diszfunkció csökkentésével. A KLF4 transzkripciós faktor potenciális terápiákban történő alkalmazásának módja azonban még további feltárást igényel.
a KLF4 szerepe a vas felhalmozódásában
a vas széles körben megtalálható a biológiai rendszerekben, a vashoz kapcsolódó metalloproteinázok kulcsszerepet játszanak az oxigén szállításában, az elektronok átvitelében és a biokémiai reakciók katalizálásában (Aisen et al., 2001). A normál fiziológiai tartományon túli vasfelesleg azonban károsíthatja az emberi egészséget (Adlard and Bush, 2006). Tanulmányok kimutatták, hogy a hippokampusz vastartalma negatívan korrelál a memóriatesztek teljesítményével (Ding et al., 2009). A megnövekedett vasterhelés az agyban felgyorsítja az a képződését a plakkok és hiperfoszforilált tau gubancok, miközben fokozza az oxidatív stresszt (Peters et al., 2015). A vas, amely nagyfokú permeabilitással rendelkezik, elősegíti az idegnövekedést és a sejtek közötti kapcsolatokat az agy fejlődése során (Dallman és Spirito, 1977).
egy nemrégiben készült tanulmány kimutatta, hogy a fiziológiai stressz a KLF4-HCP1 jelátviteli út aktiválódását és a megnövekedett hem felvételét okozta (Li H. et al., 2017). A Hem az emberi test funkcionális vasának 95% – át teszi ki. Ez a hem oxigenáz egyik fő összetevője (Hooda et al., 2014; Kurucz et al., 2018). Az oxigénáz-1 aktivitásának növelése késleltetheti az öregedő agy oxidációját (Verdile et al., 2015; Serini és Calviello, 2016; Kurucz et al., 2018). Ez enyhítő hatással van az AD-re. A fiziológiai stressz indukálja a glükokortikoid szint emelkedését, a glükokortikoid növeli a hem hordozó fehérje 1 (HCP1) expresszióját a KLF4-en keresztül, majd a HCP1 elősegíti a hem felvételét (Li H. et al., 2017). A glükokortikoid és a KLF4 együttesen szabályozzák a gyulladásgátló géneket, és az alacsony glükokortikoid tartalmú sejtek nem képesek teljes mértékben indukálni a KLF4 expressziót (Sevilla et al., 2015). A klf4 által kiváltott hembevitel növekedése vas felhalmozódásához vezet az agyban. A vas elősegíti a ROS felszabadulását (Tronel et al., 2013). A vas elem fokozza az agyi oxidatív stresszt patkányokban pszichológiai stressz alatt (Yu et al., 2011). Ezért a HCP1 szabályozható a KLF4 és a glükokortikoid együtt. A HCP1 növelése fokozza a hem felvételét, ami közvetlenül a vas felhalmozódásához vezet az agyban, súlyosbítja az oxidációt, fokozza az apoptózist vagy a diszfunkciót, és súlyosbítja az agykárosodást.
általánosan elfogadott, hogy a memória és a tanulási zavar az AD fő tünetei. Számos klinikai adat kimutatta, hogy a plakk terhelés és a vas felhalmozódása válasz a tanulási és kognitív diszfunkció kialakulására AD-ben (van Bergen et al., 2018). A közelmúltban közzétett adatok azt sugallták, hogy a nagy dózisú vas növeli a .. lerakódást és gyengíti a tanulást és a memóriát egerekben (Guo et al., 2013). Klinikai vizsgálatok kimutatták, hogy vastartalmú mikroglia található az AD betegek hippokampuszában mágneses rezonancia képalkotás alatt (Zeineh et al., 2015). A mikroglia vasat szerez átadó vagy nem átadó, extracelluláris és intracelluláris forrásokból (McCarthy et al., 2018). Szelektív és tartós KLF4 expresszió indukálható az ischaemiás hippocampus reaktív asztrociták magjában és citoplazmájában (Park et al., 2014). Tanulmányok kimutatták, hogy a KLF4 transzkripciós represszorként működik. Lefelé szabályozza az ELK-3 expresszióját, majd az ELK-3 gátolja a HO-1 expresszióját (Tsoyi et al., 2015). A hem oxigenáz-1 (HO-1) egy stresszfehérje, amely a hemet bilirubinra, szabad vasra és szén-monoxidra bontja. A HO-1 szabályozása az asztrocitákban abnormális vaslerakódáshoz és mitokondriális diszfunkcióhoz vezethet az agyban, ami csökkent kognitív képességhez vezet (Schipper, 1999, 2004). Ezért a KLF4 részt vehet az asztrocitákban a vas felhalmozódásának folyamatában, súlyosbítva az AD oxidációját és súlyosbítva az agykárosodást.
következtetés
a KLF4 köztudottan kulcsszerepet játszik a sejtproliferáció, az apoptózis és a differenciálódás szabályozásában. Korábbi tanulmányok a KLF4 szabályozására összpontosítottak számos fontos neurofiziológiai folyamatban, beleértve a neuroinflammációt, a neuroprotekciót és a szinaptikus regenerációt. Nemrégiben kiderült, hogy a KLF4 fontos szerepet játszik az AD patogenezisében. Ebben a cikkben áttekintjük a KLF4 szerepét a neuroprotekcióban és a neurogenezisben az AD-ben.
a KLF4 nemcsak a sejtproliferáció és differenciálódás szabályozója, hanem az immunválasz szabályozásának potenciális célpontja is. A KLF4 szabályozhatja a negatív gyulladásos faktorokat, elősegítheti a gyulladásos választ, és nagy hatással van az asztrocita nukleáris mikroglia expressziójára. Ezenkívül a KLF4 és ERK5 együttesen neuroprotektív hatásokat fejthetnek ki. Ezenkívül az axonregeneráció megvalósítható specifikus transzkripciós faktorok, intracelluláris inhibitorok tartalmának megváltoztatásával vagy intracelluláris jelátviteli utak megváltoztatásával. A KLF4 kiütése javíthatja az axon regenerálódását és felgyorsíthatja az axon növekedési ütemét. A KLF4 expresszió csökkentése elősegíti az axon regenerálódását a JAK-STAT3 útvonalon,a KLF4 pedig a JAK-STAT3 utat a további axonregenerációhoz. Ezért a KLF4 részt vehet a gyulladásgátló, anti-apoptózis, az axon regeneráció és a vas felhalmozódása a központi idegrendszerben, amely kulcsszerepet játszik az AD generációban. Ezek az eredmények arra utalnak, hogy a KLF4 potenciális terápiás célpontot jelent az AD számára. A klf4 AD-re gyakorolt hatásának mély sejtes és molekuláris mechanizmusai azonban továbbra sem tisztázottak, és további vizsgálatokra van szükség.
szerzői hozzájárulások
ZQC, XHZ és YJ írta a kéziratot. SHG és JYL módosította a kézirat keretét. A BJL és az RJC biztosította a kritikus felülvizsgálatokat. Minden szerző jóváhagyta a kézirat végleges változatát benyújtásra.
finanszírozás
ezt a munkát a kínai Természettudományi Alapítvány (NSFC) (81871070, 31571126, 31471120) és a Jilin tudományos és technológiai Ügynökség finanszírozása (20180519003jh, 20180414051gh, 20170414034gh és 20180414050gh).
összeférhetetlenségi nyilatkozat
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
Cacabelos, R. (2018). Volt-e javulás az Alzheimer-kór gyógyszerfelfedezésében az elmúlt 5 évben. Felh. Opin. Drog Discov. 13, 523–538. doi: 10.1080/17460441.2018.1457645
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Liu, Y., Shi, J. és Chen, X. (2015). A szezonális allergiás rhinitis új célpontjainak azonosítása a pollenszezon alatt és azon kívül mikroarray elemzéssel. Acta Otolaryngol. 135, 1330–1336. doi: 10.3109/00016489.2015.1067906
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Serini, S. és Calviello, G. (2016). Az oxidatív/nitrozatív stressz csökkentése az agyban és annak részvétele az N-3 PUFA neuroprotektív hatásában Alzheimer-kórban. Curr. Alzheimer Res. 13, 123-134. doi: 10.2174/1567205012666150921101147
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós