adagolási forma: aeroszol, hab
orvosilag felülvizsgálta Drugs.com. Utoljára frissítve szeptember 1, 2019.
- áttekintés
- mellékhatások
- adagolás
- szakmai
- terhesség
- több
- javallatok és használat ketokonazol hab
- ketokonazol hab Adagolás és alkalmazás
- adagolási formák és hatáserősségek
- Ellenjavallatok
- figyelmeztetések és óvintézkedések
- Kontakt szenzibilizáció
- gyúlékony tartalom
- szisztémás hatások
- mellékhatások
- klinikai vizsgálati tapasztalatok
- dermális biztonságossági vizsgálatok
- forgalomba hozatalt követő tapasztalatok
- alkalmazás specifikus populációkban
- terhesség
- szoptatás
- reproduktív potenciállal rendelkező nők és hímek
- gyermekgyógyászati alkalmazás
- geriátriai alkalmazás
- ketokonazol hab leírás
- ketokonazol hab – Klinikai farmakológia
- hatásmechanizmus
- farmakodinamika
- farmakokinetika
- mikrobiológia
- nem klinikai toxikológia
- karcinogenezis, mutagenezis, fertilitás károsodás
- klinikai vizsgálatok
- hogyan szállítva / tárolás és kezelés
- Betegtanácsadási információk
- használati utasítás
- betegtájékoztató
- csomag/címke fő kijelző PANEL – karton
- További információ a ketokonazolról)
- Consumer resources
- Professional resources
- Related treatment guides
javallatok és használat ketokonazol hab
ketokonazol Hab, 2% javallt seborrheás dermatitis helyi kezelésére immunkompetens 12 éves vagy annál idősebb betegeknél.
alkalmazási korlátozások
a 2% – os ketokonazol hab biztonságosságát és hatásosságát gombás fertőzések kezelésére nem igazolták.
ketokonazol hab Adagolás és alkalmazás
ketokonazol Hab, 2% – ot kell alkalmazni az érintett terület(ek) re naponta kétszer, négy héten keresztül.
tartsa a tartályt függőlegesen, és öntsön 2% ketokonazol habot a doboz kupakjába vagy más hűvös felületbe olyan mennyiségben, hogy az ellepje az érintett terület(ek) et. Nem ajánlott közvetlenül a kezekre adagolni, mivel a hab meleg bőrrel érintkezve azonnal megolvad. Vegyen fel kis mennyiségű ketokonazol habot, 2% – ot az ujjaival, és óvatosan masszírozza be az érintett terület(ek) be, amíg a hab eltűnik. A haj-hordozó területeken, részben a haj, úgy, hogy ketokonazol Hab, 2% lehet alkalmazni közvetlenül a bőrre (nem pedig a haj).
kerülni kell a szembe vagy más nyálkahártyára jutást. Ketokonazol Hab, 2% nem szemészeti, orális vagy intravaginális alkalmazásra.
adagolási formák és hatáserősségek
ketokonazol Hab, 2% 20 mg ketokonazolt tartalmaz, USP / gramm, 50 g-os és 100 g-os tartályban.
Ellenjavallatok
Nincs.
figyelmeztetések és óvintézkedések
Kontakt szenzibilizáció
ketokonazol Hab, 2% kontakt szenzibilizációt okozhat, beleértve a fotoallergén hatást is.
gyúlékony tartalom
a ketokonazol hab tartalma, 2%, tartalmaz alkoholt és propánt/butánt, amelyek gyúlékonyak. Kerülje a tüzet, a lángot és / vagy a dohányzást az alkalmazás alatt és közvetlenül azt követően. Ne szúrja át és / vagy égesse el a tartályokat. Ne tegye ki a tartályokat hőhatásnak és / vagy ne tárolja 120 6 (49} C) feletti hőmérsékleten.
szisztémás hatások
szájon át adott ketokonazol esetén hepatitist észleltek (1:10 000 jelentett előfordulási gyakoriság). Csökkent tesztoszteron–és ACTH-indukált kortikoszteroid szérumszinteket figyeltek meg a szájon át adott ketokonazol nagy dózisai esetén. Ezeket a hatásokat lokális ketokonazollal nem figyelték meg.
mellékhatások
klinikai vizsgálati tapasztalatok
mivel a klinikai vizsgálatokat nagyon eltérő körülmények között végzik, a gyógyszer klinikai vizsgálataiban megfigyelt mellékhatások aránya nem hasonlítható össze közvetlenül egy másik gyógyszer klinikai vizsgálataiban megfigyelt arányokkal, és nem feltétlenül tükrözi a gyakorlatban megfigyelt arányokat. A klinikai vizsgálatokból származó mellékhatásokra vonatkozó információk azonban alapul szolgálnak a kábítószer-használattal összefüggőnek tűnő mellékhatások azonosításához és az arányok közelítéséhez.
az 1.táblázatban bemutatott biztonságossági adatok a ketokonazol hab expozícióját tükrözik, 2% 672, 12 éves vagy annál idősebb, seborrheás dermatitisben szenvedő beteg esetében. Az alanyok ketokonazol habot, 2% – ot vagy vivőhabot alkalmaztak naponta kétszer 4 héten keresztül az arc, a fejbőr és/vagy a mellkas érintett területein. A betegek > 1% – ánál előforduló mellékhatásokat az 1.táblázat mutatja be.
1. táblázat: A klinikai vizsgálatok során >1% – ban jelentett mellékhatások
|
mellékhatások |
ketokonazol Hab, 2% N=672 n (%) |
Járműhab N=497 n (%) |
|
nemkívánatos reakcióval rendelkező betegek |
188 (28%) |
122 (25%) |
|
égő érzés az alkalmazás helyén |
67 (10%) |
49 (10%) |
|
az alkalmazás helyén fellépő reakció |
41 (6%) |
24 (5%) |
az alkalmazás helyén fellépő reakciók, melyeket a betegek <1% – ánál jelentettek, szárazság, erythema, irritáció, paraesthesia, pruritus, bőrkiütés és melegség voltak.
dermális biztonságossági vizsgálatok
egy fotoallergenitási vizsgálatban 9 53 alany (17%) reagált a provokációs periódus alatt mind a besugárzott, mind a nem besugárzott helyeken ketokonazol habbal kezelve, 2%. Ketokonazol Hab, 2% kontakt szenzibilizációt okozhat.
forgalomba hozatalt követő tapasztalatok
a ketokonazol hab forgalomba hozatalt követő alkalmazása során a következő mellékhatásokat azonosították, 2%:
emésztőrendszeri betegségek és tünetek: Cheilitis
általános tünetek, az alkalmazás helyén fellépő reakciók: fájdalom és égés az alkalmazás helyén
a bőr és a bőr alatti szövet betegségei és tünetei: Bőrégető érzés és erythema
mivel ezeket az eseményeket egy bizonytalan méretű populációból önként jelentik, nem mindig lehet megbízhatóan megbecsülni gyakoriságukat vagy ok-okozati összefüggést megállapítani a gyógyszer-expozícióval.
alkalmazás specifikus populációkban
terhesség
kockázati összefoglaló
nem állnak rendelkezésre adatok a ketokonazol Hab 2%-os terhes nőknél történő alkalmazásáról a súlyos születési rendellenességek, vetélés vagy kedvezőtlen anyai vagy magzati következmények gyógyszerrel összefüggő kockázatának azonosítására. Állatokon nem végeztek reprodukciós vizsgálatokat 2% – os ketokonazol habbal. Vemhes egerekkel, patkányokkal és nyulakkal végzett állatokon végzett reprodukciós vizsgálatokban embriotoxikus és fejlődési hatásokat (szerkezeti rendellenességeket) figyeltek meg a ketokonazol organogenezis során történő orális adagolását követően. Feltételezve, hogy a helyi és orális ketokonazol dózisok és a ketokonazol hab egyenértékű szisztémás felszívódása, a maximális ajánlott humán dózis (MRHD) 2% – a 8 gramm (ami 160 mg ketokonazolnak felel meg), az mrhd 0,8-2,4-szerese mellett embriotoxikus hatásokat, 4-nél pedig fejlődési hatásokat figyeltek meg.Az MRHD 8-szorosa .
a jelentős születési rendellenességek és vetélés háttérkockázata a jelzett populációban nem ismert. Minden terhességnél fennáll a születési rendellenesség, veszteség vagy egyéb káros következmények kockázata. Az Egyesült Államok Általános populációjában a klinikailag elismert terhességekben a súlyos születési rendellenességek és a vetélés becsült háttérkockázata 2-4%, illetve 15-20%.
adatok
állatokra vonatkozó adatok
a humán expozíciós számítások állati többszörösei az állatoknak adott orális adagok és a ketokonazol Hab 2% – os maximális ajánlott humán dózisának (MRHD) 8 g-os összehasonlításán alapulnak (ami 2, 67 mg ketokonazolnak/kg/nap 60 kg-os egyénnél vagy 98, 8 mg ketokonazolnak/m2/nap-nak felel meg).
egereken, patkányokon és nyulakon orálisan alkalmazott ketokonazollal Embriofetális fejlődési vizsgálatokat végeztek. Egereknek a 6-18. terhességi napon (az organogenezis időszakát lefedve) orálisan adva a ketokonazol embriotoxikus volt (25 mg/kg vagy magasabb; a testfelszín összehasonlításai alapján az MRHD 0,8-szorosa), magas reszorpció előfordulási gyakorisággal, megnövekedett halvaszületések számával és késleltetett szüléssel. Az érés késleltetését is megfigyelték. 50 mg/ttkg-ig (a testfelszín összehasonlításai alapján az MRHD 1, 5-szerese) nem volt bizonyíték anyai toxicitásra vagy malformációkra. 10 mg/ttkg (a testfelszín összehasonlításai alapján az MRHD 0, 3-szorosa) alkalmazásakor nem figyeltek meg kezeléssel összefüggő fejlődési hatásokat.
patkányokban anyai toxicitás jelenlétében a szájon át adott ketokonazol embriotoxikus volt (40 mg/ttkg és magasabb; a BSA összehasonlítások alapján számított MRHD 2,4-szerese), beleértve a megnövekedett reszorbeált magzatokat és halvaszületéseket, valamint teratogén (80 mg/ttkg és magasabb; a BSA összehasonlítások alapján számított MRHD 4,8-szorosa), beleértve a Syndactyliát, oligodactyliát, hullámosított bordákat és szájpadhasadékot. Ezenkívül 100 mg/kg (a testfelszín összehasonlításai alapján az MRHD 6-szorosa) ketokonazol szájon át, egyetlen napon a terhesség alatt (9-12.terhességi nap) embriotoxikus volt (fokozott reszorpció). Ugyanez a 12., 13., 14. vagy 15. terhességi napon adott orális adag külső malformációkat, köztük szájpadhasadékot, mikroméliát és digitális rendellenességeket (brachydactyly, ectrodactyly, syndactyly) váltott ki.
vemhes nyulakban szájon át adott ketokonazolt 10 mg/ttkg (a testfelszín összehasonlításai alapján az MRHD 1,2-szerese) és magasabb dózis mellett embriotoxicitásra (fokozott reszorpció) utaló bizonyítékot figyeltek meg, valamint 40 mg/ttkg dózisnál (a testfelszín összehasonlításai alapján az MRHD 4,8-szerese) a csontrendszeri rendellenességek gyakoribb előfordulását figyelték meg.
szoptatás
kockázati összefoglaló
nem áll rendelkezésre információ a ketokonazol emberi anyatejben való jelenlétéről, a szoptatott gyermekre gyakorolt hatásokról vagy a ketokonazol hab helyi alkalmazása utáni tejtermelésre gyakorolt hatásokról, 2% szoptató nőknél. Állatkísérletekben orális alkalmazást követően ketokonazolt találtak az anyatejben. Figyelembe kell venni a szoptatás fejlődési és egészségügyi előnyeit, valamint az anya klinikai szükségességét a ketokonazol Habra, 2% – ra és a szoptatott csecsemőre gyakorolt esetleges káros hatásokat a ketokonazol Habra, 2% – ra vagy a mögöttes anyai állapotra.
reproduktív potenciállal rendelkező nők és hímek
meddőség
patkányokon és kutyákon végzett fertilitási vizsgálatokban a ketokonazol 3 napos és 3 hónapos periódusok közötti orális adagolása reverzíbilis meddőséget eredményezett .
gyermekgyógyászati alkalmazás
a ketokonazol hab biztonságosságát és hatékonyságát, 2% – ot 12 évesnél fiatalabb gyermekgyógyászati betegeknél nem igazolták.
a ketokonazol habbal kezelt 672 beteg közül 2% a klinikai vizsgálatokban 44 (7%) volt 12-17 éves. .
geriátriai alkalmazás
a ketokonazol habbal kezelt 672 beteg közül 2% a klinikai vizsgálatokban 107 (16%) 65 éves vagy annál idősebb volt.
a ketokonazol habbal végzett klinikai vizsgálatok 2% – ában nem vettek részt elegendő számú 65 éves vagy annál idősebb vizsgálati alany annak megállapításához, hogy másképp reagálnak-e, mint a fiatalabb vizsgálati alanyok.
ketokonazol hab leírás
ketokonazol Hab, 2% 2% ketokonazol USP-t, gombaellenes szert tartalmaz termolabil hidroetanolos habban helyi alkalmazásra.
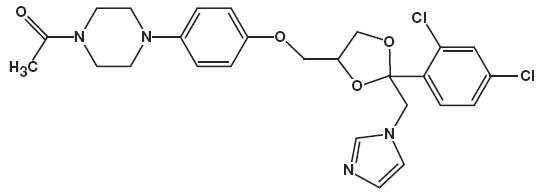
a ketokonazol kémiai neve piperazin, 1-acetil-4 – metoxi]fenil] -, cisz-c26h28ci2n4o4 molekuláris képlettel, molekulatömege 531,43.
a kémiai szerkezet a következő:
a ketokonazol Hab, 2% 20 mg ketokonazolt tartalmaz grammonként egy termolabil hidroetanolos habhordozóban, amely cetil-alkoholt, citromsavat, 58%-os etanolt (terc-butil-alkohollal és brucin-szulfáttal denaturált), poliszorbát 60-at, kálium-citrátot, propilénglikolt, tisztított vizet és szénhidrogén (propán/bután) hajtóanyaggal nyomás alatt álló sztearil-alkoholt tartalmaz.
ketokonazol hab – Klinikai farmakológia
hatásmechanizmus
a ketokonazol hatásmechanizmusa a seborrheás dermatitis kezelésében nem ismert.
farmakodinamika
a ketokonazol hab farmakodinamikáját, 2% – át nem igazolták.
farmakokinetika
egy biohasznosulási vizsgálatban 12, közepesen súlyos vagy súlyos seborrheás dermatitisben szenvedő alany 3 g ketokonazol habot alkalmazott, 2% – ot naponta kétszer 4 héten keresztül. A ketokonazol keringő plazmaszintje < 6 ng/mL volt a betegek többségénél (75%), egy betegnél legfeljebb 11 ng/mL volt megfigyelhető.
mikrobiológia
a ketokonazol egy gombaellenes szer, amely gátolja az ergoszterin, a Malassezia furfur sejtmembránjában kulcsfontosságú szterin in vitro szintézisét. A gombaellenes aktivitás klinikai jelentősége a seborrheás dermatitis kezelésében nem ismert.
nem klinikai toxikológia
karcinogenezis, mutagenezis, fertilitás károsodás
hosszú távú állatkísérleteket nem végeztek a 2%-os ketokonazol hab karcinogén vagy Foto-karcinogén potenciáljának értékelésére.
egereken (18 hónap) és patkányokon (24 hónap) végzett orális karcinogenitási vizsgálatokban a ketokonazol 5, 20 és 80 mg/ttkg/nap dózisban nem volt karcinogén. A magas dózis ezekben a vizsgálatokban a testfelszín összehasonlításai alapján az MRHD körülbelül 2, 4-4, 8-szorosa volt. Bakteriális reverz mutációs vizsgálatban a ketokonazol nem mutatott mutagén potenciált. Három in vivo vizsgálatban (testvérkromatidcsere emberben, domináns letális és micronucleus tesztek egerekben) a ketokonazol nem mutatott genotoxikus potenciált.
állatkísérletekben az orális ketokonazol dózis-és időtartamfüggő módon rontotta mind a hím, mind a nőstény patkányok fertilitását. Nőknél a 40 mg/ttkg-ig terjedő orális adagok (a BSA összehasonlítások alapján az MRHD 2,4-szerese) nem befolyásolták a termékenységet, míg a 75 mg/ttkg-os (a BSA összehasonlítások alapján az MRHD 4,5-szerese) és a magasabb dózisok csökkentették a vemhesség arányát és az implantációs helyek számát. Hím patkányokban 200 mg/ttkg/nap (a testfelszín összehasonlításai alapján az MRHD 12-szerese) per os adagolása három napig csökkentette a fertilitást és 400 mg/ttkg/nap (a testfelszín összehasonlításai alapján az MRHD 24-szerese) három napig a fertilitás teljes elvesztését eredményezte. Hosszabb ideig (legfeljebb 3 hónapig) alkalmazva hím patkányokban csökkent fertilitást figyeltek meg napi 24 mg/ttkg dózisok mellett (a testfelszín összehasonlításai alapján az MRHD 1, 4-szerese). Hím Beagle kutyáknál 25 mg/kg/nap ketokonazol orális adag legfeljebb 4 hétig (5.Az MRHD 2-szerese a BSA összehasonlítások alapján) csökkent spermium motilitást, csökkent spermaszámot, megnövekedett abnormális spermiumot és a herék atrófiáját eredményezte. A kezelés abbahagyását követően ezek a hatások megszűntek.
klinikai vizsgálatok
a ketokonazol hab biztonságosságát és hatásosságát egy randomizált, kettős-vak, vivőanyag-kontrollos vizsgálatban értékelték 12 éves vagy annál idősebb, enyhe vagy súlyos seborrheás dermatitisben szenvedő betegeken. A vizsgálatban 427 vizsgálati alany kapott ketokonazol habot, 2% – uk és 420 vizsgálati alany kapott vivőhabot. Az alanyok ketokonazol habot, 2% – ot vagy vivőhabot alkalmaztak naponta kétszer 4 héten keresztül az arc, a fejbőr és/vagy a mellkas érintett területein. A betegség teljes súlyosságát az erythema, a hámlás és az induratio tekintetében a vizsgálat megkezdésekor és a 4.héten egy 5 pontos vizsgáló Static Global Assessment (ISGA) skálán értékelték.
a kezelés sikerességét úgy határozták meg, hogy a 4.héten (a kezelés végén) elért ISGA-pontszám 0 (tiszta) vagy 1 (a léziók többségénél a skálázás, az erythema és az induratio egyedi pontszáma átlagosan 1 ) és a kiindulási értékhez képest legalább két fokú javulás érhető el. Az eredményeket a 2. táblázat tartalmazza. Az adatbázis nem volt elég nagy ahhoz, hogy felmérje, vannak-e különbségek az életkor, a nem vagy a faji alcsoportok hatásaiban.
2. táblázat: Hatékonysági eredmények
|
tantárgyak száma |
ketokonazol Hab, 2% N = 427 n (%) |
Járműhab N = 420 n (%) |
|
a kezelés sikerét elérő alanyok |
239 (56%) |
176 (42%) |
hogyan szállítva / tárolás és kezelés
ketokonazol Hab, 2% 20 mg ketokonazolt tartalmaz, USP / gramm. A termolabile hidroetanolos hab áll rendelkezésre az alábbiak szerint:
NDC 45802-532-32
50 g alumínium doboz
NDC 45802-532-33
100 g alumínium doboz
tárolja 20-25 68-77-7.o.). .
hűtőszekrényben nem tárolható.
A tartalom gyúlékony. Ne tegye ki a tartályokat hőnek és / vagy ne tárolja 49 6c (120 F) feletti hőmérsékleten. Ne tárolja közvetlen napfényben.
tartalom nyomás alatt. Ne szúrja át és/vagy égesse el a tartályt.
gyermekektől elzárva tartandó.
Betegtanácsadási információk
Lásd az FDA által jóváhagyott betegcímkét (betegtájékoztató).
utasítsa a betegeket a ketokonazol hab megfelelő használatára, 2%. Made in Israel
Manufactured By Perrigo
Yeruham, Izrael
Distributed By
Perrigo Adapterek
Allegan, MI 49010
www.perrigo.com
Rev 08-18
5K200RCJ3
használati utasítás
ketokonazol Hab, 2%
Fontos információk: a ketokonazol Hab, 2% csak a bőrön használható. Ne használjon 2% ketokonazol habot a szemében, a szájban vagy a hüvelyben.
1. lépés: Távolítsa el az átlátszó kupakot a ketokonazol habból, 2% doboz.
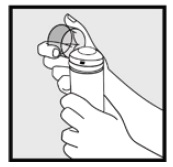
2.lépés: Tartsa a kannát függőlegesen, és erősen nyomja meg a fúvókát, hogy 2% – os ketokonazol habot adjon az átlátszó kupakba. * Adagoljon annyi ketokonazol habot, 2% – ot, hogy lefedje a teljes érintett terület(ek) et.
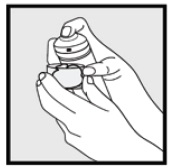
• ha a doboz melegnek tűnik, vagy a hab folyósnak tűnik, futtassa a kannát hideg víz alatt.
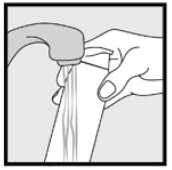
3.lépés: vegyen fel kis mennyiségű, 2% – os ketokonazol habot az ujjaival, és finoman dörzsölje be a habot az érintett terület(ek) be, amíg a hab eltűnik.
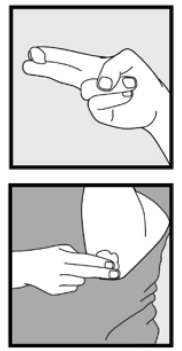
• ha olyan területeket kezel, mint a fejbőr, válassza szét a hajat úgy, hogy a ketokonazol Hab 2% – a közvetlenül a bőrre kerüljön.

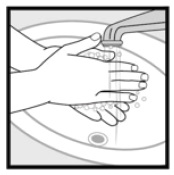
4.lépés: 2% ketokonazol hab alkalmazása után mosson kezet. * Dobja ki a kupakban maradt fel nem használt gyógyszert.
hogyan kell tárolni a ketokonazol habot, 2%? tartsa a ketokonazol habot, 2% – ot és minden gyógyszert gyermekektől elzárva.
ezt a használati utasítást Az Egyesült Államok Food and Drug Administration jóváhagyta.
csak Rx
Made in Israel
Manufactured By Perrigo
Yeruham, Izrael
Distributed By
Perrigo Kb
Allegan, MI 49010
www.perrigo.com
Rev 08-18
betegtájékoztató
ketokonazol Hab, 2%
Fontos információk: ketokonazol Hab, 2% csak a bőrön használható. Ne használjon 2% ketokonazol habot a szemében, a szájban vagy a hüvelyben.
mi a ketokonazol Hab, 2%?
ketokonazol Hab, 2% egy vényköteles gyógyszer, amelyet a bőrön (helyi) használnak seborrheás dermatitis kezelésére 12 éves vagy annál idősebb, normál immunrendszerrel rendelkező embereknél.
nem ismert, hogy a ketokonazol Hab, 2% biztonságos és hatékony-e gombás fertőzések kezelésére.
nem ismert, hogy a ketokonazol Hab, 2% biztonságos és hatékony-e 12 évesnél fiatalabb gyermekeknél.
a 2% – os ketokonazol hab alkalmazása előtt tájékoztassa kezelőorvosát minden betegségéről, beleértve azt is, ha:
• terhes vagy terhességet tervez. Nem ismert, hogy a ketokonazol Hab, 2% károsítja a magzatot. * szoptat vagy szoptat. Nem ismert, hogy a ketokonazol Hab 2% – a bejut-e az anyatejbe. Beszéljen egészségügyi szolgáltatójával arról, hogy a legjobb módja annak, hogy táplálja a babát a ketokonazol habbal történő kezelés során, 2%.
mondja el az egészségügyi szolgáltatónak az összes gyógyszert, beleértve a vényköteles és vény nélkül kapható gyógyszereket, vitaminokat és gyógynövény-kiegészítőket.
hogyan kell használni a ketokonazol habot, 2%? mit kell kerülni a ketokonazol hab használata közben, 2%? melyek a ketokonazol hab lehetséges mellékhatásai, 2%?
ketokonazol Hab, 2% súlyos mellékhatásokat okozhat, beleértve:
• bőrirritáció az alkalmazási terület(ek) en, beleértve a fény hatására fellépő bőrreakciókat. Tájékoztassa kezelőorvosát, ha 2% – os ketokonazol habbal végzett kezelés során bőrirritáció lép fel.
a leggyakoribb mellékhatások a ketokonazol Hab, 2% közé tartozik, égő érzés, szárazság, bőrpír, irritáció, zsibbadás, viszketés, kiütés és meleg az alkalmazás helyén.
ezek nem a ketokonazol hab lehetséges mellékhatásai, 2%.
forduljon orvosához a mellékhatásokkal kapcsolatos orvosi tanácsért. Lehet jelenteni mellékhatások FDA 1-800-FDA-1088.
hogyan kell tárolni a ketokonazol habot, 2%? Általános információk a ketokonazol hab biztonságos és hatékony használatáról, 2%.
a gyógyszereket néha a betegtájékoztatóban felsoroltaktól eltérő célokra írják fel. Ne használjon ketokonazol habot, 2% – ot olyan állapotban, amelyre nem volt előírva. Ne adjon ketokonazol habot, 2% – ot más embereknek, még akkor sem, ha ugyanazok a tünetek vannak, mint Önnek. Árthat nekik. Kérdezze meg gyógyszerészét vagy egészségügyi szolgáltatóját a ketokonazol habról, 2% – ról, amelyet az egészségügyi szakemberek számára írtak.
milyen összetevők vannak a ketokonazol habban, 2%?
hatóanyag: ketokonazol
Inaktív összetevők: cetil-alkohol, citromsav, etanol (terc-butil-alkohollal és brucin-szulfáttal denaturált) 58%, poliszorbát 60, kálium-citrát, propilénglikol, tisztított víz és szénhidrogén (propán/bután) hajtóanyaggal nyomás alatt álló sztearil-alkohol
további információért hívja a Perrigo-t a következő telefonszámon: 1-866-634-9120
ezt a betegtájékoztatót az Európai Parlament jóváhagyta amerikai élelmiszer-és Gyógyszerügyi Hivatal.
csomag/címke fő kijelző PANEL – karton
csak Rx
ketokonazol Hab, 2%
csak helyi alkalmazásra.
nem szemészeti, orális vagy intravaginális alkalmazásra.
100 g

a következő kép egy helyőrző, amely a termékazonosítót képviseli, amelyet a csomagolás során a gyógyszercsomag címkéjén rögzítenek vagy nyomtatnak.

| ketokonazol ketokonazol aeroszol, hab |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
Labeler-Perrigo New York Inc (078846912)
További információ a ketokonazolról)
- mellékhatások
- terhesség vagy szoptatás alatt
- adagolási információk
- hasonlítsa össze az alternatívákat
- árképzés & kuponok
- spanyol
- 36 vélemények
- kábítószer-osztály: topical antifungals
Consumer resources
- Patient Information
- Ketoconazole Topical (Advanced Reading)
Professional resources
- Prescribing Information
- Ketoconazole (Topical) (Professional Patient Advice)
- Ketoconazole Cream (FDA)
- Ketoconazole Shampoo (FDA)
Other brands Nizoral Shampoo, Ketodan, Extina, Xolegel
Related treatment guides
- Seborrheic Dermatitis
- Cutaneous Candidiasis
- Androgenetic Alopecia
- Dandruff
- … +4 több
orvosi nyilatkozat