Il glaucoma giovanile ad angolo aperto può essere una malattia difficile da catturare precocemente e trattare correttamente, a causa della natura della malattia stessa e delle caratteristiche di alcuni dei suoi malati più giovani. Se sai cosa cercare, tuttavia, e rispondi con un trattamento rapido ed efficace, puoi aiutare a salvare la visione del paziente JOAG. In questo articolo, condivideremo i nostri suggerimenti per diagnosticare JOAG e come eseguire una procedura chirurgica che offre ai pazienti le migliori possibilità di un esito positivo.
JOAG: Ciò che sappiamo
Il glaucoma giovanile ad angolo aperto è considerato un sottoinsieme del glaucoma primario ad angolo aperto, che colpisce circa 1 persona su 50.000 (maschi e femmine allo stesso modo). La definizione è stata controversa, ma generalmente tiene conto dell’età di insorgenza. La European Glaucoma Society definisce JOAG come glaucoma ad angolo aperto con esordio tra i 10 e i 35 anni.
JOAG dimostra un modello di ereditarietà autosomica dominante e la ricerca ha trovato associazioni tra JOAG e mutazioni genetiche sul cromosoma 1-1q21-q23. Questo locus è noto come GLC1A e contiene il gene TIGR (trabecular meshwork induced glucocorticoid response) o MYOC,1,2 che codifica per la proteina miocilina. La funzione esatta di questa proteina e il suo coinvolgimento nel glaucoma è attualmente sconosciuta. Quaranta mutazioni del gene TIGR / MIOC sono state identificate sia nel glaucoma ad angolo aperto giovanile che in quello adulto e le analisi genetiche hanno rivelato che l ‘ 8-63% dei pazienti con JOAG ha una mutazione TIGR/MIOC. Risultati comuni tra i pazienti con JOAG includono insorgenza precoce della malattia, IOP molto elevata e una forte storia familiare di glaucoma.3,4 Studio istopatologico della rete trabecolare in pazienti JOAG da Akihito Tawara della Kyushu University, MD, e Hajime Inomata, MD, ha rivelato una rete trabecolare anormalmente compatta con un accumulo di materiale extracellulare negli spazi trabecolari.5
Risultati clinici
Il glaucoma giovanile ad angolo aperto è generalmente asintomatico nelle sue fasi iniziali. A differenza del glaucoma infantile primario, segni come l’allargamento della cornea e del globo, rotture nella membrana di Descemet, edema corneale, epifora e fotofobia non sono presenti nei pazienti con insorgenza di glaucoma ad angolo aperto nella tarda infanzia o adolescenza. I sintomi sono rari, ma possono includere visione offuscata e dolore oculare da elevata pressione intraoculare. La perdita visiva accompagna le fasi successive della malattia e spesso porta a pazienti che cercano una valutazione oftalmica. La miopia assiale è stata associata a JOAG. I segni clinici comprendono l’elevazione severa di IOP, spesso nell’ordine di 40-50 mmHg. Data la mancanza di sintomi precoci, la presentazione è spesso in ritardo e la coppettazione avanzata del nervo ottico è spesso annotata sulla valutazione iniziale. Le caratteristiche gonioscopiche includono un angolo aperto della camera anteriore con l’alta inserzione dell’iride ed i processi prominenti dell’iride.1 I dischi ottici e gli angoli che appaiono normali non escludono tuttavia la diagnosi di JOAG.
La diagnosi di JOAG può essere semplice nell’impostazione di una IOP marcatamente elevata e coppettazione glaucomatosa del disco ottico. I casi più impegnativi sono quegli adolescenti che si presentano con una modesta elevazione della PIO e un disco che appare sano. Per aiutare a diagnosticare questi casi più difficili, si noti che i fattori di rischio per JOAG includono il genere maschile, la miopia e una storia familiare di glaucoma.1 Monitorare attentamente gli adolescenti con ipertensione oculare con valutazione periodica della IOP, dei dischi ottici e dei campi visivi. Al momento della valutazione iniziale, ottenere campi visivi di base, fotografie stereo del disco ottico e una valutazione dello spessore dello strato di fibra nervosa retinica con tomografia a coerenza ottica. Nonostante i dati normativi limitati, le misurazioni OCT sono utili per la valutazione longitudinale e l’identificazione della progressione precoce.
Escludere cause secondarie di glaucoma ad angolo aperto quando si valutano pazienti giovani con sospetto JOAG. Si noti che la sindrome da dispersione del pigmento, l’uveite, il trauma oculare e l’uso di steroidi possono portare a IOP e glaucoma elevati, e un buon esame clinico e una revisione dei sistemi sono importanti per escludere qualsiasi evidenza di queste condizioni.
Trattamento
Sebbene fino all ‘ 83% dei pazienti con JOAG richieda un intervento chirurgico,7 la terapia medica può fungere da ponte verso un trattamento chirurgico più definitivo. La terapia topica di prima linea comprende beta bloccanti, analoghi delle prostaglandine e inibitori dell’anidrasi carbonica. Usare alfa agonisti con cautela, o evitarli del tutto, nei pazienti giovani con JOAG, poiché sono state riportate potenziali reazioni avverse nei neonati e nei bambini piccoli, tra cui bradicardia, ipotensione, ipotermia, ipotonia, apnea e letargia.8
Quando i farmaci non riescono a controllare la IOP, il medico deve rivolgersi alla chirurgia. Ecco uno sguardo alle tue opzioni:
* Procedure angolari. Le procedure chirurgiche angolari sono generalmente eseguite per prime e sono spesso efficaci nel ridurre la IOP e ridurre al minimo le potenziali complicanze a breve e lungo termine. La scelta tra goniotomia e trabeculotomia dipende dalla preferenza e dall’esperienza del chirurgo.
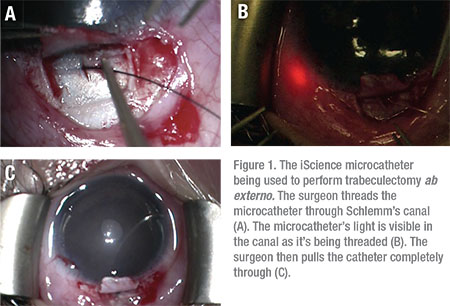
La trabeculotomia, tramite un approccio ab externo, è stata segnalata per avere un tasso di successo fino all ‘ 86% nel trattamento di JOAG, con il 14% dei pazienti che richiedono un intervento chirurgico aggiuntivo per controllare la PIO.9 Trabeculotomia ab externo può essere utilizzata per incidere la rete trabecolare a 360 gradi utilizzando una sutura o il microcatetere iScience. (Vedi Figura 1)
Nuove tecniche chirurgiche, come la trabeculotomia transluminale assistita da gonioscopia, sono state sviluppate e si sono rivelate utili anche in questa popolazione di pazienti. Quando si esegue la procedura GATT, il chirurgo effettua una piccola goniotomia nasale iniziale da 1 a 2 mm e avanza un microcatetere circonferenzialmente attraverso il canale di Schlemm. Il catetere viene tirato attraverso per creare una fessura di 360 gradi. Il principale vantaggio delle procedure ab interno come goniotomia, GATT e Trabectoma è che vengono eseguite interamente attraverso un’incisione corneale, evitando incisioni congiuntivali e sclerali—e successive cicatrici-del tutto.
Nei casi in cui la chirurgia angolare non riesce a controllare la PIO, ulteriori opzioni chirurgiche includono procedure di drenaggio esterno come trabeculectomia con mitomicina-C e chirurgia implantare di drenaggio del glaucoma, nonché procedure ciclodistruttive.
• Trabeculectomia. I ricercatori hanno riportato tassi di successo con trabeculectomia che vanno dal 50 all ‘ 87% nei pazienti con JOAG.11-14 Ottenere e quindi mantenere un bleb filtrante ben funzionante in un bambino può essere difficile, poiché i pazienti più giovani hanno una risposta di guarigione più robusta, spesso con conseguente fibrosi subcongiuntivale ed episclerale progressiva. La gestione Postop, compresa l’aderenza a regimi di collirio e manipolazioni come la lisi laser delle suture dei lembi, è complicata nei bambini molto piccoli a causa della loro incapacità di cooperare pienamente.
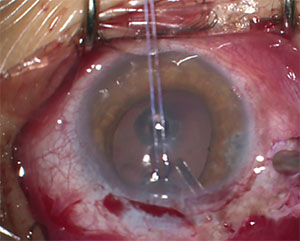
Figura 2. Questo 13-year-old con JOAG richiesto il posizionamento di un dispositivo di drenaggio glaucoma per controllare la sua IOP.
Alcuni medici hanno utilizzato la terapia antifibrosi con MMC per ridurre la quantità di cicatrici nei pazienti giovani, e questo approccio può portare a minori IOPs dopo trabeculectomia nei pazienti JOAG.11 Tuttavia, l ‘ uso di MMC è stato anche associato ad un aumentato rischio di complicanze che minacciano la vista, tra cui maculopatia ipotonica e infezione correlata alla bleb. Il tasso di maculopatia ipotonica è stato segnalato per essere alto come 20 per cento, che può essere dovuto l’incidenza aumentata di miopia assiale in questi pazienti.11 Uno studio ha rilevato un’incidenza del 17% di infezioni correlate alla bleb nei bambini con bleb funzionali.12 Alla luce di questi risultati, usare cautela quando si esegue trabeculectomia con MMC nei bambini più piccoli.
• Impianti di drenaggio del glaucoma. A causa della maggiore probabilità di cicatrizzazione congiuntivale nei pazienti con JOAG e dell’aumentato rischio di complicanze pericolose per la vista con trabeculectomia (nei pazienti più giovani), la chirurgia GDI è un’alternativa ragionevole. I GDIS più comunemente usati sono la valvola del glaucoma Ahmed (New World Medical, Rancho Cucamonga, Calif.) e Baerveldt glaucoma implant (Abbott Medical Optics, Santa Ana, Calif.). Studi precedenti con almeno un anno di follow-up hanno documentato i tassi di successo dopo la chirurgia pediatrica GDI che vanno dal 31% al 97%.15 Tuttavia, i dati a lungo termine sull’uso della GDI nei bambini e nei giovani adulti sono limitati.
Un altro problema potenziale con GDI nei bambini è che il corretto posizionamento del tubo nella camera anteriore può essere particolarmente impegnativo. La rigidità sclerale ridotta in questi pazienti rende la migrazione anteriore e la rotazione della punta del tubo prossimale più comuni che negli adulti.16 La migrazione del tubo può comportare il contatto diretto o la vicinanza della punta del tubo alla superficie corneale posteriore e può contribuire alla perdita delle cellule endoteliali e all’eventuale scompenso corneale. Posizionamento del tubo come mostrato in Figura 2 è preferito; notare la lunghezza più lunga e come è angolato lontano dall’endotelio corneale.
Dato che i pazienti con JOAG sono giovani e spesso hanno IOPs molto elevati con danni al disco avanzati, la nostra preferenza è quella di utilizzare un impianto Baerveldt da 350 mm2. Usiamo una sutura di poliglactina 7-0 per legare temporaneamente il tubo di questo dispositivo non valvolato e lasciare tre o quattro settimane per formare una capsula intorno all’espianto sclerale.
Per i bambini piccoli, eseguiamo il rilascio pianificato della legatura in sala operatoria tra le settimane postoperatorie tre e quattro utilizzando una lente Hoskins e un laser a diodi verde.17 Rendiamo la visualizzazione della legatura per lisi del laser più facile con l’uso del tessuto corneale come materiale dell’innesto della toppa. L’elevazione fluida della congiuntiva che sovrasta la piastra sclerale e il profondo ammorbidimento del globo aiutano a confermare il rilascio della legatura. Se non siete sicuri se la legatura è stato rilasciato, è possibile utilizzare B-mode ecografia per dimostrare la presenza di fluido intorno alla piastra di drenaggio.
Per sostituire il volume perso e fornire una maggiore resistenza al flusso attraverso il tubo, è possibile iniettare ialuronato di sodio (10 mg/ml) nella camera anteriore immediatamente dopo il rilascio della legatura. Ciò limita la durata e l’entità dell’ipotonia e previene il collasso della camera anteriore. Per i bambini più piccoli, spesso lasceremo la legatura rilasciare spontaneamente, ma li monitoreremo più da vicino dopo le prime settimane postoperatorie. Per i bambini e gli adulti più anziani e cooperativi, è possibile eseguire il rilascio pianificato della legatura mediante lisi laser seguita da un’iniezione in camera anteriore di ialuronato di sodio (10 mg/ml) in ufficio. Preferiamo mantenere i pazienti su atropina 1% e ridurre il numero di farmaci soppressori acquosi quando possibile dopo la terza settimana postoperatoria in previsione dell’apertura del tubo. Queste tecniche possono aiutare a prevenire periodi prolungati di ipotonia e le sue complicanze secondarie dopo il rilascio della legatura.
Sebbene la chirurgia GDI e la trabeculectomia si siano evolute nel corso degli anni con i progressi nella tecnica chirurgica e modi migliori per modulare la guarigione delle ferite, esistono sfide uniche nei pazienti giovani con JOAG rispetto agli adulti più anziani. Un’attenta valutazione preop e un monitoraggio postoperatorio, con frequenti follow-up e attenzione alla diagnosi precoce e alla gestione degli eventi avversi, possono migliorare i risultati a lungo termine. RECENSIONE
Dr. Menezes è un medico residente a New York Eye and Ear Infirmary del Monte Sinai. Il Dott. Panarelli è assistente professore di oftalmologia e direttore del programma di residenza associato presso la New York Eye and Ear Infirmary del Monte Sinai. Non hanno alcun interesse finanziario in nessuno dei prodotti menzionati.
1. Albert DM, Miller JW, Azar DT, Blodi BA, Cohan JE, Perkins T. Glaucoma giovanile ad angolo aperto. In: Albert & Principi di Jakobiec & Pratica di oftalmologia. 3a ed. Philadelphia: Elsevier 2008.
2. Bruttini M, Longo I, Frezzotti P, et al. Mutazioni nel gene della miocilina in famiglie con glaucoma primario ad angolo aperto e glaucoma giovanile ad angolo aperto. Arch Ophthalmol 2003;121:7:1034-8.
3. Il sito è stato pubblicato nel 2007. Prevalenza di mutazioni in TIGR / Miocilina in pazienti con glaucoma ad angolo aperto primario adulto e giovanile. Am J Hum Genet 1998; 63:5: 1549-52.
4. Adam MF, Belmouden A, Binisti P, et al. Mutazione ricorrente in un singolo esone che codifica il dominio olfattomedina-omologia evolutivamente conservato del TIGR nel glaucoma ad angolo aperto familiare. Hum Mol Genet 1997;6: 12: 2091-7.
5. Tawara A, Inomata H. Immaturità dello sviluppo della rete trabecolare nel glaucoma giovanile. Am J Ophthalmol 1984;15: 98: 82-97.
6. Il suo nome deriva dal greco antico, “Chou JC”, “Chou JC” e “Chou JC”. Confronti dei fattori di rischio e delle variazioni del campo visivo tra glaucoma ad angolo aperto primario ad esordio giovanile e ad esordio tardivo. Ophthalmologica 2002;216: 1: 27.
7. Wiggs JL, Delbono EA, Schuman JS, et al. Caratteristiche cliniche di cinque pedigree geneticamente collegati al locus giovanile del glaucoma sul cromosoma 1q21-q31. Oftalmologia 1995;102:1782-9.
8. I nostri servizi sono sempre disponibili. Apparente depressione del sistema nervoso centrale nei neonati dopo l’uso di brimonidina topica. Am J Ophthalmol 1999;128:255-256.
9. Ikeda H, Ishigooka H, Muto T, et al. Esito a lungo termine della trabeculotomia per il trattamento del glaucoma dello sviluppo. Arch Ophthalmol 2004;122:1122-8.
10. Grover DS, Smith O, Fellman RL, et al. Gonioscopia assistita trabeculotomia transluminale: Una trabeculotomia circonferenziale ab interno per il trattamento del glaucoma congenito primario e del glaucoma giovanile ad angolo aperto. Br J Ophthalmol 2015;99:8:1092-6.
11. I nostri prodotti sono disponibili su richiesta. Trabeculectomia con mitomicina C rispetto alla trabeculectomia da sola per il glaucoma ad angolo aperto primario giovanile. Ophthalmologica 2003;217: 1: 24-30.
12. Sidoti PA, Belmonte SJ, Liebmann JM, Ritch R. Trabeculectomia con mitomicina-c nel trattamento dei glaucomi pediatrici. Oftalmologia 2000;107:422-9
13. Groh MJ, Behrens A, Handel A, Kuchle M. Risultati a medio e lungo termine dopo trabeculectomia in pazienti con glaucoma ad angolo aperto giovanile e tardivo. Klin Monatsbl Augenheilkd 2000;217:71-76
14. Aponte EP, Diehl N, Mohney BG. Risultati medici e chirurgici nel glaucoma infantile: uno studio basato sulla popolazione. J AAPOS 2011;15: 3: 263-7.
15. Chen TC, Chen PP, Francis BA, et al. Chirurgia pediatrica del glaucoma: un rapporto dell’AAO. Oftalmologia 2014:121:11:2107.
16. Netland PA. Sergente Walton. Impianti di drenaggio del glaucoma in pazienti pediatrici. Ophthalmic Surg 1993; 24: 723-729.
17. Sidoti PA, Panarelli, JF, Huruta-Dias R, Jardim J, Leon-Rosen J, Rosen RB. Rilascio della legatura del tubo laser dopo l’impianto di shunt acquoso nei bambini piccoli. Oftalmica Surg Laser Imaging 2011;42:2:168-9.