- Introduzione
- Materiali e metodi
- Raccolta di uova
- Quantificazione Ecdysteroid
- Quantificazione dell’ormone giovanile
- Analisi statistiche
- Risultati
- Discussione
- Ecdisteroidi
- Ormone giovanile
- Dichiarazione di disponibilità dei dati
- Contributi dell’autore
- Finanziamento
- Conflitto di interessi
- Riconoscimenti
- Materiale supplementare
Introduzione
La radiazione adattativa di insetti in diversi climi, è stato in parte facilitato dai ripetuti evoluzione della diapausa, un’anticipazione arresto di sviluppo in anticipo di condizioni sfavorevoli (ad esempio, l’inverno, la stagione secca; Waterhouse e Norris, 1980; Tauber et al., 1986; Danks, 1987; Hodkova e Hodek, 2004). La diapausa viene in genere avviata in risposta a un segnale ambientale token (ad es., cambiamento stagionale nel fotoperiodo), mantenuto per un periodo geneticamente determinato e poi terminato dopo che le condizioni favorevoli sono tornate. Pertanto, la diapausa consente agli insetti di allineare la loro crescita e riproduzione con i cicli stagionali locali (Tauber et al., 1986; Danks, 1987). La diapausa è un regolatore chiave della storia della vita, della gamma geografica e dell’abbondanza stagionale per molti impollinatori di insetti (ad esempio, Kemp e Bosch, 2005; Fründ et al., 2013), parassiti agricoli (ad esempio, Pullin et al., 1991; Li et al., 2012; Levine et al., 2015), e vettori di malattia (ad esempio, Denlinger e Armbruster, 2014; Gray et al., 2016). Inoltre, la diapausa richiama diffusa modificazioni fisiologiche tra cui l’accumulo di riserve di sostanze nutrienti, la soppressione dell’attività metabolica, aumento del catabolismo anaerobico, arresto del ciclo cellulare, alterazioni nella segnalazione Wnt, e sovraregolazione di vari stress meccanismi di tolleranza (Denlinger, 2002; Hahn e Denlinger, 2007, 2011; Re e MacRae, 2015; Ragland e Mantenere, per il 2017). Comprendere i meccanismi regolatori alla base della diapausa è un problema di lunga data nella biologia organica e faciliterà lo sviluppo di nuovi approcci gestionali alle specie chiave.
Gli ecdisteroidi e gli ormoni giovanili regolano una vasta gamma di processi fisiologici e di sviluppo negli insetti (Gruntenko e Rauschenbach, 2008; Jindra et al., 2013; Palli, 2016), tra cui diapausa (Denlinger, 1985; Denlinger et al., 2012). Il segnale ormonale specifico che regola la diapausa tende a variare in base allo stadio in cui si verifica l’arresto dello sviluppo (Denlinger et al., 2012). Ad esempio, l’arresto dello sviluppo durante la diapausa larvale o pupale è tipicamente regolato da cambiamenti nell’abbondanza di ecdisteroidi (ad esempio, Ohtaki e Takahashi, 1972; Bowen et al., 1984; Richard et al., 1987). Al contrario, l’arresto dello sviluppo durante la diapausa adulta è spesso regolato da cambiamenti nell’abbondanza di ormoni giovanili (ad esempio, Spielman, 1974; Schooneveld et al., 1977; Saunders et al., 1990 e vedi recensione in Denlinger et al., 2012).
Esiste una grande lacuna nella nostra comprensione della regolazione ormonale della diapausa embrionale, che è ampiamente osservata tra Lepidotteri, Ortotteri, Emitteri e Ditteri. Ricerche precedenti hanno ampiamente documentato la regolazione endocrina della diapausa embrionale nella falena del baco da seta (Bombyx mori) da parte dell’ormone diapausa (Hasegawa, 1963; Yamashita e Hasegawa, 1966; Yamashita, 1996). Tuttavia, questo ruolo normativo per l’ormone diapausa sembra essere unico per B. mori e quindi ha fornito poche informazioni sulla base ormonale della diapausa embrionale in altre specie (Denlinger et al., 2012). Oltre a B. mori, la regolazione ormonale della diapausa embrionale è stata stabilita in sole tre specie. La falena zingara (Lymantria dispar) subisce un arresto dello sviluppo avviato e mantenuto da una maggiore abbondanza di ecdisteroidi (Lee et al., 1997; Lee e Denlinger, 1997) mentre una bassa abbondanza di ecdisteroidi regola la diapausa in due locuste (Chortoicetes terminifera, Locusta migratoria; Gregg et al., 1987; Tawfik et al., 2002).
Ad oggi, nessuno studio ha caratterizzato l’abbondanza di ormoni durante la diapausa embrionale di qualsiasi specie di dipterano. Qui, affrontiamo questa lacuna studiando la regolazione ormonale della diapausa embrionale nella zanzara tigre asiatica, Aedes albopictus. Negli ultimi 30 anni, questo vettore medicalmente importante (Paupy et al., 2009) ha invaso con successo le regioni temperate in tutto il mondo (Benedict et al., 2007) dovuto in parte a una diapausa embrionale che ha facilitato la sopravvivenza durante il trasporto a lunga distanza (Juliano e Lounibos, 2005; Diniz et al., 2017) e si è evoluto rapidamente per allineare i tempi di arresto dello sviluppo con le condizioni climatiche locali (Urbanski et al., 2012). Popolazioni temperate di Ae. albopictus entra in una diapausa fotoperiodica regolata dalla madre. Sotto brevi, daylength autunnali, le femmine producono uova che completano lo sviluppo embrionale, ma rimangono refrattari agli stimoli da cova come larve farate all’interno del corion dell’uovo fino alla primavera successiva. Negli ultimi dieci anni, la regolazione trascrizionale della diapausa embrionale in Ae. albopictus è stato ampiamente caratterizzato (Urbanski et al., 2010; Poelchau et al.,2011, 2013a, b; Huang X. et al., 2015; Batz et al., 2017) ma la regolazione ormonale di questo adattamento cruciale rimane sconosciuta. Abbiamo quantificato 20-hydroxyecdysone (20HE) e l’ormone giovanile III (JH3) nelle uova diapausing e non diapausing in tre punti temporali che raggruppano le fasi chiave dello sviluppo embrionale e interpretato i nostri risultati nel contesto di RNAseq precedentemente raccolti (Poelchau et al., 2013a, b) e dati manipolativi (Suman et al., 2015).
Materiali e metodi
Raccolta di uova
Tutte le misurazioni hanno utilizzato uova F11 provenienti da una colonia di laboratorio di Ae. albopictus fondata nel mese di agosto 2015 da oltre 200 larve raccolte a Manassas, VA, Stati Uniti. Prima di questo esperimento, la popolazione è stata mantenuta in condizioni precedentemente descritte . Per generare campioni di uova per questo esperimento, le larve di F10 sono state mantenute in contenitori di Sterlite da 5,5 L ad una densità di circa 250 larve per 2.5 L di acqua deionizzata (DI) con 5 ml di liquami alimentari (Armbruster e Conn, 2006) sotto fotoperiodo LD a 21°C e 80% RH. Ogni lunedì-mercoledì-venerdì, le larve venivano filtrate attraverso una rete a maglie fini, quindi trasferite in un contenitore pulito di Sterlite da 5,5 L; le pupe venivano distribuite in gabbie adulte mantenute sotto fotoperiodo LD che evitava la diapausa o fotoperiodo a breve giorno che induceva la diapausa (SD, 8:16 L:D).
Alle femmine adulte sono state fornite settimanalmente bloodmeals e una tazza per la deposizione delle uova foderata con un tovagliolo di carta non sbiancato e riempita a metà con acqua DI fino alla cessazione della deposizione delle uova. Le uova sono state raccolte ogni giorno, mantenute su un tovagliolo di carta bagnato per 48 h, quindi essiccate all’aria e conservate in contenitori in condizioni SD. A 5, 7 e 11 giorni dopo la deposizione delle uova (dpov), le uova raccolte sono state pesate al più vicino 1 µg (media: 11,460 mg, intervallo: 9,1–19,5 mg) su una microbalance MX5 (Mettler-Toledo, Columbia, OH, Stati Uniti), poste in provette da 1,5 ml, congelate a scatto in azoto liquido tra le 11 del mattino e le 12 del pomeriggio (tempo Zeitgeber 3-4 h) e conservate a -80°C. Un sottoinsieme di uova è stato mantenuto per confermare che le condizioni di fotoperiodo LD e SD stimolavano la produzione di uova non diapause e diapause, rispettivamente (vedi Urbanski et al., 2012).
Abbiamo campionato le uova a 5, 7 e 11 dpov per due motivi. Primo, Ae. albopictus inizia la diapausa (sensu Koštál, 2006; Koštál et al., 2017) a seguito del completamento dello sviluppo embrionale (Mori et al., 1981). Nelle condizioni utilizzate nei nostri esperimenti, Ae. gli embrioni di albopictus subiscono segmentazione approssimativamente a 5 dpov e gli embrioni non diapausi sono competenti a schiudersi a circa 7 dpov (Poelchau et al., 2013a). Con 11 dpov, l’arresto dello sviluppo è saldamente stabilito negli embrioni diapausa (Poelchau et al., 2013b). Pertanto, abbiamo scelto di confrontare gli embrioni diapausa e non diapausa in punti temporali che raggruppano il periodo di competenza della cova, compresa l’istituzione di arresto dello sviluppo durante la diapausa. In secondo luogo, abbiamo scelto punti temporali simili a quelli utilizzati per precedenti esperimenti RNAseq di embrioni (Poelchau et al., 2013a, b) in modo che questi dati possano essere sfruttati per interpretare i nostri risultati attuali. Questi risultati RNAseq sono stati precedentemente trovati per essere ben correlati con i risultati di espressione genica ottenuti tramite qRT-PCR (Poelchau et al., 2013a).
Quantificazione Ecdysteroid
Per estrarre ecdysteroids, campioni di uova sono stati posti in un tubo di vetro borosilicato da 0,5 mL conico fondo micro tissue grinder (Wheaton, Millville, NJ, Stati Uniti) con 1 µg di farnesol (Sigma-Aldrich, St. Louis, MO, Stati Uniti) aggiunto come standard interno. Le uova sono state omogeneizzate manualmente tre volte con un pestello di teflon in MeOH refrigerato da 300 µL di HPLC, quindi filate a 12.000 RCF per 10 min in una centrifuga refrigerata (4°C). Il surnatante risultante è stato raggruppato e poi eluito attraverso colonne di ossido di alluminio due volte con MEOH al 90% raffreddato e una volta con MeOH. I campioni sono stati essiccati in una centrifuga sotto vuoto refrigerata (4°C), risospesi in 20 µL di MeOH e conservati a -80°C fino all’analisi. I controlli positivi sono stati preparati aggiungendo 1 µg ciascuno di 20HE (Sigma-Aldrich) e farnesol a tubi vuoti che sono stati altrimenti trattati in modo identico. L’analisi del campione della concentrazione di ecdysteroid è stata eseguita utilizzando un Micromass Quattro Micro LC-MS / MS(Waters Co., Milford, MA, Stati Uniti). I volumi di iniezione erano di 5,0 µL, con separazioni eseguite utilizzando ACQUITY UPLC BEH C18 colonne da 2,1 mm per 50 mm con una fase stazionaria di 1,7 µm (Waters Co.). Le condizioni operative per i cicli LC erano una portata in fase mobile di 0,37 mL min-1 con una fase mobile binaria dello 0,1% di acido formico in acetonitrile e dello 0,1% di acido formico in acqua. Le condizioni iniziali erano 1: 99 acetonitrile: acqua, seguita da flusso isocratico per 0,3 min. A 0.3 min, un gradiente lineare da 1:da 99 a 99: 1 acetonitrile: l’acqua è stata applicata su 4,2 min, seguita da un flusso isocratico di 1,0 min a 99: 1 acetonitrile: acqua, dopo di che la fase mobile è tornata a 1:99 acetonitrile:acqua. Spettrometro di massa impostazioni sono state electrospray positivo, con un desolvation temperatura di 350°C. 20LUI e farnesolo eluito a 2.89 e 4.97 min, rispettivamente, e sono stati quantificati utilizzando multipli monitoraggio della reazione di caratteristica transizioni: 481.22 (m/z) > 445.24 (m/z), e 205.41 (m/z) > 121.09 (m/z), rispettivamente. Il limite di rilevamento del test è di circa 5 pg.
Quantificazione dell’ormone giovanile
Ogni campione di uovo è stato posto in un vetro borosilicato da 0,5 mL conico fondo micro tissue grinder tube (Wheaton) con 1 µg di farnesol (Sigma-Aldrich) aggiunto come standard interno. Le uova sono state omogeneizzate manualmente tre volte con un pestello di teflon in esano refrigerato di grado HPLC 500 µL, quindi filate a 12.000 RCF per 10 min in una centrifuga refrigerata (4°C). Le frazioni di esano sono state ricombinate in una fiala di vetro borosilicato pulito e asciugate mediante centrifugazione sotto vuoto. JH è stato quantificato utilizzando la gascromatografia / spettrometria di massa come descritto in precedenza (Brent e Vargo, 2003). In breve, il residuo è stato lavato dalle fiale con tre risciacqui di esano e aggiunto a colonne di vetro borosilicato riempite con ossido di alluminio. Per filtrare i contaminanti, i campioni sono stati eluiti attraverso le colonne successivamente con esano, 10% etere etilico-esano e 30% etere etilico-esano. Dopo l’essiccazione, i campioni sono stati derivatizzati riscaldando a 60°C per 20 min in una soluzione di alcool metilico (Sigma-Aldrich) e acido trifluoroacetico (Sigma-Aldrich). I campioni sono stati essiccati, risospesi in esano e nuovamente eluiti attraverso colonne di ossido di alluminio. I componenti non derivati sono stati rimossi con etere etilico al 30%. Il derivato JH è stato raccolto in nuovi flaconcini mediante aggiunta del 50% di etil-acetato–esano. Dopo l’essiccazione, i campioni sono stati risospesi in esano, quindi analizzati utilizzando una serie HP 7890A GC (Agilent Technologies, Santa Clara, CA, Stati Uniti) dotata di una colonna Zebron ZB-WAX di 30 m × 0,25 mm (Phenomenex, Torrance, CA, Stati Uniti) accoppiata a un rivelatore selettivo di massa inerte HP 5975C. L’elio è stato usato come gas vettore. La forma JH è stata confermata dai primi campioni di prova in esecuzione in modalità di SCANSIONE per le firme note di JH 0, JH I, JH II, JH3 e JH3 etile; JH3 è stata confermata come forma endogena primaria in questa specie. I campioni successivi sono stati analizzati utilizzando la modalità MS SIM, monitorando a m / z 76 e 225 per garantire la specificità per il derivato d3-metossidrina di JH3. L’abbondanza totale è stata quantificata rispetto a una curva standard di JH3 derivatizzata e aggiustata per la massa iniziale delle uova. Il limite di rilevamento del test è di circa 1 pg.
Analisi statistiche
Le analisi sono state eseguite in R (R Core Team, 2019). L’abbondanza di JH3 è stata log-trasformata e analizzata usando ANOVA per testare gli effetti dello stato della diapausa, dell’età e della loro interazione. 20L’abbondanza era non lineare e adatta usando due modelli di regressione polinomiale: un modello completo che includeva l’età e lo stato di sviluppo (diapausa, non diapausa) e un modello ridotto contenente solo l’età. I modelli sono stati confrontati utilizzando ANOVA per determinare se lo stato di sviluppo incluso ha migliorato significativamente la potenza esplicativa.
Analisi trascrizionali utilizzate dati RNAseq precedentemente raccolti da diapause e non diapause Ae. uova di albopictus (Dataset supplementare 1; Poelchau et al., 2013 bis, b). I geni espressi in modo differenziale a 3, 6 e 11 dpov sono stati studiati mediante analisi di arricchimento dei set di geni (Mootha et al., 2003) utilizzando il pacchetto Pianoforte (Väremo et al., 2013) impostare i parametri predefiniti seguiti dalla correzione FDR. Un set di geni di riferimento è stato annotato con i termini del processo biologico GO assegnati su VectorBase (Giraldo-Calderón et al., 2015). I geni della via di sintesi JH3 e ecdysteroid così come i recettori JH3 e i geni di degradazione sono stati annotati manualmente secondo la letteratura precedente (Bai et al., 2007; Li et al., 2011; Nouzova et al., 2011; Niwa e Niwa, 2014; Matthews et al., 2016). Inoltre, abbiamo annotato i geni JH3 e ecdysteroid-inducibili sulla base delle descrizioni geniche fornite in VectorBase (Giraldo-Calderón et al., 2015). Una panoramica completa di questi insiemi genici è fornita nel Dataset supplementare 1.
Risultati
L’incidenza media della diapausa è stata del 95,9% (intervallo: 90,5–100%) sotto fotoperiodo SD e 5.4% (intervallo: 1,8–9,5%) sotto fotoperiodo LD (Dataset supplementare 2); quindi, i nostri trattamenti fotoperiodici hanno indotto le risposte diapause attese. 20HE ha raggiunto il picco sia in condizioni di diapausa che non diapausa a 7 dpov, ma l’inclusione dello stato di diapausa come fattore in un modello quadratico per l’abbondanza di 20HE non ha migliorato la potenza esplicativa del modello (Figura 1A e set di dati supplementari 3; F3,43 = 0.21, p = 0.890). Questi risultati indicano che lo stato della diapausa non spiega in modo significativo la variazione del titolo 20HE. L’analisi della Pathway di RNAseq ha indicato che né la via di sintesi 20HE né i geni inducibili 20HE sono stati significativamente alterati in condizioni di diapausa vs. non diapausa a 3, 6 o 11 dpov (Tabella 1).

Tabella 1. Risultati delle analisi di arricchimento dei set genetici, vedere il Dataset supplementare 1 per un riepilogo completo di questi set genetici.
JH3 è stato confermato per essere la forma primaria di ormone giovanile in questa specie. L’abbondanza di JH3 è stata significativamente ridotta negli embrioni diapausi (Figura 1B e Dataset supplementare 3; F1,64 = 5,08, p = 0,028). Tuttavia, l’età (F2,64 = 0,66, p = 0,518) e l’interazione dello stato della diapausa e dell’età (F2,64 = 0,13, p = 0,883) non hanno influenzato i livelli di JH3. L’analisi della pathway dei dati RNAseq ha indicato che la via di sintesi JH3 è stata significativamente repressa a 3 dpov e i geni inducibili JH sono stati significativamente repressi a 6 dpov (Figura 2 e Tabella 1).
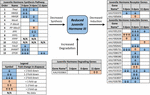
Figura 2. Sintesi dell’espressione differenziale dei geni coinvolti nella sintesi, degradazione e induzione di JH3 per Ae. albopictus (Poelchau et al., 2013 bis, b). Riduzioni significative indotte dalla diapausa (blu) o aumenti (arancione) sono indicati da cellule ombreggiate. La grandezza differenziale è indicata dalle frecce come descritto nella legenda in basso a sinistra. ∗I geni senza nomi comuni sono identificati dal numero ID VectorBase.
Discussione
La diapausa è un adattamento diffuso che consente agli insetti di allineare la loro crescita e riproduzione con condizioni stagionalmente favorevoli (Tauber et al., 1986; Danks, 1987). Comprendere i cambiamenti ormonali con cui gli insetti coordinano la percezione di segnali esterni che inducono diapausa con i meccanismi fisiologici che portano all’arresto dello sviluppo è un obiettivo di lunga data in biologia (Lees, 1956; Denlinger, 2002). Decenni di ricerca hanno portato all’identificazione di strategie ormonali comuni per la diapausa negli stadi larvale, pupale e adulto; tuttavia, la regolazione ormonale della diapausa embrionale rimane in gran parte sconosciuta, in particolare nei ditteri (Denlinger, 1985, 2002; Denlinger et al., 2012). In questo studio, la nostra misurazione diretta della ridotta abbondanza di JH3 nella diapausa è corroborata da precedenti profili di espressione genica (Poelchau et al., 2013a, b) e esperimenti manipolativi (Suman et al., 2015) sostenendo l’ipotesi che JH3 regoli la diapausa embrionale in questa specie.
Ecdisteroidi
Nel presente studio, abbiamo misurato direttamente l’abbondanza di ecdisteroidi in tre punti temporali in condizioni di diapausa e non diapausa negli embrioni della zanzara Ae. albopictus. Coerentemente con i precedenti risultati di Toxorhynchites amboinensis (Russo e Westbrook, 1986), i livelli di 20HE hanno raggiunto il picco vicino alla conclusione dello sviluppo embrionale (7 dpov; Figura 1A). Tuttavia, 20IL titolo non differiva significativamente tra le uova diapause e non diapause. Inoltre, né la via di sintesi 20HE né i geni inducibili 20HE hanno subito cambiamenti significativi e coordinati nell’espressione genica (Tabella 1). Concludiamo che, a differenza delle diapause embrionali precedentemente esaminate in Lepidotteri e Ortotteri (Hasegawa, 1963; Yamashita e Hasegawa, 1966; Gregg et al. Nel 1987, Yamashita, 1996, Lee e Denlinger, 1997, Lee et al., 1997; Tawfik et al., 2002), 20HE non regola l’iniziazione della diapausa in Ae. albopictus.
Ormone giovanile
Al contrario, abbiamo osservato un’abbondanza di JH3 circa due volte inferiore negli embrioni diapausa (Figura 1B). Mentre di magnitudo inferiore rispetto alle differenze nell’abbondanza di JH3 rilevate in condizioni di diapausa rispetto a quelle non diapause negli insetti che diapausa in altre fasi della vita (ad esempio, Yin e Chippendale, 1979; Walker e Denlinger, 1980; Readio et al., 1999), le nostre misurazioni dirette sono corroborate da prove trascrizionali (Figura 2). Ad esempio, la via di sintesi JH3 viene significativamente repressa durante la preparazione della diapausa precoce (3 dpov). A sostegno della nostra interpretazione di questi risultati, studi precedenti hanno scoperto che la ridotta espressione dei geni lungo il percorso di sintesi JH3 è fortemente correlata con una minore abbondanza di JH3 in entrambi Aedes aegypti (Nouzova et al., 2011; Rivera-Perez et al., 2014) e Diploptera punctata (Huang J. et al., 2015). I geni inducibili JH sono anche significativamente repressi durante la preparazione tardiva della diapausa (6 dpov; Tabella 1), suggerendo che gli embrioni destinati alla diapausa hanno una capacità limitata di rispondere alla segnalazione JH3 vicino al momento in cui gli embrioni non diapausa diventano competenti per schiudersi. Inoltre, l’espressione genica per un enzima degradante JH3 (JH esterasi) è significativamente sovraregolata nel mantenimento precoce della diapausa (11 dpov; Figura 2) e successivamente nel mantenimento della diapausa (21 e 40 dpov; Poelchau et al., 2013b) suggerendo che JH3 potrebbe rimanere a bassa abbondanza durante la diapausa in questa specie.
La ridotta abbondanza di JH3 durante l’arresto dello sviluppo è in qualche modo controintuitiva perché il basso titolo ormonale giovanile è tipicamente associato a mute progressive, in particolare dallo stadio larvale a quello pupale (Palli, 2016). Tuttavia, l’applicazione di un analogo JH3 (pyriproxyfen) per diapause Ae. albopictus eggss accelera il tasso di interruzione della diapausa in modo dose-dipendente (Suman et al., 2015). Al dosaggio più efficace, circa l ‘80% delle uova esposte al piriproxifene termina la diapausa del 30 dpov rispetto al solo 1% di interruzione della diapausa dell’ 80 dpov per le uova di controllo (Suman et al., 2015). Le alterazioni nell’abbondanza di JH3 possono anche generare un fenotipo simile alla diapausa embrionale in altre specie. Ad esempio, in B. mori, riduzione sperimentale della sintesi di JH3 da JHAMT knockout si traduce in larve di farato completamente sviluppate che non rispondono agli stimoli di schiusa; questo fenotipo può essere salvato in modo dose-dipendente dall’applicazione di JH3 estratto o metoprene, un analogo JH3 (Nakao et al., 2015). Allo stesso modo, la supplementazione sperimentale di un altro analogo dell’ormone giovanile (RO-20-3600) alle uova di Drosophila melanogaster appena depositate produce larve di farato che sono mobili all’interno dell’uovo ma non riescono a schiudersi (Smith e Arking, 1975). Insieme, questi dati indicano che l’abbondanza di ormoni giovanili contribuisce probabilmente alla regolazione delle risposte alla schiusa in diversi insetti. La diapausa embrionale allo stadio larvale del farato è definita da una mancata risposta agli stimoli di schiusa quindi, i cambiamenti nell’abbondanza dell’ormone giovanile possono rappresentare una strategia ormonale comune per regolare questa forma di diapausa.
Di concerto con precedenti dati trascrizionali e manipolativi, i nostri risultati implicano fortemente una ridotta abbondanza di JH3 come probabile regolatore della diapausa embrionale in Ae. albopictus. Questa ricerca è la prima quantificazione diretta dell’abbondanza ormonale durante la diapausa embrionale in qualsiasi specie di ditteri e rappresenta un passo importante verso la chiarificazione della regolazione ormonale di questo adattamento cruciale agli ambienti avversi. Caratterizzare il legame tra stimoli esterni e arresto dello sviluppo tramite segnalazione ormonale rimane una sfida importante (Denlinger, 1985; Denlinger et al., 2012). Chiarire questi percorsi in una varietà di specie fornirà informazioni critiche per problemi fondamentali e applicati, tra cui la comprensione delle basi molecolari e fisiologiche dell’evoluzione della storia della vita, la previsione delle risposte delle specie ai cambiamenti climatici e l’identificazione di nuovi obiettivi per la gestione delle specie di parassiti e vettori (Denlinger, 2008).
Dichiarazione di disponibilità dei dati
Tutti i set di dati generati per questo studio sono inclusi nell’articolo/Materiale supplementare.
Contributi dell’autore
ZB, CB e PA contribuirono alla concezione, alla progettazione dello studio e prepararono la bozza iniziale del manoscritto. ZB, MM e JS hanno eseguito la zootecnia e raccolto i campioni di uova. CB ha eseguito le analisi LC-MS / MS e GC-MS. ZB ha eseguito le analisi statistiche. Tutti gli autori hanno contribuito alla revisione del manoscritto e hanno approvato la versione presentata.
Finanziamento
Questo lavoro è stato sostenuto dal National Institutes of Health (1R15A|111328-01) e la dotazione della famiglia Davis alla PA.
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretati come un potenziale conflitto di interessi.
Riconoscimenti
Ringraziamo Allan Knopf e Dan Langhorst per l’assistenza nella misurazione dei titoli ormonali. Ringraziamo anche David Denlinger per i commenti utili sulle versioni precedenti del manoscritto. L’uso di nomi commerciali o prodotti commerciali in questo articolo ha il solo scopo di fornire informazioni specifiche e non implica raccomandazione o approvazione da parte del Dipartimento dell’Agricoltura degli Stati Uniti. USDA è un fornitore di pari opportunità e datore di lavoro.
Materiale supplementare
R Core Team (2019). R: Un linguaggio e un ambiente per il calcolo statistico. Vienna: R squadra principale.
Google Scholar
Väremo, L., Nielsen, J., e Nookaew, I. (2013). Arricchire l’analisi genica dei dati genomici incorporando la direzionalità dell’espressione genica e combinando ipotesi e metodi statistici. Acidi nucleici Res. 41, 4378-4391. doi: 10.1093/nar / gkt111
PubMed Abstract / CrossRef Full Text / Google Scholar