INTRODUZIONE
La tachicardia ectopica giunzionale acuta (JET) può comparire dopo l’intervento chirurgico per difetti cardiaci congeniti. Sebbene sia autolimitante entro 48-72 h, la mortalità in assenza di trattamento immediato è del 40% 1 a causa dell’elevata frequenza cardiaca (HR) e della dissociazione atrioventricolare (AVD). La scarsa risposta al trattamento farmacologico ha portato alla ricerca di altre opzioni di trattamento, tra cui l’ipotermia moderata.2 Questo trattamento, descritto per la prima volta nel 1987,3, è stato riportato raramente in letteratura e tutte le segnalazioni riguardano un basso numero di pazienti.
PAZIENTI E METODO
Pazienti
Abbiamo esaminato le cartelle cliniche di pazienti operati per difetti cardiaci congeniti tra settembre 1999 e ottobre 2001 presso l’Área Infantil del Corazón (Servizio cardiaco pediatrico) del complesso ospedaliero Juan Canalejo di A Coruña, nel nord-ovest della Spagna. Sono stati esaminati elettrocardiogrammi standard, così come gli elettrogrammi atriali registrati durante gli episodi di aritmia con gli elettrodi atriali posizionati durante l’intervento chirurgico o con elettrodi esofagei. Solo i pazienti con GETTO confermato o probabile che sono stati trattati con ipotermia sono stati inclusi in questo studio.
Criteri diagnostici
– GETTO confermato: a) tachicardia con un complesso QRS simile al tracciato basale o ad un tracciato ottenuto mediante stimolazione atriale, insieme a b) AVD con frequenza atriale più lenta rispetto alla frequenza ventricolare.
– Probabile GETTO: registrato quando il criterio 1 come notato sopra è stato soddisfatto ma non è stato possibile dimostrare AVD, o quando c’era una conduzione retrograda 1:1 e l’aritmia non rispondeva alla cardioversione elettrica o all’iperstimolazione atriale.
Trattamento
Il trattamento del GETTO si basava su: a) misure di base (diminuzione dell’uso di agenti inotropi, sedazione, correzione dello squilibrio elettrolitico); b) pacemaker (per ripristinare la sincronia atrioventricolare stabilendo un HR più veloce di quello causato dal GETTO); c) ipotermia e d) farmaci antiaritmici. La digossina è stata utilizzata per il supporto inotropico e diuretico in alcuni pazienti.
L’ipotermia è stata iniziata quando lo stato emodinamico si è deteriorato nonostante le misure di base o quando non è stato possibile mantenere un tasso di pacemaker più veloce del tasso di JET. Tutti i pazienti sono stati sedati e posti in ventilazione meccanica con rilassanti muscolari. Sono stati utilizzati ventilatori, impacchi freddi posti sulla pelle e lavaggio con soluzione salina fisiologica fredda tramite un sondino nasogastrico. La temperatura è stata abbassata fino a quando la velocità del GETTO è diminuita, ma mai al di sotto di 33 ºC come misurato con un termometro rettale. I pazienti sono stati riscaldati lentamente (1 ºC/8 h) dopo almeno 36 h di stabilità emodinamica (adeguata pressione venosa centrale, pressione arteriosa e diuresi) aumentando le fonti di calore esterne sotto costante monitoraggio elettrocardiografico. Nei pazienti trattati con un pacemaker, questo trattamento è stato interrotto quando è apparso il normale ritmo sinusale o quando la velocità del GETTO è diminuita al di sotto del 75 ° percentile di normalità in base all’età.
Analisi statistica
Le variabili quantitative sono espresse come media±deviazione standard e la mediana è riportata anche per le variabili la cui distribuzione era marcatamente asimmetrica. Le variabili categoriali sono espresse come valori assoluti (percentuali). I cambiamenti nei valori emodinamici ottenuti a 1, 2, 4, 8, 12 y 24 h dall’inizio dell’ipotermia sono stati analizzati con MANOVA per le tendenze lineari per le misure ripetute; la normale distribuzione dei dati è stata verificata in anticipo con il test Shapiro-Wilks. Le differenze sono state considerate significative con P
RISULTATI
UN totale di 138 pazienti sottoposti a chirurgia cardiaca pediatrica con bypass cardiopolmonare; 21 (15.2%), sviluppato confermato o probabile, dei JET, e l’ipotermia è stata utilizzata in 12 pazienti analizzati (9 ragazze, età media 2.1±2.0 mesi) (Tabella 1). L’inizio del GETTO è stato registrato 6,3±11,9 h dopo l’operazione (mediana, 2 h). In quel momento, la temperatura era di 37,0±0,7 °C (Tabella 2). L’ipotermia è stata iniziata 1,5±0,5 h dopo l’inizio del GETTO (mediana, 1,0 h) ed è durata 74±42 h (intervallo, 36-144 h). Durante l’ipotermia, la digossina è stata utilizzata in 6 pazienti e in 4 di questi amiodarone è stato somministrato anche per il supporto durante l’ipotermia. Un pacemaker è stato utilizzato in 10 pazienti: in 9, gli elettrodi epicardici sono stati collocati nella sala operatoria e in 1 è stato utilizzato un elettrodo esofageo.
Le variazioni della temperatura centrale e dello stato emodinamico durante le prime 24 ore sono mostrate nella Figura 1. I maggiori miglioramenti sono stati ottenuti durante le prime 4 ore di ipotermia, dopo di che i pazienti sono rimasti stabili.
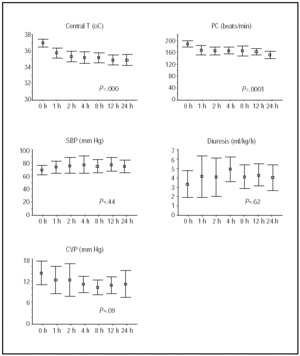
Fig. 1. Corso durante le prime 24 ore di ipotermia. Le linee illustrano le medie e gli intervalli di confidenza del 95%. I valori P si riferiscono ai test di trend lineari MANOVA per le misure ripetute. HR indica la frequenza cardiaca; battiti / min, battiti al minuto; T, temperatura; SBP, pressione arteriosa sistolica; CVP, pressione venosa centrale.
Tutti i pazienti tranne uno sono sopravvissuti. Il bambino che è morto aveva uno stato di uscita basso secondario al JET, che era refrattario al trattamento. Non ci sono state complicazioni direttamente attribuibili all’ipotermia. Al momento del rewarming, 5 pazienti hanno continuato ad avere JET; uno ha richiesto il ricooling a causa di un significativo aumento dell’HR. Prevalentemente il ritmo sinusale è riapparso 65±38 h dopo l’inizio dell’ipotermia. Due dei 6 pazienti che hanno recuperato un normale ritmo sinusale durante l’ipotermia hanno richiesto il raffreddamento perché JET e rapid HR sono riapparsi.
Gli 11 pazienti che sono stati dimessi sono rimasti in vita e non hanno avuto sequela neurologica dopo un periodo medio di follow-up di 15±12 mesi (intervallo, 2-36 mesi). Il ritmo sinusale è stato mantenuto senza aritmia durante il follow-up.
DISCUSSIONE
Il GETTO postoperatorio nasce da un fuoco ectopico situato nel tessuto nodale o nel fascio di His ed è indotto da irritazione meccanica durante l’intervento chirurgico.2 La sua natura ectopica lo rende sensibile all’equilibrio simpatico-vagale e resistente all’iperstimolazione atriale o alla cardioversione elettrica. L’alta HR e AVD diminuiscono la gittata cardiaca, e questo a sua volta accelera l’aritmia a causa dell’aumento del tono adrenergico, creando così un circolo vizioso.1,2 Poiché il processo è autolimitante entro 48-72 h, 2 l’obiettivo principale del trattamento è il mantenimento di un’adeguata produzione cardiaca fino a quando l’aritmia non si risolve spontaneamente.
Il trattamento deve includere1, 2, 4, 5 correzione dello squilibrio elettrolitico e dello squilibrio acido-base, rimozione degli stimoli adrenergici (dolore, irritazione, ansia), sedazione appropriata e diminuzione dei livelli di agenti inotropi e vasodilatatori, che accelerano HR e JET.2 La risposta ai farmaci antiaritmici è scarsa, 2 e la digossina non è efficace.5 Il propafenone sembra avere qualche beneficio, 6 nonostante sia un agente inotropico negativo. L’amiodarone è utile7, 8 sebbene nella nostra esperienza possa richiedere un’espansione del volume a causa della comparsa di ipotensione. La procainamide è efficace in combinazione con l’ipotermia solo quando l’ipotermia da sola è insufficiente.5 Il ruolo dei beta bloccanti è controverso, 2 e gli antagonisti del calcio non sono raccomandati. Altre opzioni di trattamento sono varie modalità di stimolazione con pacemaker e rapida ablazione del fascio di His in casi refrattari.1,2
La diagnosi precoce è fondamentale. Quando si sospetta il GETTO, è necessario eseguire un elettrocardiogramma a 12 conduttori e un elettrogramma atriale.9 Nella nostra serie di pazienti, l’elettrografia atriale ha permesso di smascherare AVD in 2 pazienti e confermare il sospetto in 6 pazienti in cui l’elettrocardiogramma di superficie era indicativo di AVD (Figura 2).
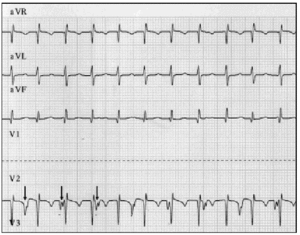
Fig. 2. Tracciatura elettrocardiografica del JET, inclusi i cavi aVR, aVL e aVF. Il tracciato inferiore mostra l’elettrogramma atriale ed è stato ottenuto collegando il cavo solitamente utilizzato per l’elettrodo V2 all’elettrodo epicardico atriale. Questa traccia mostra un aumento dell’attività atriale (frecce); la dissociazione atrioventricolare è evidente dal tasso atriale più lento rispetto alla frequenza ventricolare.
Il trattamento con ipotermia si basa sull’osservazione che la diminuzione della temperatura centrale riduce l’automaticità delle cellule pacemaker. Dal momento che il primo rapporto di questo trattamento è stato pubblicato da Bash et al., nel 1987,3 sono apparsi rapporti sparsi sull’uso riuscito dell’ipotermia in un piccolo numero di pazienti.9,10 L’obiettivo di questi interventi era di raggiungere una temperatura centrale di 32-35 °C. Il nostro obiettivo era quello di ridurre HR fino a quando un adeguato trattamento pacemaker è diventato possibile, e quindi evitare l’ipotermia profonda e i suoi possibili effetti collaterali. In 2 pazienti non sono stati utilizzati pacemaker perché non erano disponibili elettrodi epicardici atriali. In considerazione del loro buon decorso clinico abbiamo deciso di non utilizzare un elettrodo esofageo. A causa del nostro progetto di studio, non è stato possibile giudicare l’utilità relativa della digossina e dell’amiodarone somministrati durante l’ipotermia nel controllo dell’HR.
In questa serie di pazienti l’ipotermia associata all’uso di un pacemaker era un’opzione efficace e sicura. I cambiamenti emodinamici si sono verificati entro poche ore e non sono stati osservati effetti collaterali direttamente attribuibili all’ipotermia. Sebbene il piccolo numero di pazienti che abbiamo studiato non ci consenta di generalizzare, il tasso di mortalità nella nostra serie dell ‘ 8,3% era chiaramente inferiore alla cifra del 40% riportata per il trattamento conservativo.1 Il bambino che è morto era uno dei primi pazienti della serie e aveva una tachicardia molto rapida, che potrebbe spiegare il fallimento dell’ipotermia.
Il rewarming è stato iniziato dopo almeno 36 ore di stabilità emodinamica senza attendere il recupero di un ritmo sinusale stabile. La probabilità che sarebbe stato necessario recooling (27%) non era correlato con il ritmo sinusale o JET, e quindi riteniamo che rewarming può essere temporizzato sulla base di criteri emodinamici da solo.
I limiti del nostro studio sono quelli inerenti a qualsiasi analisi retrospettiva e osservazionale basata su un piccolo numero di pazienti senza gruppo di controllo. Tuttavia, riteniamo che i nostri risultati, insieme ad altri rapporti pubblicati, supportino l’uso dell’ipotermia come trattamento efficace e sicuro per la gestione del GETTO postoperatorio.