Nome generico: sodio polistirene sulfonato
Forma di dosaggio: orale, rettale powder
Medicamente recensito da Drugs.com. Ultimo aggiornamento il 21 settembre 2020.
- Panoramica
- Effetti Collaterali
- Dosaggio
- Professional
- Interazioni
- Più
- Kalexate Polvere Descrizione
- Polvere di Kalexate-Farmacologia clinica
- Indicazioni e utilizzo per la polvere di Kalexate
- Controindicazioni
- Avvertenze
- Precauzioni
- Interazioni farmacologiche
- Madri che allattano
- Uso pediatrico
- Reazioni avverse
- Sovradosaggio
- Dosaggio e somministrazione di polvere di Kalexate
- Come viene fornita la polvere di Kalexate
- ETICHETTA CONFEZIONE.PANNELLO PRINCIPALE
- di Più su Kalexate (polistirene sulfonato di sodio)
- risorse per i Consumatori
- risorse Professionali
- relativo trattamento guide
Kalexate Polvere Descrizione
Polistirene Sulfonato di Sodio (USP), è una benzene, diethenyl-polimero, con etenilbenzene, solfonato di sodio, il sale ed ha la seguente formula di struttura:
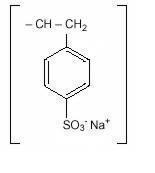
La droga è una crema al marrone chiaro, finemente tritati, macinati forma di polistirene sulfonato di sodio, una resina a scambio cationico preparato di sodio fase con un sistema in vitro la capacità di scambio di circa 3.1 mEq (in vivo circa 1 mEq) di potassio per grammo. Il contenuto di sodio è di circa 100 mg (4,1 mEq) per grammo del farmaco. Può essere somministrato per via orale o in un clistere.
Polvere di Kalexate-Farmacologia clinica
Poiché la resina passa lungo l’intestino o viene trattenuta nel colon dopo la somministrazione mediante clistere, gli ioni sodio vengono parzialmente rilasciati e vengono sostituiti da ioni potassio. Per la maggior parte, questa azione si verifica nell’intestino crasso, che espelle gli ioni di potassio in misura maggiore rispetto all’intestino tenue. L’efficienza di questo processo è limitata e imprevedibile variabile. Si avvicina comunemente l’ordine del 33 per cento, ma la gamma è così grande che gli indici definitivi di bilancio elettrolitico devono essere chiaramente monitorati.
I dati metabolici non sono disponibili.
Indicazioni e utilizzo per la polvere di Kalexate
Sodio polistirene solfonato, USP è indicato per il trattamento dell’iperkaliemia.
Controindicazioni
Sodio polistirene solfonato, USP è controindicato nelle seguenti condizioni: pazienti con ipopotassiemia, pazienti con anamnesi di ipersensibilità alle resine di polistirene solfonato, malattia intestinale ostruttiva, neonati con ridotta motilità intestinale (postoperatoria o indotta da farmaci) e somministrazione orale nei neonati (vedere PRECAUZIONI).
Avvertenze
Necrosi intestinale: Casi di necrosi intestinale, che possono essere fatali, e altri gravi eventi avversi gastrointestinali (sanguinamento, colite ischemica, perforazione) sono stati riportati in associazione con l’uso di sodio polistirene solfonato, USP. La maggior parte di questi casi ha riportato l’uso concomitante di sorbitolo. I fattori di rischio per gli eventi avversi gastrointestinali erano presenti in molti dei casi compreso prematurità, storia della malattia intestinale o chirurgia, ipovolemia ed insufficienza e guasto renali. La somministrazione concomitante di sorbitolo non è raccomandata (vedere PRECAUZIONI, interazioni farmacologiche).
• Usare solo in pazienti con normale funzione intestinale. Evitare l’uso in pazienti che non hanno avuto un movimento intestinale dopo l’intervento chirurgico.
• Evitare l’uso in pazienti che sono a rischio di sviluppare costipazione o compressione (compresi quelli con anamnesi di compressione, costipazione cronica, malattia infiammatoria intestinale, colite ischemica, aterosclerosi vascolare intestinale, precedente resezione intestinale o ostruzione intestinale).
• Interrompere l’uso in pazienti che sviluppano costipazione.
Terapia Alternativa in Grave Iperkaliemia
Dato che l’effettivo abbassamento dei livelli di potassio sierico con Polistirene Sulfonato di Sodio (USP) può richiedere ore, giorni, il trattamento con questo farmaco da solo potrebbe non essere sufficiente a correggere rapidamente grave iperkaliemia associati a stati di rapida rottura del tessuto (ad esempio, ustioni e insufficienza renale) o iperkaliemia contrassegnate in modo da costituire un’emergenza medica. Pertanto, altre misure definitive, compresa la dialisi, dovrebbero sempre essere prese in considerazione e potrebbero essere imperative.
Ipopotassiemia
Grave carenza di potassio può verificarsi dalla terapia con polistirene solfonato di sodio, USP. L’effetto deve essere attentamente controllato da frequenti determinazioni del potassio sierico entro ogni periodo di 24 ore. Poiché la carenza di potassio intracellulare non è sempre riflessa dai livelli sierici di potassio, il livello al quale il trattamento con polistirene solfonato di sodio, USP deve essere interrotto deve essere determinato individualmente per ciascun paziente. Aiuti importanti nel fare questa determinazione sono le condizioni cliniche del paziente e l’elettrocardiogramma. I primi segni clinici di ipopotassiemia grave includono un modello di confusione irritabile e processi di pensiero ritardati.
Elettrocardiograficamente, l’ipopotassiemia grave è spesso associata ad un intervallo Q-T allungato, allargamento, appiattimento o inversione dell’onda T e onde U prominenti. Inoltre, possono verificarsi aritmie cardiache, come contrazioni atriali premature, nodali e ventricolari e tachicardie sopraventricolari e ventricolari. Gli effetti tossici della digitale sono probabilmente esagerati. L’ipopotassiemia marcata può anche manifestarsi con grave debolezza muscolare, a volte estendendosi alla paralisi franca.
Disturbi elettrolitici
Come tutte le resine a scambio cationico, il polistirene solfonato di sodio, USP non è totalmente selettivo (per il potassio) nelle sue azioni e piccole quantità di altri cationi come il magnesio e il calcio possono anche essere persi durante il trattamento. Di conseguenza, i pazienti che ricevono sodio polistirene solfonato, USP devono essere monitorati per tutti i disturbi elettrolitici applicabili.
Alcalosi sistemica
È stata riportata alcalosi sistemica dopo che le resine a scambio cationico sono state somministrate per via orale in combinazione con antiacidi non assorbibili che donano cationi e lassativi come l’idrossido di magnesio e il carbonato di alluminio. L’idrossido di magnesio non deve essere somministrato con sodio polistirene solfonato, USP. Un caso di attacco di grand mal è stato riportato in un paziente con ipocalcemia cronica di insufficienza renale a cui è stato somministrato Sodio polistirene solfonato, USP con idrossido di magnesio come lassativo. (Vedere PRECAUZIONI, interazioni farmacologiche.)
Precauzioni
Si consiglia cautela quando il polistirene solfonato di sodio, USP viene somministrato a pazienti che non possono tollerare anche un piccolo aumento dei carichi di sodio (cioè, grave insufficienza cardiaca congestizia, ipertensione grave o edema marcato). In tali casi può essere indicata una restrizione compensativa dell’assunzione di sodio da altre fonti.
In caso di stitichezza clinicamente significativa, il trattamento con Sodio polistirene solfonato, USP deve essere interrotto fino alla ripresa del normale movimento intestinale (vedere AVVERTENZE, Necrosi intestinale).
Interazioni farmacologiche
Antiacidi
La somministrazione orale simultanea di sodio polistirene solfonato, USP con antiacidi e lassativi non assorbibili che donano cationi può ridurre la capacità di scambio di potassio della resina.
Antiacidi e lassativi non assorbibili che donano cationi
Alcalosi sistemica è stata riportata dopo che le resine a scambio cationico sono state somministrate per via orale in combinazione con antiacidi e lassativi non assorbibili che donano cationi come l’idrossido di magnesio e il carbonato di alluminio. L’idrossido di magnesio non deve essere somministrato con sodio polistirene solfonato, USP. Un caso di attacco di grand mal è stato riportato in un paziente con ipocalcemia cronica di insufficienza renale a cui è stato somministrato sodio polistirene solfonato, USP con idrossido di magnesio come lassativo.
Ostruzione intestinale dovuta a concrezioni di idrossido di alluminio quando usato in combinazione con sodio polistirene solfonato, è stata riportata USP.
Digitale
Gli effetti tossici della digitale sul cuore, in particolare varie aritmie ventricolari e dissociazione nodale A-V, sono probabilmente esagerati dall’ipopotassiemia, anche a fronte delle concentrazioni sieriche di digossina nel “range normale”. (Vedere AVVERTENZE).
Sorbitolo
L’uso concomitante di sorbitolo con Sodio polistirene solfonato, USP è stato implicato in casi di necrosi intestinale, che può essere fatale. Pertanto, la somministrazione concomitante non è raccomandata. (Vedere AVVERTENZE).
Litio
Sodio polistirene solfonato, USP può diminuire l’assorbimento di litio.
Tiroxina
Sodio polistirene solfonato, USP può diminuire l’assorbimento di tiroxina.
Carcinogenesi, mutagenesi, Compromissione della fertilità
Non sono stati condotti studi.
Gravidanza Categoria C
Non sono stati condotti studi sulla riproduzione animale con Sodio polistirene solfonato, USP. Inoltre non è noto se il polistirene solfonato di sodio, USP può causare danni fetali quando somministrato a una donna incinta o può influenzare la capacità di riproduzione. Il polistirene solfonato di sodio, USP deve essere somministrato a una donna incinta solo se chiaramente necessario.
Madri che allattano
Non è noto se questo farmaco sia escreto nel latte umano. Poiché molti farmaci sono escreti nel latte umano, si deve usare cautela quando il polistirene solfonato di sodio, USP viene somministrato a una donna che allatta.
Uso pediatrico
L’efficacia del polistirene solfonato di sodio, USP nei pazienti pediatrici non è stata stabilita. Nei neonati, il polistirene solfonato di sodio, USP non deve essere somministrato per via orale. Sia nei bambini che nei neonati si deve prestare particolare attenzione con la somministrazione rettale, poiché un dosaggio eccessivo o una diluizione inadeguata potrebbero causare l’azione della resina.
A causa del rischio di emorragia digestiva o necrosi intestinale, si deve osservare particolare attenzione nei neonati prematuri o nei neonati a basso peso alla nascita.
Reazioni avverse
Sodio polistirene solfonato, USP può causare un certo grado di irritazione gastrica. Anoressia, nausea, vomito e stitichezza possono verificarsi soprattutto se vengono somministrate dosi elevate. Inoltre, possono verificarsi ipopotassiemia, ipocalcemia, ipomagnesiemia e significativa ritenzione di sodio e le loro manifestazioni cliniche correlate (vedere AVVERTENZE). Occasionalmente si sviluppa la diarrea. Grandi dosi in individui anziani possono causare l’impaction fecale (vedi PRECAUZIONI). Sono stati riportati rari casi di necrosi intestinale. È stata riportata ostruzione intestinale dovuta a concrezioni di idrossido di alluminio, se usato in combinazione con sodio polistirene solfonato, USP.
Nell’esperienza mondiale post marketing sono stati riportati i seguenti eventi:
• Ostruzione fecale a seguito di somministrazione rettale, in particolare nei bambini;
• Colite ischemica, ulcerazione o necrosi del tratto gastrointestinale che potrebbe portare a perforazione intestinale; e,
• Rari casi di bronchite acuta e / o bronco-polmonite associati all’inalazione di particelle di polistirene solfonato.
Sovradosaggio
Il sovradosaggio può causare disturbi elettrolitici tra cui ipopotassiemia, ipocalcemia e ipomagnesiemia .Disturbi biochimici derivanti da sovradosaggio possono dare origine a segni clinici e sintomi di ipopotassiemia, tra cui: irritabilità, confusione, processi di pensiero ritardati, debolezza muscolare, iporeflessia, che possono progredire a paralisi franca e/o apnea. Può verificarsi tetania. I cambiamenti elettrocardiografici possono essere coerenti con ipopotassiemia o ipercalcemia; possono verificarsi aritmie cardiache. Devono essere prese misure appropriate per correggere gli elettroliti sierici (potassio, calcio, magnesio) e la resina deve essere rimossa dal tratto alimentare mediante l’uso appropriato di lassativi o clisteri.
Dosaggio e somministrazione di polvere di Kalexate
La sospensione di questo farmaco deve essere preparata al momento e non conservata oltre le 24 ore.
La dose media giornaliera per adulti della resina va da 15 g a 60 g. Questo è meglio fornito somministrando 15 g (circa 4 cucchiaini di livello) di sodio polistirene solfonato, USP da una a quattro volte al giorno. Un grammo di sodio polistirene solfonato, USP contiene 4,1 mEq di sodio; un cucchiaino di livello contiene circa 3,5 g di sodio polistirene solfonato, USP e 15 mEq di sodio. (Un cucchiaino colmo può contenere fino a 10 g a 12 g di sodio polistirene solfonato, USP.) Poiché l’efficienza in vivo delle resine a scambio sodio-potassio è di circa il 33%, circa un terzo del contenuto effettivo di sodio della resina viene consegnato al corpo.
Nei bambini più piccoli e nei neonati, dosi più basse devono essere impiegate utilizzando come base di calcolo una velocità di 1 mEq di potassio per grammo di resina.
Ogni dose deve essere somministrata come sospensione in una piccola quantità di acqua o, per una maggiore appetibilità, in sciroppo. La quantità di liquido varia solitamente da 20 mL a 100 mL, a seconda della dose, o può essere semplicemente determinata consentendo da 3 mL a 4 mL per grammo di resina. Gli operatori sanitari devono seguire tutte le precauzioni di aspirazione quando somministrano questo prodotto, come posizionare e mantenere il paziente in posizione verticale mentre viene somministrata la resina.
La resina può essere introdotta nello stomaco attraverso un tubo di plastica e, se lo si desidera, miscelata con una dieta appropriata per un paziente in insufficienza renale.
La resina può anche essere somministrata, anche se con risultati meno efficaci, in un clistere composto (per gli adulti) da 30 g a 50 g ogni sei ore. Ogni dose viene somministrata come emulsione calda (a temperatura corporea) in 100 ml di veicolo acquoso. L’emulsione deve essere agitata delicatamente durante la somministrazione. Il clistere deve essere mantenuto il più a lungo possibile e seguito da un clistere purificante.
Dopo un clistere di pulizia iniziale, un tubo di gomma morbido, di grandi dimensioni (francese 28) viene inserito nel retto per una distanza di circa 20 cm, con la punta ben nel colon sigmoideo, e registrato in posizione. La resina viene quindi sospesa nella giusta quantità di veicolo acquoso a temperatura corporea e introdotta per gravità, mentre le particelle vengono mantenute in sospensione mescolando. La sospensione viene lavata con 50 mL o 100 mL di liquido, dopodiché il tubo viene bloccato e lasciato in posizione. Se si verifica una perdita di schiena, i fianchi sono elevati sui cuscini o una posizione del ginocchio-torace viene presa temporaneamente. Si può usare una sospensione un po ‘ più spessa, ma bisogna fare attenzione che non si formi pasta, perché quest’ultima ha una superficie di scambio notevolmente ridotta e sarà particolarmente inefficace se depositata nell’ampolla rettale. La sospensione viene mantenuta nel colon sigmoideo per diverse ore, se possibile. Quindi, il colon viene irrigato con una soluzione contenente nonsodio a temperatura corporea per rimuovere la resina. Possono essere necessari due litri di soluzione di lavaggio. I ritorni sono vuotati costantemente attraverso un collegamento del tubo di Y. Mentre l’uso di sorbitolo non è raccomandato, particolare attenzione deve essere prestata a questo clistere purificante se è stato usato sorbitolo
L’intensità e la durata della terapia dipendono dalla gravità e dalla resistenza dell’iperkaliemia.
Sodio polistirene solfonato, USP non deve essere riscaldato per farlo può alterare le proprietà di scambio della resina.
Come viene fornita la polvere di Kalexate
Sodio polistirene solfonato, USP è disponibile come crema per marrone chiaro, polvere finemente macinata in barattoli da 1 libbra (454 g),
NDC 10702-036-45.
Conservare a 20° a 25° C (68°a 77 ° F) con escursioni consentite tra 15° a 30 ° C (59° a 86°F) .
Rx Solo
Prodotto da:
KVK-TECH INC.
110 Unità Terry
Newtown, PA 18940 Stati Uniti d’America.
Codice articolo # 006067/04
Codice produttore: 10702 10/13
ETICHETTA CONFEZIONE.PANNELLO PRINCIPALE
454 g Etichetta barattolo
NDC 10702-036-45
SODIO POLISTIRENE SOLFONATO, USP
RESINA A SCAMBIO CATIONICO
454 g
Rx Solo
Media dose per adulti: 15 g (circa 4 cucchiaini di livello) da una a quattro volte al giorno in acqua. Vedere informazioni complete sulla prescrizione.
L ‘ effetto deve essere attentamente controllato mediante frequenti determinazioni del potassio sierico entro ogni periodo di 24 ore. Contenuto di sodio circa 60 mEq per 15 g.
La sospensione deve essere preparata al momento e non conservata oltre le 24 ore. Dispensare in contenitori stretti e resistenti alla luce come definito nella compendia ufficiale.
Conservare a 20° a 25° C (68°a 77 ° F) con escursioni consentite tra 15° a 30 ° C (59° a 86°F) .
KVK-TECH, INC.

| KALEXATE sodium polystyrene sulfonate powder |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – KVK-Tech, Inc. (173360061)
Sito ufficiale (173360061)
| Struttura | |||
| Nome | Indirizzo | ID/FEI | Operazioni |
| KVK-Tech, Inc. | 173360061 | FABBRICAZIONE IN CUI(10702-036) | |
di Più su Kalexate (polistirene sulfonato di sodio)
- Effetti Collaterali
- Durante la Gravidanza o l’Allattamento al seno
- Dosaggio di Informazioni
- interazioni Farmacologiche
- Prezzi & Coupon
- spagnolo
- classe di Droga: resine a scambio cationico
- FDA Avvisi (2)
risorse per i Consumatori
- Informazioni Paziente
risorse Professionali
- Informazioni prescrittive
- Polistirene Sulfonato di Sodio Orale Polvere (FDA)
Altre marche Kayexalate, Kionex
relativo trattamento guide
- Iperkaliemia
Disclaimer Medico