Forma di dosaggio: aerosol, foam
Medicamente recensito da Drugs.com. Ultimo aggiornamento il set 1, 2019.
- Panoramica
- Effetti Collaterali
- Dosaggio
- Professional
- Gravidanza
- Più
- Indicazioni e Utilizzo per Ketoconazole Schiuma
- Ketoconazole Foam Dosaggio e somministrazione
- Forme di dosaggio e dosaggi
- Controindicazioni
- Avvertenze e precauzioni
- Sensibilizzazione da contatto
- Contenuto infiammabile
- Effetti sistemici
- Reazioni avverse
- Esperienza negli studi clinici
- Studi di sicurezza cutanea
- Esperienza post-marketing
- USO IN POPOLAZIONI SPECIFICHE
- Gravidanza
- Allattamento
- Femmine e maschi con potenziale riproduttivo
- Uso pediatrico
- Uso geriatrico
- Ketoconazole Foam Descrizione
- Schiuma di ketoconazolo – Farmacologia clinica
- Meccanismo d’azione
- Farmacodinamica
- Farmacocinetica
- Microbiologia
- Tossicologia non clinica
- Carcinogenesi, mutagenesi, compromissione della fertilità
- Studi clinici
- Come Dotazione/Stoccaggio e la Movimentazione di
- Informazioni sulla consulenza del paziente
- Istruzioni per l’uso
- INFORMAZIONI PAZIENTE
- CONFEZIONE/ETICHETTA PANNELLO PRINCIPALE – CARTONE
- Più su ketoconazole attualità)
- Consumer resources
- Professional resources
- Related treatment guides
Indicazioni e Utilizzo per Ketoconazole Schiuma
Ketoconazole Schiuma, il 2% è indicato per il trattamento topico di dermatite seborroica in pazienti immunocompetenti 12 anni di età e anziani.
Limitazioni d’uso
La sicurezza e l’efficacia della schiuma di ketoconazolo, 2% per il trattamento delle infezioni fungine non sono state stabilite.
Ketoconazole Foam Dosaggio e somministrazione
Ketoconazole Foam, 2% deve essere applicato alla zona interessata(s) due volte al giorno per quattro settimane.
Tenere il contenitore in posizione verticale, ed erogare schiuma di ketoconazolo, 2% nel tappo della lattina o altra superficie fredda in una quantità sufficiente a coprire la zona interessata(s). L’erogazione direttamente sulle mani non è raccomandata, poiché la schiuma inizierà a sciogliersi immediatamente a contatto con la pelle calda. Raccogliere piccole quantità di schiuma di ketoconazolo, 2% con la punta delle dita, e massaggiare delicatamente nella zona interessata(s) fino a quando la schiuma scompare. Per le aree portanti, separare i capelli, in modo che la schiuma di ketoconazolo, 2% possa essere applicata direttamente sulla pelle (piuttosto che sui capelli).
Evitare il contatto con gli occhi e le altre mucose. La schiuma di ketoconazolo, 2% non è per uso oftalmico, orale o intravaginale.
Forme di dosaggio e dosaggi
Schiuma di ketoconazolo, 2% contiene 20 mg di ketoconazolo, USP per grammo, fornito in contenitori da 50 g e 100 g.
Controindicazioni
Nessuna.
Avvertenze e precauzioni
Sensibilizzazione da contatto
La schiuma di ketoconazolo, 2% può provocare sensibilizzazione da contatto, inclusa la fotoallergenicità.
Contenuto infiammabile
Il contenuto di schiuma di ketoconazolo, 2% include alcool e propano/butano, che sono infiammabili. Evitare incendi, fiamme e / o fumo durante e immediatamente dopo l’applicazione. Non forare e / o incenerire i contenitori. Non esporre i contenitori al calore e / o conservare a temperature superiori a 49°C (120°F).
Effetti sistemici
L’epatite è stata osservata con ketoconazolo somministrato per via orale (incidenza riportata di 1:10.000). Bassi livelli sierici di corticosteroidi indotti da ACTH e testosterone sono stati osservati con alte dosi di ketoconazolo somministrato per via orale. Questi effetti non sono stati osservati con ketoconazolo topico.
Reazioni avverse
Esperienza negli studi clinici
Poiché gli studi clinici sono condotti in condizioni molto diverse, le percentuali di reazioni avverse osservate negli studi clinici di un farmaco non possono essere confrontate direttamente con le percentuali negli studi clinici di un altro farmaco e potrebbero non riflettere le percentuali osservate nella pratica. Le informazioni sulle reazioni avverse provenienti dagli studi clinici forniscono tuttavia una base per identificare le reazioni avverse che sembrano essere correlate all’uso di droghe e per approssimare i tassi.
I dati di sicurezza presentati nella Tabella 1 riflettono l’esposizione alla schiuma di ketoconazolo, 2% in 672 soggetti di età pari o superiore a 12 anni con dermatite seborroica. I soggetti hanno applicato schiuma di ketoconazolo, 2% o schiuma per veicoli due volte al giorno per 4 settimane alle aree interessate del viso, del cuoio capelluto e/o del torace. Le reazioni avverse che si verificano in > 1% dei soggetti sono riportate nella Tabella 1.
Tabella 1: Reazioni avverse Riportate da >1% dei Soggetti in sperimentazione Clinica
|
Reazioni Avverse |
Ketoconazolo Schiuma, 2% N=672 n (%) |
Veicolo Schiuma N=497 n (%) |
|
i Soggetti con una Reazione Avversa |
188 (28%) |
122 (25%) |
|
bruciore al sito di Applicazione |
67 (10%) |
49 (10%) |
|
Reazione del sito di applicazione |
41 (6%) |
24 (5%) |
Le reazioni al sito di applicazione riportate in <1% dei soggetti sono state secchezza, eritema, irritazione, parestesia, prurito, eruzione cutanea e calore.
Studi di sicurezza cutanea
In uno studio di fotoallergenicità, 9 soggetti su 53 (17%) hanno avuto reazioni durante il periodo di challenge sia nei siti irradiati che non irradiati trattati con schiuma di ketoconazolo, 2%. Schiuma di ketoconazolo, 2% può causare sensibilizzazione al contatto.
Esperienza post-marketing
I seguenti eventi avversi sono stati identificati durante l’uso post-marketing di Ketoconazolo Foam, 2%:
Patologie gastrointestinali: Cheilite
Patologie generali e condizioni relative alla sede di somministrazione: Dolore e ustione nel sito di applicazione
Patologie della cute e del tessuto sottocutaneo: Sensazione di bruciore della pelle ed eritema
Poiché questi eventi sono segnalati volontariamente da una popolazione di dimensioni incerte, non è sempre possibile stimare in modo affidabile la loro frequenza o stabilire una relazione causale con l’esposizione al farmaco.
USO IN POPOLAZIONI SPECIFICHE
Gravidanza
Riassunto del rischio
Non ci sono dati disponibili sulla schiuma di ketoconazolo, 2% uso in donne in gravidanza per identificare un rischio associato al farmaco di gravi difetti alla nascita, aborto spontaneo o esiti avversi materni o fetali. Non sono stati effettuati studi riproduttivi su animali con schiuma di ketoconazolo, 2%. In studi sulla riproduzione animale su topi, ratti e conigli gravidi sono stati osservati effetti sia embriotossici che sullo sviluppo (anomalie strutturali) dopo somministrazione orale di ketoconazolo durante l’organogenesi. Assumendo un assorbimento sistemico equivalente di dosi topiche e orali di ketoconazolo e una schiuma di ketoconazolo, dose massima raccomandata (MRHD) del 2% di 8 grammi (equivalente a 160 mg di ketoconazolo), sono stati osservati effetti embriotossici a 0,8-2,4 volte la MRHD e effetti sullo sviluppo a 4.8 volte il MRHD .
Il rischio di base di gravi difetti alla nascita e aborto spontaneo per la popolazione indicata non è noto. Tutte le gravidanze hanno un rischio di fondo di difetto di nascita, perdita o altri esiti avversi. Nella popolazione generale degli Stati Uniti, il rischio di fondo stimato di gravi difetti alla nascita e aborto spontaneo in gravidanze clinicamente riconosciute è 2-4% e 15-20%, rispettivamente.
Dati
Animali
L’animale multipli di esposizione umana calcoli sono basati sulla superficie corporea (BSA) confronti orale di dosi somministrate agli animali e un Ketoconazole Schiuma, 2% massima dose raccomandata nell’uomo (MRHD) di 8 grammi (equivalente a 2.67 mg di ketoconazolo/kg/die per 60 kg di singoli o 98.8 mg di ketoconazolo/m2/giorno).
Sono stati condotti studi di sviluppo embriofetale in topi, ratti e conigli con ketoconazolo somministrato per via orale. Quando somministrato per via orale a topi nei giorni gestazionali da 6 a 18 (coprendo il periodo di organogenesi), il ketoconazolo era embriotossico (25 mg/kg e oltre; 0,8 volte il MRHD basato su confronti BSA) con un’alta incidenza di riassorbimento, aumento del numero di nati morti e parto ritardato. Sono stati osservati anche ritardi nella maturazione. Non vi è stata evidenza di tossicità materna o malformazioni fino a 50 mg/kg (1,5 volte la MRHD in base ai confronti con BSA). Non sono stati osservati effetti sullo sviluppo correlati al trattamento a 10 mg / kg (0,3 volte la MRHD in base ai confronti con BSA).
In presenza di tossicità materna nei ratti, il ketoconazolo somministrato per via orale è risultato sia embriotossico (40 mg/kg e oltre; 2,4 volte la MRHD sulla base di confronti BSA), incluso un aumento dei feti riassorbiti e dei nati morti, sia teratogeno (80 mg/kg e oltre; 4,8 volte la MRHD sulla base di confronti BSA), inclusi sindattilia, oligodattilia, costole ondulate e palatoschisi. Inoltre, 100 mg/kg (6 volte la MRHD sulla base di confronti BSA) ketoconazolo somministrato per via orale in un solo giorno durante la gestazione (giorni gestazionali 9 attraverso 12) era embriotossico (aumento riassorbimento). Questa stessa dose orale somministrata il giorno 12, 13, 14 o 15 di gestazione ha indotto malformazioni esterne, tra cui palatoschisi, micromelia e anomalie digitali (brachidattilia, ectrodattilia, sindattilia).
In conigli gravidi trattati per via orale con ketoconazolo, è stata osservata evidenza di embriotossicità (aumento dei riassorbimenti) a 10 mg/kg (1,2 volte la MRHD sulla base di confronti con BSA) e superiore e un’aumentata incidenza di anomalie scheletriche è stata osservata a 40 mg/kg (4,8 volte la MRHD sulla base di confronti con BSA).
Allattamento
Riassunto del rischio
Non sono disponibili informazioni sulla presenza di ketoconazolo nel latte umano, né sugli effetti sul bambino allattato al seno, né sugli effetti sulla produzione di latte dopo applicazione topica di schiuma di ketoconazolo, 2% alle donne che allattano. In studi su animali, ketoconazolo è stato trovato nel latte dopo somministrazione orale. I benefici per lo sviluppo e la salute dell’allattamento al seno devono essere considerati insieme alla necessità clinica della madre per la schiuma di ketoconazolo, 2% e qualsiasi potenziale effetto negativo sul bambino allattato da schiuma di ketoconazolo, 2% o dalla condizione materna sottostante.
Femmine e maschi con potenziale riproduttivo
Infertilità
Negli studi sulla fertilità animale condotti su ratti e cani, la somministrazione di dosi orali di ketoconazolo tra 3 giorni e 3 mesi ha determinato infertilità reversibile .
Uso pediatrico
La sicurezza e l’efficacia della schiuma di ketoconazolo, il 2% nei pazienti pediatrici di età inferiore ai 12 anni non sono state stabilite.
Dei 672 soggetti trattati con schiuma di ketoconazolo, il 2% negli studi clinici, 44 (7%) avevano un’età compresa tra 12 e 17 anni. .
Uso geriatrico
Dei 672 soggetti trattati con schiuma di ketoconazolo, il 2% negli studi clinici, 107 (16%) avevano 65 anni e oltre.
Gli studi clinici con schiuma di ketoconazolo, 2% non hanno incluso un numero sufficiente di soggetti di età pari o superiore a 65 anni per determinare se rispondono in modo diverso rispetto ai soggetti più giovani.
Ketoconazole Foam Descrizione
Ketoconazole Foam, 2% contiene 2% ketoconazole USP, un agente antifungino, in una schiuma idroetanolica termolabile per applicazione topica.
Il nome chimico del ketoconazolo è piperazina, 1-acetil-4-metossi]fenil]-, cis – con la formula molecolare C26H28CI2N4O4 e un peso molecolare di 531,43.
La seguente è la struttura chimica:
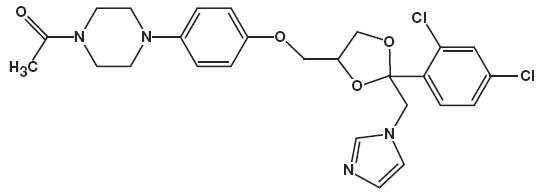
Ketoconazolo Schiuma, 2% contiene 20 mg di ketoconazolo al grammo in un termolabili hydroethanolic schiuma veicolo composto di alcool cetilico, acido citrico, etanolo (denaturato con tert-butyl alcohol e brucina solfato) 58%, polisorbato 60, citrato di potassio, glicole propilenico, acqua purificata, e alcool stearilico pressurizzato con un idrocarburo (propano/butano) propellente.
Schiuma di ketoconazolo – Farmacologia clinica
Meccanismo d’azione
Il meccanismo d’azione del ketoconazolo nel trattamento della dermatite seborroica non è noto.
Farmacodinamica
La farmacodinamica della schiuma di ketoconazolo, 2% non è stata stabilita.
Farmacocinetica
In uno studio sulla biodisponibilità, 12 soggetti con dermatite seborroica da moderata a grave hanno applicato 3 g di schiuma di ketoconazolo, 2% due volte al giorno per 4 settimane. I livelli plasmatici circolanti di ketoconazolo sono risultati < 6 ng/mL per la maggior parte dei soggetti (75%), con un livello massimo di 11 ng/mL osservato in un soggetto.
Microbiologia
Il ketoconazolo è un agente antifungino che inibisce la sintesi in vitro dell’ergosterolo, uno sterolo chiave nella membrana cellulare di Malassezia furfur. Il significato clinico dell’attività antifungina nel trattamento della dermatite seborroica non è noto.
Tossicologia non clinica
Carcinogenesi, mutagenesi, compromissione della fertilità
Non sono stati condotti studi a lungo termine sugli animali per valutare il potenziale cancerogeno o foto-cancerogeno della schiuma di ketoconazolo, 2%.
In studi di cancerogenicità orali nel topo (18 mesi) e nel ratto (24 mesi) a dosi di 5, 20 e 80 mg/kg/die, il ketoconazolo non è risultato cancerogeno. La dose elevata in questi studi è stata approssimativamente da 2,4 a 4,8 volte la MRHD sulla base di confronti con BSA. In un test di mutazione inversa batterica, il ketoconazolo non ha espresso alcun potenziale mutageno. In tre test in vivo (sister chromatid exchange in humans, dominant lethal and micronucleus tests in mice), ketoconazolo non ha mostrato alcun potenziale genotossico.
In studi sulla fertilità animale, il ketoconazolo orale ha alterato la fertilità sia maschile che femminile nei ratti in modo dipendente dalla dose e dalla durata. Nelle femmine, dosi orali fino a 40 mg/kg (2,4 volte la MRHD sulla base di confronti con BSA) non hanno avuto alcun effetto sulla fertilità, mentre dosi di 75 mg/kg (4,5 volte la MRHD sulla base di confronti con BSA) e superiori hanno ridotto il tasso di gravidanza e il numero di siti di impianto. Nei ratti maschi, la somministrazione orale di 200 mg / kg / die (12 volte la MRHD in base ai confronti con BSA) per tre giorni ha ridotto la fertilità e 400 mg/kg/die (24 volte la MRHD in base ai confronti con BSA) per tre giorni ha determinato una perdita completa della fertilità. Quando somministrato per durate più lunghe (fino a 3 mesi), è stata osservata una diminuzione della fertilità nei ratti maschi a dosi fino a 24 mg/kg/die (1,4 volte la MRHD in base ai confronti con BSA). Nei cani beagle maschi, una dose orale di 25 mg/kg/die di ketoconazolo per un massimo di 4 settimane (5.2 volte il MRHD basato sui confronti di BSA) ha provocato la motilità dello sperma diminuita, il conteggio di sperma diminuito, lo sperma anormale aumentato e l’atrofia dei testicoli. Questi effetti sono stati invertiti dopo la sospensione del trattamento.
Studi clinici
La sicurezza e l’efficacia della schiuma di ketoconazolo, 2% sono state valutate in uno studio randomizzato, in doppio cieco, controllato dal veicolo in soggetti di età pari o superiore a 12 anni con dermatite seborroica da lieve a grave. Nello studio, 427 soggetti hanno ricevuto schiuma di ketoconazolo, 2% e 420 soggetti hanno ricevuto schiuma per veicoli. I soggetti hanno applicato schiuma di ketoconazolo, 2% o schiuma per veicoli due volte al giorno per 4 settimane alle aree interessate del viso, del cuoio capelluto e/o del torace. La gravità complessiva della malattia in termini di eritema, desquamazione e indurimento è stata valutata al Basale e alla settimana 4 su una scala ISGA (Static Global Assessment) dello sperimentatore a 5 punti.
Il successo del trattamento è stato definito come il raggiungimento di un punteggio ISGA alla settimana 4 (fine del trattamento) di 0 (chiaro) o 1 (la maggior parte delle lesioni ha punteggi individuali per desquamazione, eritema e indurimento in media 1 ) e almeno due gradi di miglioramento rispetto al basale. I risultati sono presentati nella Tabella 2. Il database non era abbastanza grande per valutare se ci fossero differenze negli effetti in età, genere, o sottogruppi di razza.
Tabella 2: I Risultati di efficacia
|
Numero di Soggetti |
Ketoconazolo Schiuma, 2% N = 427 n (%) |
Veicolo Schiuma N = 420 n (%) |
|
Soggetti Conseguire il Successo del Trattamento |
239 (56%) |
176 (42%) |
Come Dotazione/Stoccaggio e la Movimentazione di
Ketoconazole Schiuma, 2% contiene 20 mg di ketoconazolo (USP) per grammo. La schiuma idroetanolica termolabile è disponibile come segue:
NDC 45802-532-32
Lattina in alluminio da 50 g
NDC 45802-532-33
Lattina in alluminio da 100 g
Conservare a 20° a 25°C (68° a 77°F). .
Non conservare in frigorifero.
Il contenuto è infiammabile. Non esporre i contenitori al calore e / o conservare a temperature superiori a 49°C (120°F). Non conservare alla luce diretta del sole.
Contenuto sotto pressione. Non forare e / o incenerire il contenitore.
Tenere fuori dalla portata dei bambini.
Informazioni sulla consulenza del paziente
Vedere etichettatura del paziente approvata dalla FDA (foglietto illustrativo del paziente).
Istruire i pazienti su un uso corretto della schiuma di ketoconazolo, 2%.
• Evitare incendi, fiamme e / o fumo durante e immediatamente dopo l’applicazione. * Non applicare la schiuma di ketoconazolo, 2% direttamente sulle mani. Dispensare su una superficie fredda e applicare sulle aree interessate usando la punta delle dita. * Lavarsi le mani dopo l’applicazione * Schiuma di ketoconazolo, 2% può causare irritazione della pelle (bruciore al sito di applicazione e/o reazioni) • Istruire un paziente a contattare un operatore sanitario se l’area di applicazione mostra segni di aumentata irritazione e segnalare eventuali segni di reazioni avverse.
Made in Israel
Prodotto da Perrigo
Yeruham, Israel
Distribuito da
Perrigo®
Allegan, MI 49010
www.perrigo.com
Rev 08-18
5K200RCJ3
Istruzioni per l’uso
Schiuma di ketoconazolo, 2%
Informazioni importanti: La schiuma di ketoconazolo, 2% è destinata all’uso solo sulla pelle. Non usare schiuma di ketoconazolo, 2% negli occhi, nella bocca o nella vagina.
Fase 1: Rimuovere il tappo trasparente dalla schiuma di ketoconazolo, 2% può.
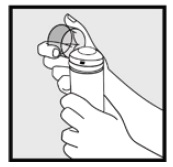
Fase 2: tenere la lattina in posizione verticale e premere saldamente l’ugello per erogare schiuma di ketoconazolo, 2% nel cappuccio trasparente. * Dispensare abbastanza schiuma di ketoconazolo, 2% per coprire l’intera area interessata.
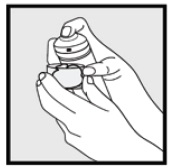
• Se la lattina sembra calda o la schiuma sembra che cola, eseguire la lattina sotto l’acqua fredda.
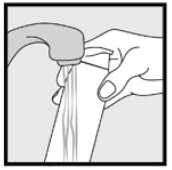
Passo 3: Raccogliere piccole quantità di schiuma di ketoconazolo, 2% con la punta delle dita e strofinare delicatamente la schiuma nella zona interessata(s) fino a quando la schiuma scompare.
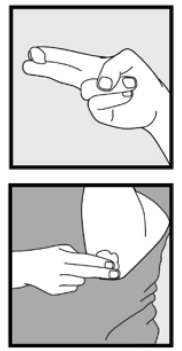
• Se stai trattando aree come il cuoio capelluto, separa i capelli in modo che la schiuma di ketoconazolo, 2% possa essere applicata direttamente sulla pelle.

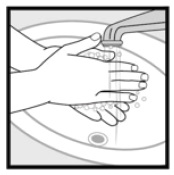
Fase 4: Lavarsi le mani dopo l’applicazione di schiuma di ketoconazolo, 2%. * Getti via qualsiasi medicinale non utilizzato rimasto nel cappuccio.
Come devo conservare la schiuma di ketoconazolo, 2%?
• Conservare la schiuma di ketoconazolo, 2% a temperatura ambiente tra 68 ° F e 77°F (da 20°C a 25 ° C). * Non conservare la schiuma di ketoconazolo, 2% può in frigorifero o nel congelatore. * Tenere la schiuma di ketoconazolo, 2% lontano dal calore. Non gettare mai la lattina nel fuoco, anche se la lattina è vuota. * Non conservare la schiuma di ketoconazolo, 2% a temperature superiori a 120°F (49 ° C). • Non sfondare (forare) la schiuma di ketoconazolo, 2% può.
Tenere la schiuma di ketoconazolo, il 2% e tutti i medicinali fuori dalla portata dei bambini.
Queste istruzioni per l’uso sono state approvate dalla Food and Drug Administration degli Stati Uniti.
Rx Solo
Made in Israele
Prodotti Perrigo
Yeruham, Israele
Distribuito Da
Perrigo®
Allegan, MI 49010
www.perrigo.com
Rev 08-18
INFORMAZIONI PAZIENTE
Ketoconazole Schiuma, 2%
Informazioni Importanti: Ketoconazolo Schiuma, il 2% è per l’uso sulla pelle solo. Non usare schiuma di ketoconazolo, 2% negli occhi, nella bocca o nella vagina.
Che cos’è la schiuma di ketoconazolo, 2%?
Ketoconazole Foam, 2% è un farmaco di prescrizione utilizzato sulla pelle (topico)per trattare la dermatite seborroica in persone di età pari o superiore a 12 anni con un normale sistema immunitario.
Non è noto se la schiuma di ketoconazolo, 2% è sicura ed efficace se usata per trattare le infezioni fungine.
Non è noto se la schiuma di ketoconazolo, 2% è sicura ed efficace nei bambini di età inferiore ai 12 anni.
Prima di usare Ketoconazole Foam, 2%, informi il medico di tutte le sue condizioni mediche, incluso se lei:
• è incinta o sta pianificando una gravidanza. Non è noto se la schiuma di ketoconazolo, 2%, danneggerà il bambino non ancora nato. * stanno allattando o stanno pianificando di allattare al seno. Non è noto se la schiuma di ketoconazolo, il 2% passa nel latte materno. Parlate con il vostro medico curante del modo migliore per nutrire il vostro bambino durante il trattamento con schiuma di ketoconazolo, 2%.
Informare il proprio medico di tutti i farmaci che si assumono, compresi i farmaci da prescrizione e da banco, vitamine e integratori a base di erbe.
Come devo usare la schiuma di ketoconazolo, 2%?
• Usi la schiuma del ketoconazolo, 2% esattamente come il vostro fornitore di cure mediche vi dice di usarlo. Vedere le “Istruzioni per l’uso” dettagliate alla fine di questo foglio per le istruzioni su come applicare la schiuma di ketoconazolo, 2% nel modo giusto. * Applicare schiuma di ketoconazolo, 2% alla zona della pelle interessata(s) 2 volte al giorno per 4 settimane. Si dovrebbe applicare abbastanza schiuma di ketoconazolo, 2% per coprire l’intera area interessata(s). * Parli con il medico se la pelle non migliora dopo 4 settimane di trattamento con schiuma di ketoconazolo, 2%. * Erogare la schiuma di ketoconazolo, 2% direttamente nel cappuccio. Non dispensare la schiuma di ketoconazolo, il 2% direttamente sulle mani, perché la schiuma inizierà a sciogliersi a contatto con la pelle calda. * Lavarsi le mani dopo aver applicato la schiuma di ketoconazolo, 2%.
Cosa devo evitare durante l’uso di schiuma di ketoconazolo, 2%?
• La schiuma di ketoconazolo, 2% è infiammabile. Evitare incendi, fiamme o fumo durante e subito dopo aver applicato la schiuma di ketoconazolo, 2% sulla pelle. * Evitare di ottenere schiuma di ketoconazolo, 2% in o vicino agli occhi, bocca, labbra o vagina. Se si ottiene schiuma di ketoconazolo, 2% sulle labbra o negli occhi, nella bocca o nella vagina, sciacquare bene con acqua.
Quali sono i possibili effetti collaterali della schiuma di ketoconazolo, 2%?
La schiuma di ketoconazolo, 2% può causare gravi effetti collaterali, tra cui:
• Irritazione cutanea nell’area di applicazione, comprese le reazioni cutanee causate dall’esposizione alla luce. Informi il medico se sviluppa irritazione cutanea durante il trattamento con schiuma di ketoconazolo, 2%.
Gli effetti indesiderati più comuni della schiuma di ketoconazolo, 2% includono bruciore, secchezza, arrossamento, irritazione, intorpidimento, prurito, eruzione cutanea e calore nel sito di applicazione.
Questi non sono tutti i possibili effetti collaterali della schiuma di ketoconazolo, 2%.
Chiamare il medico per un consiglio medico sugli effetti collaterali. È possibile segnalare effetti collaterali alla FDA a 1-800-FDA-1088.
Come devo conservare la schiuma di ketoconazolo, 2%?
• Conservare la schiuma di ketoconazolo, 2% a temperatura ambiente tra 68 ° F e 77°F (da 20°C a 25 ° C). * Non conservare la schiuma di ketoconazolo, 2% può in frigorifero o nel congelatore. * Tenere la schiuma di ketoconazolo, 2% lontano dal calore. Non gettare mai la schiuma di ketoconazolo, 2% lattina in un fuoco, anche se la lattina è vuota. * Non conservare la schiuma di ketoconazolo, 2% a temperature superiori a 120°F (49 ° C). • Non sfondare (forare) la schiuma di ketoconazolo, 2% può. Tenere la schiuma di ketoconazolo, il 2% e tutti i medicinali fuori dalla portata dei bambini.
Informazioni generali sull’uso sicuro ed efficace della schiuma di ketoconazolo, 2%.
I medicinali sono talvolta prescritti per scopi diversi da quelli elencati in un foglio informativo per il paziente. Non usare schiuma di ketoconazolo, 2% per una condizione per la quale non è stata prescritta. Non dare schiuma di ketoconazolo, 2% ad altre persone, anche se hanno gli stessi sintomi che hai. Infatti per loro potrebbe essere pericoloso. Puoi chiedere al tuo farmacista o operatore sanitario informazioni sulla schiuma di ketoconazolo, 2% che è scritto per gli operatori sanitari.
Quali sono gli ingredienti della schiuma di ketoconazolo, 2%?
Principio attivo: ketoconazolo
Ingredienti inattivi: alcool cetilico, acido citrico, etanolo (denaturato con tert-butyl alcohol e brucina solfato) 58%, polisorbato 60, citrato di potassio, glicole propilenico, acqua purificata, e alcool stearilico pressurizzato con un idrocarburo (propano/butano) propellente
Per ulteriori informazioni, chiamare il Perrigo a 1-866-634-9120
Questo foglietto illustrativo è stato approvato dalla US Food and Drug Administration.
CONFEZIONE/ETICHETTA PANNELLO PRINCIPALE – CARTONE
Solo Rx
Schiuma di ketoconazolo, 2%
Solo per uso topico.
Non per uso oftalmico, orale o intravaginale.
100 g

L’immagine seguente è un segnaposto che rappresenta l’identificatore del prodotto che viene apposto o impresso sull’etichetta della confezione del farmaco durante l’operazione di confezionamento.

| KETOCONAZOLO ketoconazole aerosol schiuma |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
Labeler – Perrigo New York Inc (078846912)
Più su ketoconazole attualità)
- Effetti collaterali
- Durante la Gravidanza o l’Allattamento al seno
- Dosaggio di Informazioni
- Confronto Alternative
- Prezzi & Coupon
- spagnolo
- 36 Recensioni
- classe di Droga: topical antifungals
Consumer resources
- Patient Information
- Ketoconazole Topical (Advanced Reading)
Professional resources
- Prescribing Information
- Ketoconazole (Topical) (Professional Patient Advice)
- Ketoconazole Cream (FDA)
- Ketoconazole Shampoo (FDA)
Other brands Nizoral Shampoo, Ketodan, Extina, Xolegel
Related treatment guides
- Seborrheic Dermatitis
- Cutaneous Candidiasis
- Androgenetic Alopecia
- Dandruff
- … + 4 più
Disclaimer medico