はじめに
kt/Vの計算は、血液透析(HD)の必要な用量を決定するために最も使用される方法です。 これは、あるセッションで除去された尿素の量(Kt)および特定の患者における尿素の分布量(V)に基づく指標であり、これは体水分(BW)と一致する。 それは尿素からdepurated血液の量として表されるため、指標であります,リットルで,BWで割った,リットルで.これは、尿素からdepurated血液の量として表されます,リ 透析前後の尿素濃度の測定を用いて、尿素の速度論的モデルから開発された式を用いてKt/Vを推定することができる。1,2
イオン透析(ID)または紫外線捕捉によって尿素Kのクリアランスを推定し、この値にセッションの持続時間tを掛け、人体測定式またはバイオインピーダンスによって計算されたBWの体積で割る可能性は、方法論を簡素化し、3-6HD後の血液サンプルの抽出におけるミスを回避し、月に一回ではなくすべてのセッションを制御できるようにした。 HDのモニターの表示人員の時間および費用の必然的なセービングの分析のための必要性なしでリアルタイムの価値。 尿素とIDによって測定されたKt/Vの値の相関は優れており(r=0.9)、変動係数は5-6%の範囲にのみあります。4,5欠点は、タンパク質異化率(nPCR)を計算することができず、HDモニターの種類に応じて最大10%の変動がある可能性があることです。7,8
Kt/VはHDの線量として使用されています。9-11観察研究は、Kt/Vと死亡率および罹患率との関係を発表した。 患者の生存率はKt/V>110-12で改善され、この目的はその後1.213および1.3.10に上昇したが、HEMO研究では、14、15Kt/Vと死亡率との間に有意な関係は検出されなかった。 この研究では、11Kt/Vのより大きなターゲットの利点は、女性では示されたが、男性では示されておらず、VによってKtを修正または正規化するという考えは、すべてのタイプの患者に対して適切ではないことが示唆された。 Kt/Vが必要とされる透析の用量を適切に決定しない特定の特徴を有する患者が存在するであろう。11
Kt/Vと死亡率との関係は、しばしば”J”曲線として表され、kt/Vが低いまたは尿素還元率(URR)が低い患者は死亡リスクが増加するが、同時にkt/Vが推奨レベルを超える患者は死亡リスクが減少するのではなく増加する。16-18しかし、腎臓は連続的なKtを産生し、この結果とは対照的にはるかに高い量である。 これらのタイプの曲線は、通常、修正されていないいくつかの混乱要因によって説明されます。 Kt/Vの場合,交絡因子はVである可能性があります.患者は、高Ktまたは低Vのために高いKt/Vを有することができます.小さな患者と女性は、低Vを有し、それらの中で我々はすでに我々はより高いKt/Vを提供しなければならないことを知っています.彼らの水分content有量が低いため、低Vを有する患者があります,それはの場合です,高齢者,栄養失調,低筋肉量,細胞数の減少,これらの患者はすべて、通常、予後不良を持っています. Vは混乱の要因ですか? 死亡のリスクとKtを関連させる研究は、”J”曲線を提示しない;死亡のリスクは、Ktが増加するにつれて減少し続け、”推奨”されているものを上回っている。18-20
本研究の目的は、Kt/VとKtおよびV(合計および重量の補正)との関係、およびこれらのパラメータとintraおよび細胞外水の総含有量、および除脂肪量(bioimpedance)との関係 この研究では、これらの変数と死亡率との関係も調査します。 この仮説は、Kt/VがBWが小さいまたは減少した患者の生存と直接相関しないということである。
材料と方法デザインと患者
2013年と2014年にHDで流行している患者のコホートにおける生体インピーダンスによって評価されたkt/V、Kt、kt体表面に調整(Ktsc)、Vおよ その後、患者は2016年末まで前向きに追跡されました。 フォローアップ中の死亡率は、言及されたHDパラメータとの関連で研究されている。 2013年と2014年の間に、すべてのHDセッションのデータが収集され、HDモニターからコンピュータシステムに転送されたデータが収集されました。
包含基準:含まれる患者は、2013年と2014年の間にInfanta Leonor大学病院のHDユニットで流行している患者である。 これらはすべて、18歳以上の慢性HDの患者であり、データの使用に同意していました。 除外基準:有意な残存腎機能のために、3ヶ月未満のフォローアップまたは週に3回未満のHDセッションを有する患者。<5 3 4 2>血液透析技術<4 7 8 3>使用した機械は、Ak2 0 0Us(登録商標)およびArtis(登録商標)(Baxter)およびST5 0 0 8(Fresenius,FMC,Bad Homburg,Germany)であった。 すべての機械にID(Diascan®u OCM®)がある。 機械は各会議のデータの自動ダウンロードを可能にするTSS®コンピュータ塗布に接続される。 透析液は、0.1未満のコロニー形成単位mlのレベルおよび0.03EU/ml未満のエンドトキシンレベル(Spanish Society of Nephrologyからのガイド)によって定義されるultrapureである。 患者は、有意な残存腎機能(RRF)を有する患者を除いて、週に3日、通常は週に最低12時間透析される。 Dialyzersは1.8からの2.1m2へ表面積の総合的な膜との高い透磁率、である。 これらの膜に対する有害反応を有する患者は、セルロース三酢酸塩で透析される。 管のアクセスを可能にする最高の血の流れは−220mm Hgの下で落ちる幹線圧力を許可しないで使用される。 患者はオンライン血液透析または高流量HDであった。
Bioimpedance(BCM®)
BCM®multifrequency bioimpedance21–23を本研究で使用しました。
パラメーターを収集し、評価した
年齢と性別を収集しました。 H Dのための血管アクセス;h D前およびh d後の体重、および体表面積(m2)を計算した。
研究の開始時に、pre-HD multifrequency bioimpedance(BCM®)を実施しました。 以下のパラメータが収集されました: 除脂肪質量指数(LTI)(kg/m2)、脂肪質量指数(FTI)(kg/m2)、BW(リットル)、細胞外水(ECW、リットル)、細胞内水(ICW、リットル))および正常水和重量(kg)。 BCM®データは、対応するHDセッションのデータに関連しています。<5342><4783>HDに関しては、透析技術、透析器、血流(Qb)、精製された血液の総体積(TVPB)、透析の有効時間(t)、透析液中の総導電率(Ct)を記録した。 尿素(K)のクリアランスは,各タイプのモニターにおけるIDによって推定された。 Kt/Vを決定するために、BCM(登録商標)によりVel B Wとして使用した。 Natremia(N a)は最初のセンサ測定でIDによって計算した。 目標Ktscは、式:リットル単位のKt=1/、m2単位のBS A(体表面積)=重量0.18,24
2013年と2014年の間に、すべてのセッションのKtとKt/Vのデータが収集され、有効なデータが研究に含まれていたすべての患者のデータが収集されました。 その期間中の各患者におけるKt、KtscおよびKt/Vの平均を計算に使用した。
進化
患者は2016年末まで追跡され、彼らがまだ活動していたか、移植されていたか、追跡中に失われたか、死亡したかを評価した。
統計量
正規の連続変数は、平均と標準偏差として表されます。 変数Kt/Vは四分位数に分割されています。 Kt/Vの四分位数による変数の差を比較するために、Levene検定を実施した後にワンステップ分散分析を使用した。 ピアソン型二変量相関は、変数が正規分布を持っていたことを確認した後、適用されています。
Kaplan–Meier生存曲線を計算し、因子を対数ランク検定(Mantel–Cox)を用いて比較した。 Cox回帰を用いて、因子間の相互作用を解明し、死亡率に独立して影響する因子を決定した。
A p
0.05が有意であると考えられた。 SPSS15.0(Chicago,Illinois,USA)は、統計パッケージとして使用されています。結果
Infanta Leonor University Hospitalの血液透析ユニットで2013年と2014年に流行している135人の患者のうち、127人が包含基準を満たして研究され、そのうち18,998セッションが登録された。
平均年齢は70.4歳(15.3歳)で、22歳から93歳までの範囲であった。 60.6%が男性、39.4%が女性であった。 患者はトンネルカテーテル(n=51)を介して透析された;自家動静脈瘻(n=68)と人工瘻(n=8)によって。 七十から二の患者は、AK200us®またはArtis®モニターと55ST5008®で透析されました。 127人の患者の六十から五は、オンラインhemodiafiltrationにありました。 使用された透析装置は、ポリエーテルスルホナド2.1m2で74人、Fx800®で24人、ポリアミド2.1m2で22人、Fx80®で7人であった。
127人の患者の平均Ktは56.1(7)lであり、Ktscは52.8(10.4)lであった。平均目標Ktscは49.7(4.5)lであった。平均Ktsc−Ktsc目標は+6.39(7.00)lであり、範囲:-18.76から26.38lであった。5%の患者は、推奨Ktscに達しなかった。 HDセッションの平均持続時間tは、248.9(21)分であった。 このシリーズでは、女性は男性よりも低い達成されたKtsc目標Ktscを持たず、p=0.785。 より高いKtscを有する患者は、カテーテルの割合が低く、p
0.033であった。 カテーテルの分布は、Kt/V、p=0.468の四分位間で類似していた。
最大Kの平均は243(24)ml/分であった。 平均血流は374(43)ml/分であった;総depurated血液量は83.4(11.4)Iであった;プレHDでSBPは146(24)mmHgとDBP69(15)mmHgであった。体重、70.6(16.8)kg;体表面、1.8(0.25)m2;体重、32.2(7.4)l;細胞外容積、17(9.5)l;細胞内容積、15.9(4)l;相対希薄質量、42.6(12.1)%; 相対的な脂肪質の固まり、39.6(9.6)%、LTI、11.1(2.7)kg/m2。
平均Kt/Vは1.84(0.44)であった。 表1は、kt、Ktsc、kt到達−ターゲットKt、バイオインペダンスおよび透析のデータをKt/Vの四分位数に応じて示しています。 Kt/Vと反比例する因子は、除脂肪質量指数、除脂肪質量%;BW;細胞外容積、および細胞内容積である。 フォローアップの開始時の年齢は、BWと逆相関していた(p0。0 5)およびLTI(p0. 血清アルブミンはLTI(n=127、r=0.64、p0.001)とACT(n=127、r=0.048、p0.01)と相関した。 表2は、BW四分位数(V)に基づくアルブミンおよびその他の生体インピーダンス値の分布を説明しています。
Kt/Vの四分位数に関連したスタディ変数の分布。
| Kt/Vの四分位数、平均(区間) | 1.32 (0.97–1.53) | 1.65 (1.54–1.78) | 1.88 (1.8–2.16) | 2.34 (2.17–3.11) | Sig. p |
|---|---|---|---|---|---|
| Kt, l (SD) | 54.5 (6.3) | 53.7 (6.2) | 57.1 (7.4) | 59.1 (7.1) | |
| Ktsc, l | 48.4 (11.7) | 52.3 (9.3) | 53.9 (10.5) | 56.3 (8.7) | |
| Kt achieved−Kt target, l | 0.58 (5.26) | 4.65 (4.24) | 7.8 (6.1) | 12.2 (6.6) | |
| V (TBW), l | 39.8 (6.2) | 32.3 (5.1) | 29.6 (4.7) | 24.6 (3.8) | |
| 女性、n(%) | 4 (8%) | 10 (20%) | 17 (34%) | 19 (38%) | |
| 重量、kg | 84.5 (16.2) | 67.6 (14.2) | 68.4 (14.9) | 62.4 (13.9) | |
| V/重量、l/kg | 0.47 (0.07) | 0.47 (0.08) | 0.44 (0.07) | 0.40 (0.07) | |
| ボディ表面、m2 | 2.04 (0.23) | 1.76 (0.17) | 1.77 (0.23) | 1.65 (0.21) | |
| IMM (LTI), kg/m2 | 12.6 (2.8) | 12.1 (2.4) | 10.4 (2.0) | 9.2 (2.1) | |
| Relative MM, % | 43.4 (12.6) | 48.4 (13.3) | 41 (11.5) | 37.5 (8.2) | |
| Intracellular water, l | 19.6 (3.5) | 16.8 (3.6) | 14.9 (2.1) | 12.7 (3.1) | |
| Extracellular water, l | 20.5 (3.1) | 19.3 (3.0) | 15.2 (2.2) | 13.2 (2.8) | |
| 血清アルブミン、g/dl | 3.73 (0.53) | 3.72 (0.50) | 3.48 (0.58) | 3.4 (0.50) | 0.012 |
TBW:総ボディ水;SD:標準偏差;IMM(LTI):細い固まりの索引;Ktsc:ボディ表面ができるように調節されるKt;MM:相対的な細い固まり。
総体水の四分位数に関連した研究変数の分布,V.
| Quartile of V, L, mean (interval) | 23.5 (17.4–27.0) | 29.3 (27.7–30.7) | 3.4 (30.8–36.9) | 42.5 (37–51.1) | Sig. p |
|---|---|---|---|---|---|
| Kt, l (SD) | 54.4 (6.4) | 55.6 (7.7) | 57.1 (7.6) | 57.4 (6.2) | 0.293 |
| Kt/V | 2.2 (0.43) | 1.9 (0.33) | 1.8 (0.25) | 1.4 (0.26) | |
| 女性、n(%) | 20 (40%) | 16 (32%) | 11 (22%) | 3 (6%) | |
| 重量、kg | 57.0 (9.1) | 64.3 (12.6) | 74.5 (10.4) | 86.2 (17.6) | |
| V/重量、l/kg | 0.42 (0.07) | 0.44 (0.07) | 0.45 (0.08) | 0.47 (0.07) | 0.057 |
| IMM(LTI)、kg/m2 | 8.7 (1.6) | 10.5 (1.9) | 11.5 (2.0) | 13.6 (2.4) | |
| 相対MM, % | 43.4 (7.1) | 38.9 (8.9) | 41.2 (7.7) | 34.8 (12.0) | |
| 血清アルブミン、g/dl | 3.4 (0.53) | 3.4 (0.57) | 3.7 (0.51) | 4.0 (0.32) |
SD:標準偏差;IMM(LTI):リーン質量指数;MM:相対リーン質量。
患者ごとの155の会議の平均は36と308の間で、評価されました。 各患者のセッションにおけるKtの変動係数の平均および標準偏差は、11.6(4.6)%であり、18,998セッションの127患者であった。 平均Kt/VおよびKtは,生体インピーダンスを行った透析に対応するものと有意に異ならなかった。
36ヶ月の平均フォローアップの終わりに、24ヶ月から48ヶ月の間に、50人の患者がまだ活動しており、42人が死亡し、23人が移植され、12人が別のセンターに移動していた。 コホートの推定生存時間は36.4ヶ月であり、標準誤差は1.47であり、95%の信頼限界(33。5–39.3). 表3および図3および図3および図4。 図1は、Kt/Vの四分位数の生存推定値を示しており、他の四分位数と比較して4番目の四分位数の推定値が低い(p0.004)。 差Ktsc到達−ターゲットKtsc(表4)の四分位は、死亡率に有意に関連していなかったが、上部四分位は明らかに良好な生存率を有していた。 死亡率に関連した他の変数は、年齢;血清アルブミン;LTIおよびACTであった。 これらの変数にCOX回帰を適用すると、アルブミンとLTIだけが独立したプリディターのままになります(表5)。
127人の患者のフォローアップ中の平均生存時間。 Kt/V、LR p0.004の四分位数による生存時間の比較(第4四分位数9ヶ月の差に関して)。
| Kt/Vの四分位数(平均) | 平均生存時間(ヶ月) | 標準偏差(SD) | 95%信頼区間(CI) | 中央値(SE)(CI) |
|---|---|---|---|---|
| 1 (1.32) | 38.51 | 2.74 | 33.13–43.88 | |
| 2 (1.65) | 41.72 | 2.58 | 36.65–46.78 | |
| 3 (1.88) | 38.16 | 2.94 | 32.38–43.93 | |
| 4 (2.34) | 29.38 | 2.75 | 23.98–34.77 | 26.00 (2.21) (21.65–30.34) |
| グローバル | 36.41 | 1.46 | 33.54–39.28 | |
| ログランク(マンテル-コックス) | カイ正方形:13。36 | 自由度、3 | p0.004 |
推定は、それが検閲されている場合、より長い生存時間に制限されます。
Kt/Vの異なる四分位数に対する生存の等しい分布の証明。
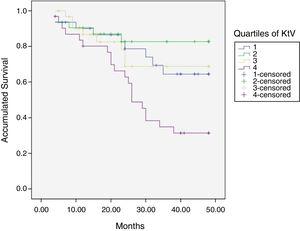
Kt/Vの四分位数による生存曲線。
127人の患者のフォローアップの間の平均存続時間。 差の四分位数による生存時間の比較:Kt達成−Kt目標、LR p=0.117(第1四分位数と第2四分位数は8ヶ月差があり、第4四分位数との差がある)。
| 差の四分位数: Kt達成-Kt目標(平均、l) | 平均生存時間(月) | 標準誤差(SE) | 信頼区間(CI) | 平均生存時間(月) | 平均生存時間(月) | ) 95% |
|---|---|---|---|---|---|---|
| 1 (-1.5) | 32.7 | 3.2 | 26.4–38.9 | |||
| 2 (3.2) | 32.7 | 3.2 | 26.5–39 | |||
| 3 (6.9) | 38.6 | 2.4 | 33.4–43.8 | |||
| 4 (16) | 41 | 2.4 | 36.4–45.6 | |||
| グローバル | 36.41 | 1.46 | 33.54–39.28 | |||
| 対数ランク(Mantel–Cox) | カイ二乗:1.092 | 自由度,3 | p=0.117 |
推定は、それが検閲されている場合、より長い生存時間に制限されます。
Ktの異なる四分位数に対する生存の等しい分布の証明。
HD上の127人の患者のコホートにおけるCOX回帰分析。 血清アルブミンとIMM(LTI)は、死亡率の独立した有意な予測を維持します。
| 方程式に含まれる変数 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| B | SE | Wald | gl | Sig. | Exp(B) | CI Exp(Bに対して95.0%) | |||
| 下 | 上 | ||||||||
| LTI | -0.361 | 0.137 | 6.965 | 1 | 0.008 | 0.697 | 0.533 | 0.911 | |
| TBA | -0.029 | 0.057 | 0.251 | 1 | 0.616 | 0.972 | 0.869 | 1.087 | |
| kt | 0.056 | 0.032 | 2.995 | 1 | 0.084 | 1057 | 0.993 | 1.126 | |
| Kt/V | -0.895 | 0.648 | 1.908 | 1 | 0.167 | 0.409 | 0.115 | 1.455 | |
| TBW/重量(l/kg) | 0.081 | 2664 | 0.001 | 1 | 0.976 | 1.084 | 0.006 | 200.692 | |
| 血清Na(IDによって) | -0.122 | 0.099 | 1.503 | 1 | 0.220 | 0.886 | 0.729 | 1.075 | |
| 性別 | -0.312 | 0.391 | 0.635 | 1 | 0.425 | 0.732 | 0.340 | 1.576 | |
| アルブミン | -1.114 | 0.284 | 15.432 | 1 | 0.000 | 0.328 | 0.188 | 0.572 | |
| モデラの係数のためのオムニバステスト,b | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| -2 信頼性のログ | グローバル(スコア) | 前のステップからの変更 | 前のブロックからの変更 | ||||||
| Chi squared | gl | Sig. | Chi-square | gl | Sig. | Chi-square | gl | Sig. | |
| 311.348 | 8 | 0.000 | 70.695 | 8 | 0.000 | 60.864 | 8 | 0.000 | 60.864 |
TBW:総体水分;SE:標準誤差;CI:信頼区間;LTI:除脂肪質量指数;血清Na(IDによる):イオン透析によって計算された血清ナトリウム;Sig。:重要性(p)。
初期ブロック番号0、初期信頼性のログ関数:-2信頼性のログ:372.212。
初期ブロック番号1。 メソッド=入力します。
初期のナトリウム血症は死亡率に関連しており、最低四分位である低ナトリウム血症患者の予後は悪化していた(図10)。
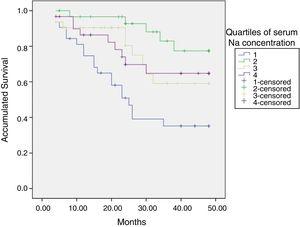
血清ナトリウム(ID)の四分位による生存曲線。 ID:イオン透析。
考察
HD患者のこのコホートでは、Kt/Vが高い患者の方が死亡率が高い。 最も高いKtは生存を改善するが、有意ではない。 BW、Vは、死亡率に反比例しています。 このシリーズでは、Kt/VはKtよりもVに依存します。 バイオインペダンスによって測定されたV,BWは,LTI,相対除脂肪量および細胞内水分などの栄養パラメータに関連している。 研究された変数のうち、LTIおよび血清アルブミンは、死亡率の最良の独立した予測因子である。 したがって、”透析量”の尺度としてのKt/Vの有用性は、低Vの患者では制限され、栄養失調および低筋肉量のために低Vの患者で誤った結論につながる可 Kt/Vは、ktに置き換えることができ、補正することも、vによって示されるバイアスを持たない体表面によって補正されないこともできる。
Kt/Vは、”透析量”を定義するために使用されるパラメータとして考慮されています。 体の大きさを補正し,尿素動力学の式を適用できるように,KtをVで割った。 KDOQIガイドラインによると、目標Kt/Vは>1.2または尿素還元率>65%であると考えられています。23女性および体重の低い人々がより高いKt/Vから利益を得ることができるという証拠を考えると、推奨されるKt/Vは>1.310であった。 Kt/Vは、透析量の制御および改善のための基準として有用であった。 スペインでは、スペイン腎臓学会の品質グループによって定義された基準に達したセンターの割合は、Kt/V基準(Daugirdas II、>1.3患者の80%以上)の目的に従って、65から90.9%に増加した。25
問題は、BWによるKtの通常の補正が適切かどうかである。 このアプローチは、用量指示の偏りのために観察研究の結果を解釈する際に困難を提示する。Ktを修正するための26の代替方法が提案されている: 性別、体表面による27、タンパク質異化率(PCR)などの代謝パラメータによる24、または尿毒症毒素の可能な供給源としての内臓質量による28,29。30
1999年、Lowrie et al.31は透析用量および死亡率のマーカーとしてKtを提案し、女性では40–45l、男性では45–50lの最小Ktを推奨した。 その後の研究では、24同じ著者は、アカウントに同じ性別の被験者の人体測定の違いを取って、体表面の関数としてKtの異なる要件を相関させ、後の研究18体表面によるKtの補正のこの同じ方法は、スペインの人口で検証されています。19,20病院Universitario Infanta Leonorでは、KtでHDの用量を制御します。 この研究では、平均Ktと平均Ktscは、平均の+6.4lで、推奨される最小値と考えられるものよりも非常に優れています。 この値は、スペイン人患者の大集団における研究で得られた+6.5lと同様であり、19および他の以前の研究よりも高い:+0.3の米国人口における研究では200618および+3.3のスペイン人口における2013l。本研究では患者の数が限られているため、他の研究で示されているように、より高いKtが生存を改善できるかどうかを観察することはできない。18-20これらの以前の研究では、Ktsc目標に達した患者の割合は53、67、および81%であった。18-20この研究では、患者のわずか5%が透析不足とみなすことができ、Ktscターゲット>Ktscが達成されました。
Ktsc18の目標はKt/Vの目標よりも厳しい。8,19,20,32,33Ktを用いた透析用量のモニタリングは、透析の妥当性のより良い差別を可能にし、性別または体表面を与えられた適切な用量に達しない患者の30および40%の間で識別する。31ターゲットKtに達するより多くの難しさがある患者は次のとおりである:カテーテルを持つ患者、規則的なHDのより少ない時間の年配の患者、より短い透析の会議、低い血の流れ、より大きい体重および人に関して女性。20resent研究では、Ktが高いカテーテルを有する患者の割合がより少ないことが観察されている。 より低いKのカテーテルの存在はより高いtの価値と償われる。 1999年には、Chertowet al.17は、Hdにおける死亡率の予測因子としてKt/Vを使用する問題は、vの値にある可能性があるという考えを進めました.このような研究では、3009人の患者のBWは、単周波数のバイオインピーダンスを用いてHDで決定され、BwはWatsonのものを含む3つの異なる人体測定式を用いて計算されました。その集団において、PRUの5分位数に従って調整された死亡の危険度は、「J」曲線を示す。 高い五分位の患者は、第3の患者よりも死亡のリスクが高く、BWの5.9l(15%)が少なかった。 同じ集団では、Ktの五分位数は、死のリスクに関連してJに曲線を提示しません。 Bwを人体計測式で計算しても同様の結果が得られた。 Ktは尿素速度論モデルから計算した。 彼の結論は、Kt/V altoが高いKtまたは低いVに起因する可能性があるということである。 それは女性で起こるように、低Vは、低体重および/または低体重に対する水分比に起因する可能性があります。 他の場合では、低いVは低い細い固まりの索引、栄養失調のマーカーと関連し、それに死の危険との強い関係があります。
タンパク質栄養失調またはタンパク質エネルギー浪費は、水和の程度、細胞内水分および細胞内/細胞外水分の比率に有意に関連している。タンパク質栄養失調の35,36人の患者は予後不良であり、体重に関連して低いVに基づいて高いKt/Vを維持する。 栄養のマーカーであり、死亡率の予測因子である血清アルブミンも、本研究ではVと直接関連している。 彼らの体重に対して低いVを持つ人口は、高齢の患者です。 私たちの環境では、HDの患者の半分は70歳以上です。 マドリードのコミュニティの腎臓患者のレジストリ(REMER)37このタイプの患者は、過去数年間で事件の患者の中で最も増加しています。 マドリードのコミュニティで2015年に腎置換療法を受けた807人の患者では、35.3%が74歳以上であった。 これらの高齢患者は低いVを有し,したがってKt/Vは標的Ktに対応しない適切な透析の外観を与えることができる。 低ナトリウム血症は、一般集団と同様に、HD患者の予後不良のマーカーである。38,39私たちの患者は、
mEq/lの血清ナトリウムが死亡のリスクが高いことを示しています。 実際、多変量解析では、2つの因子を含めることによって、低ナトリウム血症はその重要性を失う。 栄養失調と低ナトリウム血症との関係はすでに証明されている。38この研究の限界の中には、単一のセンターからであることは他のタイプのバイアスを回避するが、患者の数が少ないことがある。 しかしながら、ktおよびKt/Vは、フォローアップを通じて含まれておらず、また時間依存回帰分析においても使用されていない。
Chertow et al.17データは、3ヶ月の平均と使用bioimpedanceの間に収集されます;本研究では、155透析の平均を使用しています,これはに対応します12ヶ月. 同じ患者の異なるセッションで投与されるKtの変動は無視できるものではなく、変動係数は0.116(11.6%)であった。 マッキンタイア他40では、個々の変動係数が0.13(0.1)であることがわかりました。 このため、このタイプの研究では、かなりの数のセッションから平均Ktを分析することが重要であり、これはここでは12ヶ月の期間中のセッションの
Idを持つ現代のHDマシンは、セッションの最終Ktを提供し、提供/注釈を付けたVでKt/Vを計算することができます; 将来的には、HDマシンが体表面に基づいてKtscについて通知する可能性もあります。 各患者はほとんどの会議のターゲットKtを達成するべきです。 上記の問題を避けるために体表面によってKt/Vを修正することが提案されているが、これが有用であり、もちろんKtscよりも面倒であるかどうかを評価す41
結論:Ktは、IDを介して現代のHDモニターによって行われた直接測定です。 各患者の最小”HDの量”を推定するために、予後不良の栄養失調患者の低Ktをマスクする可能性のあるVを使用する必要はありません。 Kt/Vは、BWが小さいまたは減少した患者の透析の用量を決定するのに有効ではない。 KtまたはKtscはKt/Vの代わりになる可能性があります。
利益相反
最初の著者は、この作品に関連して利益相反がないと宣言しています。