はじめに
先天性心不全の手術後に急性接合異所性頻脈(JET)が現れることがあります。 それは48-72時間以内に自己制限的であるが、迅速な治療の非存在下での死亡率は、心拍数(HR)および房室解離(AVD)のために40%1である。 薬理学的治療に対する反応が悪いことは、中等度の低体温症を含む他の治療選択肢の探索につながっている。2この治療法は、1987年3月に最初に記載された文献ではまれに報告されており、すべての報告は患者の数が少ない。
患者と方法
患者
スペイン北西部ア-コルーニャにあるフアン-カナレホ病院複合施設のÁrea Infantil del Corazón(小児心臓サービス)において、1999年から2001年までの間に先天性心欠損のために手術された患者の臨床記録をレビューした。 手術中または食道電極を用いて心房電極を配置した不整脈のエピソード中に記録された心房電極と同様に、標準心電図を調べた。 低体温症で治療された確認されたまたは可能性のあるジェットを有する患者のみがこの研究に含まれた。
診断基準
-確認されたJET:a)基底追跡または心房刺激によって得られた追跡に類似するQRS複合体を有する頻脈、b)心室速度よりも遅い心房速度を有するAVD。
: 上記のように基準1が満たされたが、AVDを実証することができなかった場合、または1:1の逆行性伝導があり、不整脈が電気的除細動または心房過刺激に応答しなかった場合に記録される。
治療
JETの治療は、a)基本的な措置(変力剤の使用の減少、鎮静、電解質不均衡の是正);b)ペースメーカー(JETによるものよりも速くHRを確立することにより房室同期を回復させる);c)低体温症、およびd)抗不整脈薬に基づいていた。 ジゴキシンは、一部の患者では変力性および利尿性のサポートに使用された。
低体温症は、基本的な対策にもかかわらず血行動態が悪化したとき、またはジェット速度よりもペースメーカー速度を維持することができなかったときに開始された。 すべての患者は鎮静され、筋弛緩剤を用いて機械的換気に置かれた。 ファン、皮膚上に置かれた冷たいパック、および経鼻胃管を介した冷たい生理食塩水での洗浄を使用した。 噴流速度が低下するまで温度を低下させたが、直腸温度計で測定したように33℃以下には決してなかった。 患者は、一定の心電図モニタリング下で外部熱源を増加させることによって、血行力学的安定性(適切な中心静脈圧、動脈圧および利尿)の少なくとも36 ペースメーカーで治療された患者では、この治療は、正常な洞調律が現れたとき、またはジェット速度が年齢に応じて正常の75パーセンタイル以下に減少したときに中断された。
統計分析
定量的変数は平均±標準偏差として表され、分布が著しく非対称であった変数についても中央値が報告されます。 カテゴリ変数は、絶対値(パーセンテージ)として表されます。 低体温の開始から1、2、4、8、12y24hで得られた血行力学的値の変化は、繰り返し測定のための線形傾向についてMANOVAで分析した;データの正規分布はShapiro-Wilksテス P
結果
合計138人の患者が心肺バイパスによる小児心臓手術を受け、21人(15.2%)が確認または可能性のあるジェットを発症し、ここで分析された12人の患者(9人の女の子、平均年齢2.1±2.0ヶ月)で低体温が使用された(表1)。 ジェットの発症は、手術後6.3±11.9時間(中央値、2時間)を記録した。 その時点での温度は37.0±0.7℃であった(表2)。 低体温症は、ジェットの発症後1.5±0.5時間(中央値、1.0時間)を開始し、74±42時間(範囲、36-144時間)続いた。 低体温症の間、ジゴキシンは6人の患者に使用され、これらのアミオダロンの4人には低体温症の間のサポートのためにも与えられた。 ペースメーカーは10人の患者で使用されました:9では、心外膜電極を手術室に置き、1では食道電極を使用しました。
最初の24hの間の中心温度および血行力学的状態の変化を図1に示す。 最大の改善は、低体温の最初の4時間の間に得られ、その後、患者は安定したままであった。
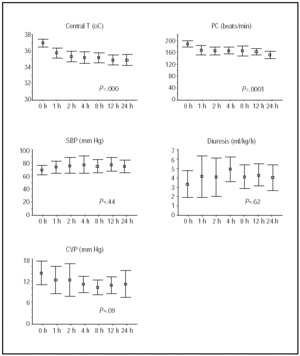
図1.1.1. 1. 低体温の最初の24時間の間のコース。 線は、平均と95%信頼区間を示しています。 P値は、反復測定のMANOVA線形傾向検定を参照しています。 HRは心拍数を示します;拍/分、毎分拍数;T、温度;SBP、収縮期血圧;CVP、中心静脈圧。
一人を除く全ての患者が生存した。 死亡した乳児はJETに続発した低出力状態であり,治療に難治性であった。 低体温に直接起因する合併症はなかった。 再ウォーミングの時に、5人の患者はジェット機を持ち続けた;HRの重要な増加のために再冷却を必要とした。主に洞調律は低体温症の開始後65±38hを再出現させた。 ジェットと急速なHRが再び現れたので、低体温中に正常な洞調律を回復した6人の患者の二つは、再冷却を必要とした。
退院した11人の患者は生存しており、平均フォローアップ期間15±12ヶ月(範囲、2-36ヶ月)後に神経学的後遺症はなかった。 経過観察中に不整脈を伴わずに洞調律を維持した。
ディスカッション
術後ジェットは、hisの結節組織または束に位置する異所性焦点から生じ、手術中の機械的刺激によって誘発される。2その異所性の性質は、交感神経-迷走神経バランスに敏感であり、心房過剰刺激または電気的除細動に抵抗性である。 高HRおよびAVDは心拍出量を減少させ、これはアドレナリン作動性緊張の増加のために不整脈を加速させ、悪循環を作り出す。1,2プロセスは48-72時間以内に自己制限的であるため、2治療の主な目標は、不整脈が自発的に伝達されるまで適切な心臓出力の維持である。
治療には、1、2、4、5電解質不均衡および酸-塩基不均衡の修正、アドレナリン作動性刺激(痛み、刺激、不安)の除去、適切な鎮静、およびHRおよびJETを加速する変力2抗不整脈薬に対する反応は不良であり、2ジゴキシンは有効ではない。5Propafenoneはそれが否定的な変力性の代理店であるという事実にもかかわらず利点、6があるようです。 アミオダロンは有用である7,8私たちの経験では、低血圧の出現のために体積膨張を必要とするかもしれないが。 プロカインアミドは、低体温単独では不十分である場合にのみ、低体温と組み合わせて有効である。5β遮断薬の役割は議論の余地があり、2およびカルシウム拮抗薬は推奨されない。 他の処置の選択はペースメーカーとの刺激のさまざまなモード、および処理し難い場合のHisの束の敏速な切除です。1,2
早期診断が基本です。 ジェットが疑われる場合は、12リード心電図と心房電気グラムを行う必要があります。9私たちの一連の患者では、心房電気写真は、2人の患者でAVDのマスクを解除し、表面心電図がAVDを示唆していた6人の患者で疑いを確認することを可能にした(図2)。
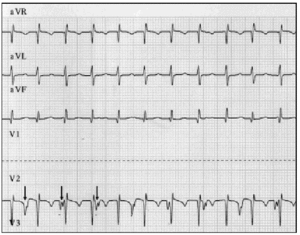
図1.1.1. 2. AVR、aVLおよびaVFの鉛を含むジェット機の心電図のトレース。 下のトレースは心房電気グラムを示し、通常V2電極に使用されるリードを心房心外膜電極に接続することによって得られた。 このトレースは、増加した心房活動(矢印)を示しています; 房室解離は心室速度と比較して心房速度が遅いことから明らかである。
低体温による治療は、中心温度を低下させるとペースメーカー細胞の自動性が低下するという観察に基づいています。 この治療の最初の報告はBashらによって出版されたので。 1987年3月には、少数の患者で低体温症の使用に成功したという報告が報告されている。9,10これらの介入の目的は、32-35℃の中心温度を達成することであった。 私たちの目標は、適切なペースメーカー治療が可能になるまでHRを削減し、したがって、深い低体温とその可能性のある副作用を避けることでした。 心房の心外膜の電極が利用できなかったので2人の患者でペースメーカーは使用されませんでした。 彼らの良好な臨床経過を考慮して、我々は食道電極を使用しないことにしました。 低体温時に投与されたジゴキシンとアミオダロンのHR制御における相対的有用性を判断することはできなかった。
この一連の患者では、ペースメーカーの使用に伴う低体温が効果的で安全な選択肢でした。 血行力学的変化は数時間以内に起こり,低体温に直接起因する副作用は見られなかった。 私たちが研究した少数の患者は一般化することはできませんが、私たちのシリーズの8.3%の死亡率は、保存的治療のために報告された40%の数字よりも明死亡した乳児は、シリーズの最初の患者の1人であり、低体温の失敗を説明するかもしれません非常に急速な頻脈を持っていました。
再ウォーミングは、安定した洞調律の回復を待つことなく、少なくとも36時間の血行力学的安定性の後に開始された。 再冷却が必要とされる可能性(27%)は、洞調律またはジェットと関連していなかったため、再冷却は血行力学的基準のみに基づいてタイミングを計るこ
我々の研究の限界は、対照群を持たない少数の患者に基づくレトロスペクティブな観察分析に固有のものである。 それにもかかわらず、我々は我々の発見は、一緒に他の公開されたレポートと、術後ジェットの管理のための効果的かつ安全な治療として低体温の使用を