Introduction
多様な気候にわたる昆虫の適応放射線は、休眠の繰り返し進化、好ましくない条件(例えば、冬、乾季;Waterhouse and Norris,1980;Tauberら。 ることを示した。 休眠は、通常、トークン環境キューに応答して開始されます(例えば、、光周期の季節変化)、遺伝的に決定された期間維持され、その後、良好な条件が戻った後に終了します。 したがって、休眠は、昆虫がそれらの成長および生殖を局所的な季節サイクルと整列させることを可能にする(Tauber e t a l.,1986;ダンクス,1987). 休眠は、多くの昆虫花粉媒介者の生活史、地理的範囲、および季節の豊富さの重要な調節因子である(例えば、Kemp and Bosch,2005;Fründ et al. ら、2 0 1 3)、農業害虫(例えば、Pullin e t a l. 1991年;Li et al. ら、2 0 1 2;Levine e t a l. 例えば、Denlinger and Armbruster,2 0 1 4;Gray e t a l.,2 0 1 5)、および疾患ベクター(例えば、Denlinger and Armbruster,2 0 1 4;Gray e t a l., 2016). さらに、休眠は、栄養埋蔵量の蓄積、代謝活性の抑制、嫌気性異化の増加、細胞周期の停止、Wntシグナル伝達の変化、および様々なストレス耐性メカニズムのアップレギュレーションを含む広範な生理学的改変を引き起こす(Denlinger、2002;Hahn and Denlinger、2007、2011;King and MacRae、2015;Ragland and Keep、2017)。 休眠の根底にある調節機構を理解することは、生物生物学における長年の問題であり、主要種に対する新しい管理アプローチの開発を容易にする。
エクジステロイドおよび若年ホルモンは、昆虫の生理学的および発達過程の広い範囲を調節する(Gruntenko and Rauschenbach,2008;Jindra et al. ら、2 0 1 3;Palli、2 0 1 6)、休眠を含む(Denlinger、1 9 8 5;Denlinger e t a l., 2012). 休眠を調節する特定のホルモンシグナルは、発達停止が起こる段階によって変化する傾向がある(Denlinger e t a l., 2012). 例えば、幼虫または蛹休眠中の発達停止は、典型的には、エクジステロイドの存在量の変化によって調節される(例えば、OhtakiおよびTakahashi、1 9 7 2;Bowen e t a l.、1 9 8 9年、Bowen e t a l.、1 9 8 9年、 ら、1 9 8 4;Richard e t a l., 1987). 対照的に、成体休眠中の発達停止は、しばしば、若年ホルモンの存在量の変化によって調節される(例えば、Spielman,1 9 7 4;Schooneveld e t a l. ら、1 9 7 7;Saunders e t a l. ら、1 9 9 0およびDenlinger e t a l., 2012).
胚性休眠のホルモン調節についての我々の理解には大きなギャップが存在し、これは鱗翅目、整形目、半翅目、双翅目全体で広く観察されている。 これまでの研究では、カイコガ(Bombyx mori)における休眠ホルモンによる胚休眠の内分泌調節が広く文書化されている(長谷川、1963; 山下と長谷川,1966;山下,1996). しかしながら、休眠ホルモンのためのこの調節的役割は、b.moriに特有のものであるように思われ、したがって、他の種における胚休眠のホルモン基礎に, 2012). B.moriを超えて、胚休眠のホルモン調節はわずか三つの種で確立されている。 ジプシー蛾(Lymantria dispar)は、エクジステロイドのより高い豊富さによって開始され、維持される発達停止を受ける(Lee et al., 1997; LeeおよびDenlinger,1 9 9 7)が、低エクジステロイドの存在量が2つのイナゴの休眠を調節している(Chortoicetes terminifera,Locusta migratoria;Gregg e t a l. ら、1 9 8 7;Tawfikら、1 9 8 8;Tawfikら、, 2002).
これまでの研究では、いずれのジプテラン種の胚休眠中にもホルモンの豊富さを特徴付ける研究はなかった。 ここでは、アジアのトラの蚊、Aedes albopictusの胚休眠のホルモン調節を調査することによって、このギャップに対処します。 過去3 0年間で、この医学的に重要なベクター(Paupy e t a l. 2009年)は世界中の温帯地域への侵入に成功している(Benedict et al. 長距離輸送中の生存を促進した胚性休眠に部分的に起因する(Juliano and Lounibos,2005;Diniz et al. ら、2017)と急速に進化し、発達停止のタイミングを地元の気候条件と合わせるようになった(Urbanski et al., 2012). Aeの温暖な個体群。 albopictusは母性的に調節された、光周期の休眠に入る。 短い秋の日長の下では、雌は胚発生を完了するが、次の春まで卵の絨毛膜内のpharate幼虫として孵化刺激に難治性のまま卵を産生する。 過去十年にわたって、aeにおける胚休眠の転写調節。 albopictusは広範囲に特徴付けられている(Urbanski e t a l. ら、2 0 1 0;Poelchau e t a l. ら,2 0 1 1,2 0 1 3a,b;Huang X. ら、2 0 1 5;Batz e t a l.,2017)しかし、この重要な適応のホルモン調節は不明のままである。 我々は、胚発生の重要な段階をブラケットし、以前に収集されたRNAseqのコンテキストで我々の結果を解釈した三つの時点で休眠と非休眠卵における20-ヒドロキシエジソン(20HE)と若年ホルモンIII(JH3)を定量化した(Poelchau et al. ら,2 0 1 3a,b)および操作データ(Suman e t a l., 2015).
材料と方法
採卵
すべての測定は、Aeの実験室コロニーからのF11卵を使用しました。 2015年、アメリカ合衆国バージニア州マナサスで採集された200匹以上の幼虫からalbopictusが設立された。 この実験の前に、集団は、前述の条件の下で維持された。 この実験のための卵サンプルを生成するために、F10幼虫は5.5L Sterlite容器に約250幼虫あたり2の密度で維持された。LD光周期下、2 1℃および8 0%R Hで、5mlの食品スラリー(ArmbrusterおよびConn、2 0 0 6)で、5Lの脱イオン(D I)水を得る。 毎週月曜日–水曜日–金曜日、幼虫は、きれいな5.5Lステライトコンテナに転送し、細かいメッシュネットを通して濾過した;蛹は、休眠回避LD光周期または休眠誘導、短日光周期(SD、8:16L:D)のいずれかの下で維持された成体ケージに分布した。
成体の雌には、産卵が停止するまで、毎週の血便と無漂白のペーパータオルで裏打ちされた産卵カップが提供され、DI水で半分満たされました。 卵を毎日収集し、湿ったペーパータオル上で48時間維持し、次いで空気乾燥し、SD条件下で容器に保存した。 産卵後5、7、および1 1日目(dpov)に、収集した卵を、M X5マイクロバランス(Mettler−Toledo,Columbia,O H,United States)上で最も近い1μ g(平均:1 1. 卵のサブセットを保持して、LDおよびSD光周期条件がそれぞれ非休眠および休眠卵の産生を刺激したことを確認した(Urbanski e t a l., 2012).
私たちは2つの理由で5、7、および11dpovで卵を採取しました。 まず、Ae。 albopictusは休眠を開始する(sensu Koštál、2006;Koštál et al. 胚発生の完了後(Moriら、2 0 1 7)(moriら、2 0 1 8)。, 1981). 我々の実験で利用された条件の下で、Ae。 albopictus胚は約5dpovで分節化を受け、非休眠胚は約7dpovで孵化する能力がある(Poelchau et al.、2013a)。 1 1dpovによって、休眠胚において発達停止がしっかりと確立される(Poelchau e t a l.、2013b)。 したがって、我々は休眠中の発達停止の確立を含む、孵化能力の期間をブラケット時点で休眠と非休眠胚を比較することを選択した。 第二に、本発明者らは、胚の以前のRnaseq実験に使用されたものと類似した時点を選択した(Poelchau e t a l.,2013a,b)これらのデータを活用して現在の結果を解釈できるようにします。 これらのRnaseq結果は、qRT−PCRを介して得られた遺伝子発現結果とよく相関することが以前に見出された(Poelchau e t a l.、2013a)。<5 9 3 8><3 5 8 3>エクジステロイドの定量<5 0 6><8 6 2 2>エクジステロイドを抽出するために、卵試料を、1μ gのfarnesol(Sigma−Aldrich,St. 卵を、300μ lのHPLCグレードのチルドMeOH中のテフロン乳棒で3回手動で均質化し、その後、冷蔵(4℃)遠心分離機中で12,000RCFで10分間回転させた。 得られた上清をプールし、次いで酸化アルミニウムカラムを通して冷却された9 0%Meohで2回、Meohで1回溶出した。 試料を冷蔵(4℃)真空遠心分離機中で乾燥させ、2 0μ LのMeoh中に再懸濁し、分析まで−8 0℃で保存した。 陽性対照を、それぞれ1μ gの2 0H E(Sigma−Aldrich)およびfarnesolを、別の点では同じように処理された空の管に添加することによって調製した。 エクジステロイド濃度の試料分析は、Micromass Quattro Micro LC−MS/MS(Waters C O.、ミルフォード、マサチューセッツ州、米国)。 注入量は5.0μ lであり、分離は、1.7μ mの固定相を有するACQUITY UPLC BEH C18 2.1mm by50mmカラムを使用して行った(Waters Co.). LCランの動作条件は、アセトニトリル中の0.37mL分–1の移動相流量であり、アセトニトリル中の0.1%ギ酸および水中の0.1%ギ酸の二成分移動相であった。 初期条件は1:99アセトニトリル:水であり、続いて0.3分間アイソクラティックフローであった。 0.3分で、1からの線形勾配:99から99:1アセトニトリル:水を4.2分にわたって適用し、続いて1.0分のイソクラティック流を99:1アセトニトリル:水で適用し、その後移動相を1:99アセトニトリル:水に戻した。 質量分析計の設定は、350℃の脱溶媒温度で、エレクトロスプレー陽性であった20HEとファルネソールは、それぞれ2.89と4.97分で溶出し、特性遷移の複数の反応モニ アッセイの検出限界は約5pgである。
幼若ホルモン定量
各卵サンプルを、ホウケイ酸ガラス0.5mL円錐底マイクロ組織粉砕管(Wheaton)に入れ、1μ gのfarnesol(Sigma-Aldrich)を内部標準として添加した。 卵を500μ lのHPLCグレードのチルドヘキサン中のテフロン乳棒で3回手動で均質化し、その後、冷蔵(4℃)遠心分離機で10分間12,000RCFで回転させた。 ヘキサン画分をきれいなホウケイ酸ガラスバイアル中で再結合し,真空遠心分離により乾燥させた。 J Hを、前述のようにガスクロマトグラフィー/質量分析を用いて定量した(Brent and Vargo,2 0 0 3)。 簡単に説明すると、残留物をヘキサンの3回のすすぎでバイアルから洗浄し、酸化アルミニウムで満たされたホウケイ酸ガラスカラムに添加した。 汚染物質を濾過するために、試料をヘキサン、10%エチルエーテル-ヘキサンおよび30%エチルエーテル-ヘキサンで連続的にカラムを通して溶出した。 乾燥後、メチル−dアルコール(Sigma−Aldrich)およびトリフルオロ酢酸(Sigma−Aldrich)の溶液中で6 0℃で2 0分間加熱することによって試料を誘導体化した。 試料を乾燥させ、ヘキサン中に再懸濁し、再び酸化アルミニウムカラムを通して溶出した。 非誘導体化成分を30%エチルエーテルで除去した。 J H誘導体を、5 0%酢酸エチル−ヘキサンの添加によって新しいバイアル中に収集した。 2 5mm Zebron Z B−WAXカラム(Phenomenex,Torrance,C A,United States)を装備したHP7 8 9 0AシリーズGC(Agilent Technologies,Santa Clara,C A,United States)を用いて分析した。 ヘリウムはキャリアガスとして使用された。 JHの形態はJH0、JH I、JH II、JH3およびJH3エチルの知られていた署名のための走査モードの最初操業テストサンプルによって確認されました;JH3はこ その後のサンプルは、MS SIMモード、m/z7 6および2 2 5でのモニタリングを使用して分析し、J H3のd3−メトキシヒドリン誘導体の特異性を確実にした。 総存在量は、誘導体化されたJH3の標準曲線に対して定量化され、卵の開始質量について調整された。 アッセイの検出限界は約1pgである。
統計分析
分析はRで実行されました(Rコアチーム、2019)。 JH3の存在量を対数変換し、休眠状態、年齢、およびそれらの相互作用の影響をテストするためにANOVAを使用して分析しました。 20HE存在量は非線形であり、二つの多項式回帰モデルを使用してフィット:年齢と発達状態(休眠、非休眠)を含む完全なモデルと、年齢のみを含む縮小モデ モデルをANOVAを用いて比較して、発達状態を含むことで説明力が有意に改善されたかどうかを決定した。
休眠および非休眠Aeから以前に収集されたRNAseqデータを利用した転写解析。 アルボピクタスの卵(補足データセット1;Poelchau et al.,2013a,b). 3、6、および1 1dpovでの特異的に発現された遺伝子を、遺伝子セット濃縮分析によって調べた(Mootha e t a l. Pianoパッケージを使用した(Varemo e t a l.,2013)デフォルトパラメータに設定し、その後にFDR補正を行います。 参照遺伝子セットに、Vectorbase上に割り当てられた生物学的プロセスGO用語を注釈した(Giraldo−Calderon e t a l., 2015). J H3およびエクジステロイド合成経路遺伝子ならびにJ H3受容体および分解遺伝子を、以前の文献に従って手動で注釈した(Bai e t a l. ら,2 0 0 7;Liら,2 0 0 8;Mol. ら、2 0 1 1;Nouzova e t a l. ら,2 0 1 1;NiwaおよびNiwa,2 0 1 4;Mathews e t a l., 2016). さらに、本発明者らは、Vectorbase(Giraldo−Calderon e t a l., 2015). これらの遺伝子セットの完全な概要は、補足データセット1で提供されています。
結果
平均休眠発生率は95.9%(範囲:90.5–100%)で、SD光周期と5であった。4%(範囲:1.8–9.5%)LD光周期(補足データセット2)の下で;したがって、私たちの光周期治療は、予想される休眠応答を誘導した。 20HEは7dpovで休眠条件と非休眠条件の両方でピークに達しましたが、20HE存在量の二次モデルの因子として休眠状態を含めると、モデルの説明力は改善されませんでした(図1Aおよび補足データセット3;F3,43=0.21,p=0.890)。 これらの結果は、休眠状態が有意に20HE力価の変動を説明しないことを示している。 RNAseqの経路分析は、20HE合成経路も20HE誘導性遺伝子も、3、6または11dpovでの休眠対非休眠条件下で有意に変化しなかったことを示した(表1)。

表1. 遺伝子セットの濃縮分析結果は、これらの遺伝子セットの完全な要約については、補足データセット1を参照してください。
JH3は、この種の若年ホルモンの主要な形態であることが確認された。 JH3の存在量は、休眠胚で有意に減少した(図1Bおよび補足データセット3;F1、64=5.08、p=0.028)。 しかし、年齢(F2、64=0.66、p=0.518)と休眠状態と年齢(F2、64=0.13、p=0.883)の相互作用はJH3レベルに影響しませんでした。 RNAseqデータの経路分析は、JH3合成経路が3dpovで有意に抑制され、JH誘導性遺伝子が6dpovで有意に抑制されたことを示した(図2および表1)。
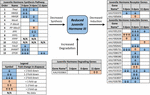
図2. Jh3合成、分解、およびaeの誘導に関与する遺伝子の差動発現の概要。 アルボピクトゥス(Poelchau et al.,2013a,b). 有意な休眠誘発性の減少(青色)または増加(オレンジ)は、網掛けされた細胞によって示される。 差分の大きさは、左下の凡例に記載されているように矢印で示されています。 ①共通名のない遺伝子は、VectorBase ID番号によって識別されます。
議論
休眠は、昆虫が季節的に有利な条件で成長と生殖を整列させることを可能にする広範な適応である(Tauber et al.,1986;ダンクス,1987). 昆虫が発達停止につながる生理学的メカニズムと外部の休眠誘導手がかりの知覚を調整するホルモンの変化を理解することは、生物学における長年の目標である(Lees、1956;Denlinger、2002)。 数十年の研究は、幼虫、蛹、および成虫の段階での休眠のための一般的なホルモン戦略の同定につながっている;しかし、胚休眠のホルモン調節は、特に双翅目(Denlinger,1985,2002;Denlinger et al., 2012). 本研究では、休眠中の減少したJH3存在量の我々の直接測定は、以前の遺伝子発現プロファイリングによって裏付けられている(Poelchau et al. ら,2 0 1 3a,b)および操作実験(Sumanら,2 0 1 3a,b)および操作実験(Sumanら, 2015年)は、JH3がこの種の胚休眠を調節するという仮説を支持している。
エクジステロイド
本研究では、蚊Aeの胚における休眠および非休眠条件下での三つの時点でエクジステロイドの存在量を直接測定した。 アルボピクタス Toxorhynchites amboinensis(Russo and Westbrook、1986)からの以前の結果と一致して、20HEレベルは胚発生の結論の近くでピークに達した(7dpov;図1A)。 しかし、20HE力価は休眠と非休眠卵の間で有意に異ならなかった。 さらに、2 0H E合成経路も2 0H E誘導性遺伝子も、遺伝子発現において有意な協調的変化を受けなかった(表1)。 我々は、以前に鱗翅目および整形外科における胚休眠を検討したのとは対照的に、と結論している(長谷川、1963;山下と長谷川、1966;Gregg et al. およびDenlinger,1 9 9 7;Lee e t a l.,1 9 8 7;Yamashita,1 9 9 6;Lee and Denlinger,1 9 9 7;Lee e t a l. ら、1 9 9 7;Tawfikら、1 9 9 8;Smith e t a l.,2002),20HEはAeにおける休眠開始を調節しない。 アルボピクタス
若年ホルモン
対照的に、休眠胚ではJH3の存在量が約二倍低いことが観察されました(図1B)。 他の生命段階で休眠する昆虫における休眠対非休眠条件下で検出されたJH3存在量の差よりも大きさが小さいが(例えば、Yin and Chippendale,1979;Walker and Denlinger,1980;Readio et al.,1999),我々の直接測定は、転写証拠によって裏付けられています(図2). 例えば、J H3合成経路は、初期の休眠調製(3dpov)中に有意に抑制される。 これらの結果の我々の解釈を支持して、以前の研究は、JH3合成経路に沿った遺伝子の発現の減少は、Aedes aegyptiの両方におけるJH3の存在量の低下と強く相関していることを見出した(Nouzova et al. ら、2 0 1 1;Rivera−Perez e t a l. ら、2 0 1 4)およびDiploptera punctata(Huang J., 2015). JH誘導性遺伝子も大幅に休眠運命の胚は、非休眠胚が孵化する能力になる時間の近くにJH3シグナル伝達に応答する限られた能力を持っているこ さらに、JH3分解酵素(JHエステラーゼ)の遺伝子発現が大幅に早期休眠維持(11dpov;図2)だけでなく、後に休眠維持(21および40dpov;Poelchau et al.,2013b)JH3はこの種の休眠を通して低い豊富に残るかもしれないことを示唆している。
幼若ホルモン力価が低いことは、一般的に、特に幼虫から蛹期までの進行性脱皮に関連しているため、発達停止中のJH3の存在量の減少はやや直感に反している(Palli,2016)。 しかし、休眠AeへのJH3アナログ(pyriproxyfen)の適用。 albopictus卵は、用量依存的に休眠終結の速度を加速する(Suman et al., 2015). 最も効果的な投与量では、ピリプロキシフェン曝露卵の約8 0%が3 0dpovで休眠を終結させるのに対し、対照卵については8 0dpovでちょうど1%の休眠終結, 2015). JH3の豊富さの変化はまた、他の種の胚休眠のような表現型を生成することができます。 例えば、Bでは。 mori,jhamtノックアウトによるJH3合成の実験的減少は、ふ化刺激に応答しない完全に発達したpharate幼虫をもたらす;この表現型は、抽出されたJH3またはメトプレン、JH3アナログのいずれかの適用によって用量依存的に救出することができる(Nakao et al., 2015). 同様に、新たに寄託されたショウジョウバエmelanogaster卵への別の若年ホルモン類似体(RO-20-3600)の実験的補充は、卵内で移動性であるが孵化しないファラテ幼生を産生する(Smith and Arking、1975)。 一緒に、これらのデータは、少年ホルモンの豊富さは、おそらく多様な昆虫のふ化応答の調節に寄与することを示しています。 Pharate larval段階の萌芽期の休眠は刺激をふ化することに答える失敗によって定義されます従って、若年ホルモンの豊富の変更は休眠のこの形態を調整する
以前の転写および操作データと連携して、我々の結果は強くaeの胚休眠の可能性が高いレギュレータとして減少したJH3の豊富さを関与させます。 アルボピクタス この研究は、任意のDipteran種における胚休眠中のホルモンの豊富さの最初の直接定量化であり、不利な環境にこの重要な適応のホルモン調節を明らかに 外部刺激とホルモンシグナル伝達を介した発達停止との間の連鎖を特徴付けることは、主要な課題のままである(Denlinger,1985;Denlinger et al., 2012). 様々な種におけるこれらの経路を解明することは、生命史の進化の分子的および生理学的基礎の理解、気候変動に対する種の応答の予測、害虫およびベクター種の管理のための新しい標的の特定など、基本的および応用的な問題に対する重要な洞察を提供する(Denlinger、2008)。
データ利用可能性に関する声明
本研究のために生成されたすべてのデータセットは、記事/補足資料に含まれています。
著者の貢献
ZB、CB、PAは、研究の概念、デザインに貢献し、原稿の最初の草案を準備しました。 ZB,MM,JSは畜産を行い,卵試料を採取した。 CBは、LC−MS/MSおよびGC−MS分析を行った。 ZBは統計分析を行った。 すべての著者は原稿の改訂に貢献し、提出されたバージョンを承認しました。
資金調達
この研究は、国立衛生研究所(1R15A|111328-01)およびPAへのDavis家族の寄付によって支援されました。
利益相反
著者らは、この研究は潜在的な利益相反と解釈される可能性のある商業的または財政的関係がない場合に行われたと宣言しています。
謝辞
私たちは、ホルモン力価の測定を支援してくれたAllan KnopfとDan Langhorstに感謝します。 私たちはまた、原稿の以前のバージョンに役立つコメントのためのDavid Denlingerに感謝します。 この記事での商号または商用製品の使用は、特定の情報を提供することを目的としており、米国農務省による推奨または推奨を意味するものでは USDAは機会均等の提供者および雇用者である。
補足資料
Rコアチーム(2019)。 R:統計計算のための言語と環境。 ウィーン:Rコアチーム。
とができるようになりました。 遺伝子発現の方向性を取り入れ、統計的仮説と方法を組み合わせることにより、ゲノムワイドデータの遺伝子セット解析を充実させます。 核酸Res.41、4378-4391。 doi:10.1093/nar/gkt111
PubMed Abstract|CrossRef Full Text|Google Scholar