| Auteur | Aansluiting |
|---|---|
| Lindsay A. Weiner, MD | Universiteit van Maryland Medical Center in Baltimore, Maryland |
| George Smith, MD | Universiteit van Maryland School of Medicine, Afdeling van de Spoedeisende Geneeskunde, Baltimore, Maryland |
| Zachary D. W. Dezman, MD, MS, MS | Universiteit van Maryland School of Medicine, Department of Emergency Medicine in Baltimore, Maryland |
| Laura J. Bontempo, MD, MEd | University of Maryland School Of Medicine, Department of Emergency Medicine, Baltimore, Maryland |
Case presentation
Case discussion
Case outcome
Resident discussion
Final diagnosis
belangrijkste leerpunten
CASE PRESENTATION
een 52-jarige vrouw kwam naar de spoedeisende hulp (ED) voor hemodialyse (HD) als gevolg van terminale nierziekte (ESRD). Ze had de voorgaande weken doorgebracht in een buitenziekenhuis en werd behandeld voor longontsteking en bacteriëmie met daptomycine. Ze vertrok vervolgens tegen medisch advies (AMA) na het verwijderen van haar dialyse toegangskatheter. Ze presenteerde zich aan onze ED omdat ze hd vasculaire toegang plaatsing nodig had en opnieuw starten van dialyse behandelingen. Haar medische geschiedenis omvatte chronische nierziekte secundair aan hypertensieve nefrosclerose, bloedarmoede, hypertensie, diepe veneuze trombose (DVT), systemische lupus erythematosus, en een aanval stoornis van onbekende etiologie.
de patiënt, een Jehovah ‘ s Getuige, weigerde bloedtransfusies; daarom werd haar anemie behandeld met intraveneuze (IV) toediening van ijzer, epoëtine alfa en folaat. Andere geneesmiddelen omvatten nifedipine, clonidine, metoprolol, sevelamer en prednison. Ze was allergisch voor amoxicilline, azithromycine, hydralazine, labetolol, linezolide, morfine en vancomycine. Ze rapporteerde eerder IV heroïnegebruik vele jaren eerder en eerder roken van sigaretten. Ze ontkende het gebruik van alcohol, drugs of tabak.
bij aankomst was ze alert en in geen acute nood met 38 koorts.3° Celsius, hartslag van 87 slagen per minuut( bpm), bloeddruk van 110/65 millimeter kwik (mmHg), ademhalingssnelheid van 17 ademhalingen per minuut, en pulsoximetrie van 99% tijdens de ademhaling kamerlucht. Ze woog 80 kilo en was 1,80 meter lang. Haar hoofd was normocephalisch en atraumatisch met vochtige slijmvliezen. Leerlingen waren anicterisch, gelijk, rond, en reageerden op licht en accommodatie. De nek was soepel en zonder lymfadenopathie of gevoeligheid. Haar longen hadden Grove ademgeluiden met milde bibasilaire gekraak, maar geen piepende ademhaling of rhonchi. Er waren geen intrekkingen of verhoogde werk van de ademhaling. Haar hart was van regelmatige snelheid en ritme zonder geruis, wrijven, of galop. Haar buik was zacht met normale darmgeluiden en zonder zwelling, gevoeligheid, rebound, of bewaking. Er was geen gevoeligheid van de costovertebrale hoek. De onderste ledematen hadden 1 + pitting oedeem, 2 + dorsalis pedis pulsen, en waren zonder tederheid of misvorming. De patiënt had een normale kracht en spierspanning in alle ledematen met intact gevoel. Oude fistels waren aanwezig in de linker en rechter bovenste ledematen zonder voelbare sensatie. Ze was alert en gericht op persoon, plaats en tijd.
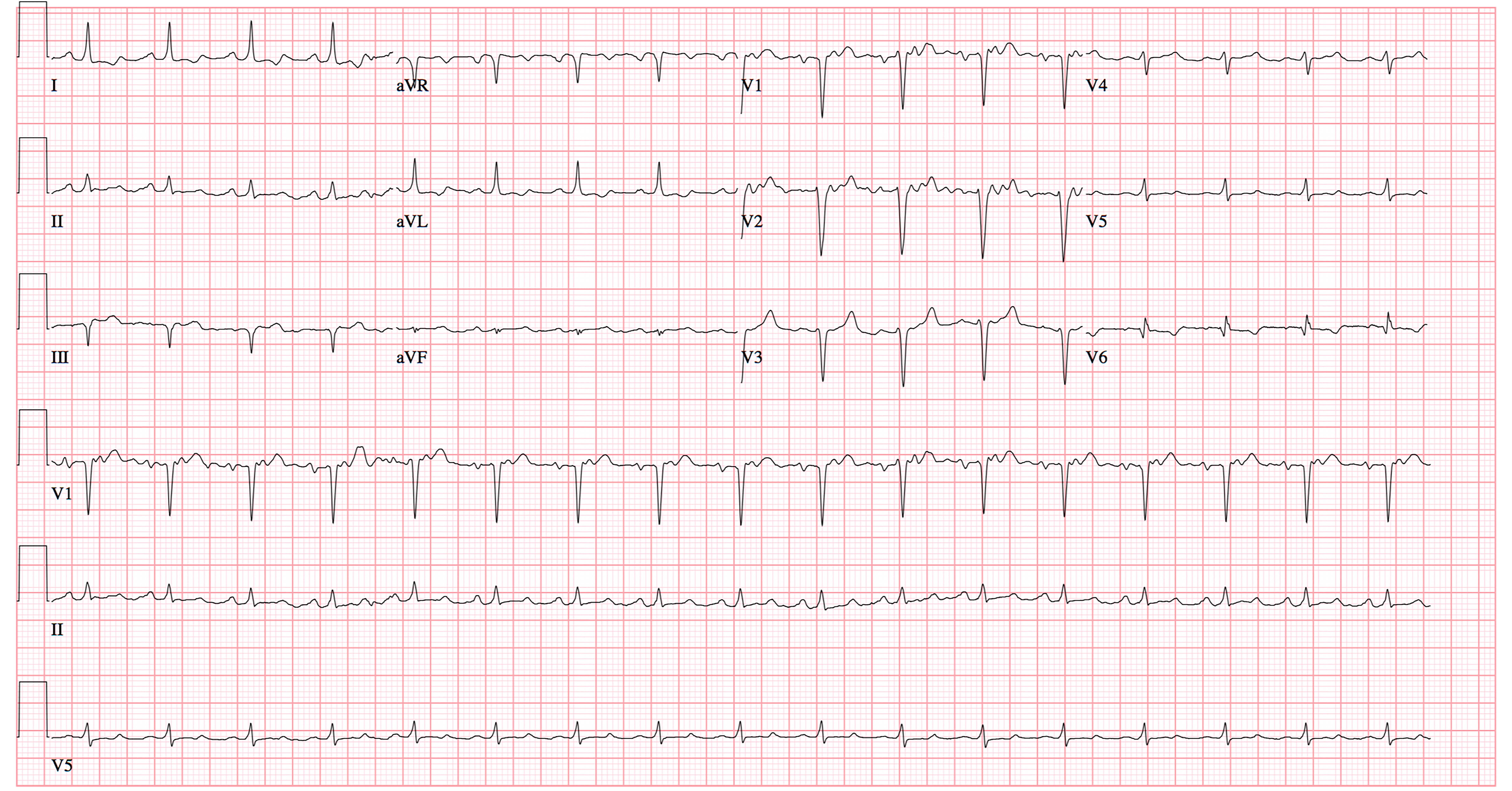
de initiële laboratoriumwaarden van de patiënt zijn weergegeven in Tabel 1. Deze waren significant voor een lichte leukocytose, bloedarmoede tot 5.3 g/dL, trombocytopenie, hyperkaliëmie, en een verhoogd creatinine van 11,9 mg/dL. Haar eerste elektrocardiogram (ECG) toonde een sinustachycardie met T-golf inversies in leads I en V6 (Afbeelding 1). Dit was ongewijzigd ten opzichte van een eerder ECG. De patiënt werd opgenomen in het medicijnteam en begon met daptomycine. In afwachting van de plaatsing van het bed, werd een niet-tunneled linker femorale dialyse katheter ingebracht door de medische intensive care unit (ICU) fellow voor de initiatie van HD. Plaatsing werd bevestigd door het gemakkelijke nadeel van bloed uit alle havens. Tijdens het toestemmingsproces voor katheter plaatsing, werd gedocumenteerd dat de patiënt verklaarde dat ze “liever zou sterven dan bloedtransfusies ontvangen.”Na het plaatsen van de katheter werd een poging gedaan om HD te starten, maar ze werd hypotensief en klaagde bijna onmiddellijk over zwakte. Haar vitale functies tijdens de eerste HD poging waren een bloeddruk van 85/56 mmHg met een hartslag van 105 bpm.
| Waarden | |
|---|---|
| Volledige bloedcellen | |
| Witte bloedcellen | 12.4 K/mcl |
| Hemoglobine | 5,3 g/dL |
| Hematocriet | 15.8% |
| Platelets | 133 K/mcl |
| Basic metabolic panel | |
| Sodium | 135 mmol/L |
| Potassium | 5.8 mmol/L |
| Chloride | 99 mmol/L |
| Bicarbonate | 27 mmol/L |
| Blood urea nitrogen | 56 mg/dL |
| Creatinine | 11.9 mg/dL |
| Glucose | 189 mg/dL |
| Calcium | 7.2 mg / dL |
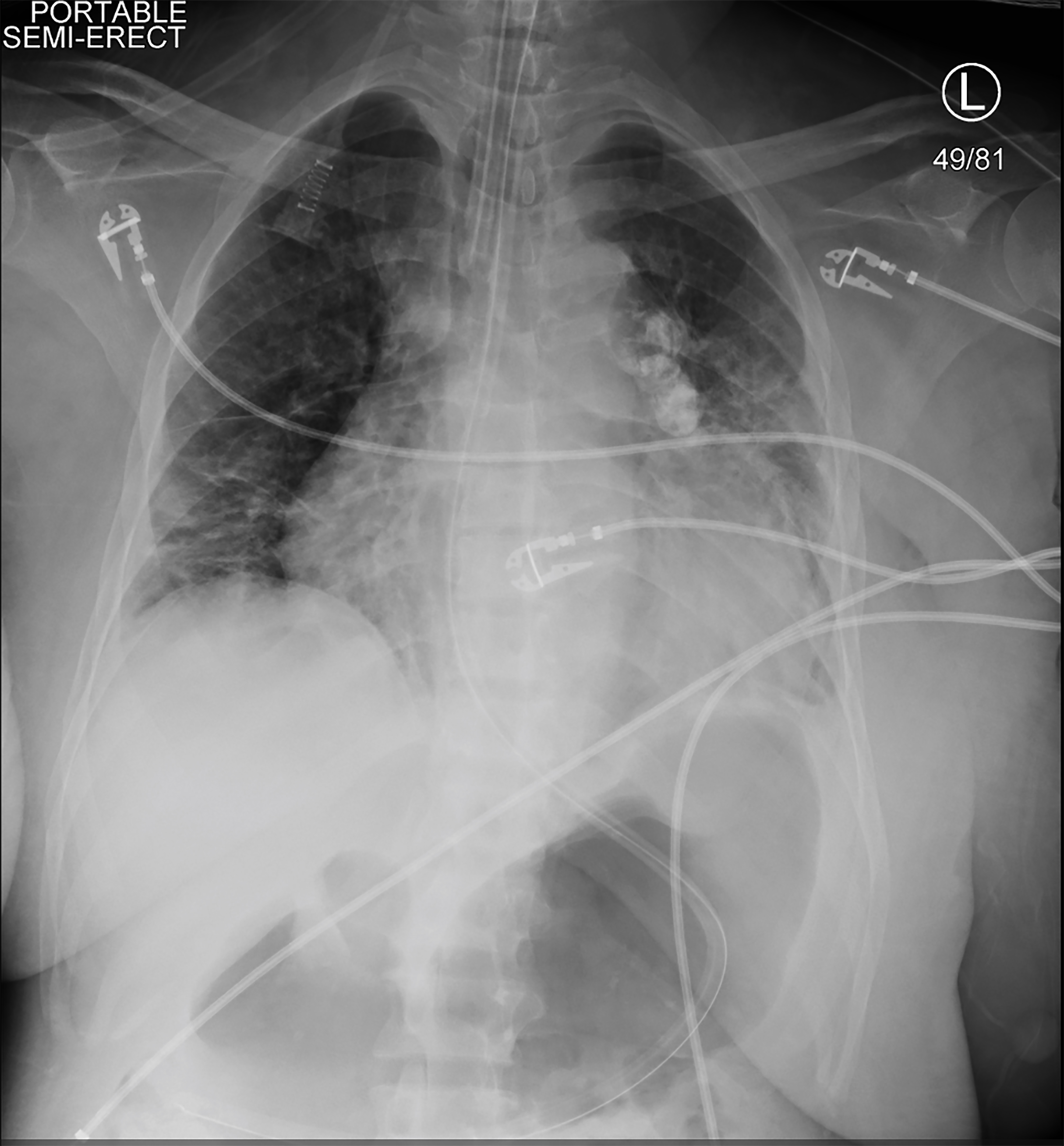
omdat de patiënt symptomatisch en hypotensief was tijdens HD, werd een continue niervervangingstherapie (CRRT) gestart. Kort daarna werd ze hypotensief, reageerde niet, en had een tonische clonische aanval. Vitale functies op dat moment waren een hartslag van 113 bpm, bloeddruk 75/48 mmHg, ademhalingssnelheid van 20 ademhalingen per minuut, en zuurstofverzadiging van 78% op de lucht in de kamer. Een kort, herhaald lichamelijk onderzoek toonde aan dat de patiënt niet reageerde op pijnlijke stimuli en haar pupillen waren gelijk en reactief. Ze kreeg 4 mg lorazepam en intubeerde voor luchtwegbescherming. Een rechter arteriële femorale lijn en een rechter femorale drievoudige lumen veneuze centrale lijn werden geplaatst. Een thoraxfoto bevestigde de plaatsing van de endotracheale tube (Afbeelding 2). De CRRT werd gestopt, maar de patiënt bleef in shock ondanks bolusinfusies van kristalloïde, dus werden vasopressoren gestart. Zij ontving oplopende doses vasopressoren wanneer herhaalde laboratoriumwaarden een hemoglobine van 1,6 g/dL aangaven (Tabel 2).
| Values (prior value) | |
|---|---|
| Complete blood cell count | |
| White blood cell count | 13.4 K/mcl (12.4 K/mcl) |
| Hemoglobin | 1.6 g/dL (5.3 g/dL) |
| Hematocrit | 5.7% (15.8%) |
| Platelets | 167 K/mcl (133K/mcl) |
| Complete metabolic panel | |
| Sodium | 131 mmol/L |
| Potassium | 6.7 mmol/L |
| Chloride | 99 mmol/L |
| Bicarbonate | 14 mmol/L |
| Blood urea nitrogen | 56 mg/dL |
| Creatinine | 11.9 mg/dL |
| Glucose | 169 mg/dL |
| Alanine aminotransferase | 23 u/L |
| Aspartate aminotransferase | 31 u/L |
| Alkaline phosphatase | 145 u/L |
| Total bilirubin | 0.4 mg/dL |
| Totaal eiwit | 5,8 g/dL |
| Albumine | 3.2 g/dL |
| Lactaat | 15 u/L |
| Arteriële bloed gas | |
| pH | 7.23 |
| PCO2 | 28 mmHg |
| PO2 | 214 mmHg |
Kort daarna ging ze naar een hartstilstand met een ritme van pulsatievrije elektrische activiteit (PEA). Terugkeer van de spontane circulatie werd bereikt na zes minuten cardiopulmonale reanimatie. Verhoogde opgezette buik werd opgemerkt tijdens de reanimatie; daarom werd een druk-sensing urinaire katheter geïntroduceerd. Haar piekdruk en blaasdruk werden gemeten bij respectievelijk meer dan 60 cmH2O en 50 mmHg. Vervolgens werd de operatie geraadpleegd. Een massieve transfusie protocol werd gestart nadat haar nabestaanden overeengekomen om de transfusie van bloedproducten toe te staan. Een gerichte beoordeling met sonografie voor trauma (FAST) werd uitgevoerd, met vrije vloeistof in Morrison ‘ s buidel. Aangezien reanimatiemaatregelen werden voortgezet, werd een aanvullend onderzoek verkregen en werd een diagnose gesteld.
casusbespreking
dit geval vertoonde een unieke en omslachtige opeenvolging van gebeurtenissen die zeer snel in een ongelukkige richting spiraalde. Wanneer patiënten worden gepresenteerd met vage of minimale klachten, is het de taak van de zorgverleners om te zoeken naar aanwijzingen om te helpen bij het maken van de diagnose. Daarom begon ik met het zoeken naar de aanwijzingen in dit geval.
de patiënt had een hoofdklacht dat hij dialyse nodig had. Ze was onlangs opgenomen in een andere faciliteit voor longontsteking en bacteriëmie en had haar HD katheter verwijderd vanwege verdenking op lijn sepsis. Ze tekende AMA uit deze faciliteit na het ontvangen van daptomycine. Het is onbekend hoe lang ze zonder HD was geweest of of ze haar antibioticakuur had beëindigd voordat ze vertrok. Echter, ze is in wezen asymptomatisch.
haar medische voorgeschiedenis is opmerkelijk voor zowel aanvallen als DVT ‘ s en bloedarmoede. Er wordt geen melding gemaakt van antistollingsmiddelen of anti-epileptica, wat erop wijst dat ze zich de namen van haar medicijnen niet herinnerde of dat ze er geen nam. Van belang, ze is een Jehovah ‘ s Getuige en daarom kreeg alternatieve therapieën voor haar bloedarmoede, waaronder ijzer, folaat en epogen.Uit haar lichamelijk onderzoek blijkt dat ze koortsig is, maar dat ze verder stabiele vitale functies heeft. Ik zou dit verwachten gezien het feit dat ze de andere faciliteit had verlaten en waarschijnlijk niet klaar met haar antibioticakuur voor haar longontsteking en bacteriëmie. Andere mogelijkheden zijn een infectie resistent tegen het antibioticum of een nieuw verworven nosocomiale infectie van haar vorige verblijf in het ziekenhuis. Ze heeft wat Grove adem geluiden en bibasilar gekraak op haar Long Onderzoek, wat haar longontsteking geschiedenis bevestigt. De longontsteking is hoogstwaarschijnlijk de bron van haar koorts, evenals de bacteriëmie, die niet aanwezig met symptomen kan zijn.
haar laboratoriumstudies brachten enkele relevante bevindingen aan het licht. Ze had bloedarmoede en hyperkaliëmie. Ze was ook hypocalcemisch en hyperfosfatemisch. Ze had ook wat milde uremie. De meeste van deze bevindingen zouden enigszins worden verwacht bij een ESRD-patiënt. De bloedarmoede kan het gevolg zijn van nierziekte. Andere mogelijkheden op de differentiële diagnose voor bloedarmoede omvatten bloeding, ijzerdeficiëntie, en folaatdeficiëntie. Ze klaagt niet over bloedverlies noch hebben we de rode bloedcelindices zoals het gemiddelde corpusculaire volume om deze alternatieve diagnoses op dit moment te kunnen stellen. Haar hyperkaliëmie komt waarschijnlijk door haar gebrek aan HD. Haar hyperfosfatemie is ook het meest waarschijnlijk van gebrek aan HD; echter, daptomycine kan hyperfosfatemie ook veroorzaken.
terwijl ze wacht op het plaatsen van het bed, heeft ze HD gestart, waarbij ze begint te klagen dat ze zich zwak voelt en wordt opgemerkt dat ze hypotensief en tachycardie wordt. Ze heeft dan CRRT gestart en blijft hypotensief, wordt hypoxisch, reageert niet en heeft een tonisch-clonische aanval die intubatie en vasopressor initiatie vereist. Onderzoek toont gelijke en reactieve pupillen bij een patiënt die niet reageert op pijnlijke stimuli. De laboratoriumstudies tonen een diep verergerende bloedarmoede, verergerende hyperkalemia, en intervalontwikkeling van een lactaatacidose. Ze gaat dan in een ERWTENSTILSTAND en, na succesvolle terugkeer van spontane circulatie, heeft bloedtransfusie. Echter, ze is nog steeds hypotensief en hypoxisch ondanks intubatie. Ze heeft ook een opgezwollen buik en piekdruk van de luchtwegen groter dan 60 cmH2O. een snel onderzoek onthult vrije vloeistof in Morrison ‘ s buidel.
een dergelijke diepgaande statusverandering na een therapeutische interventie vereist ernstig nadenken. Laten we beginnen met de hypotensie en tachycardie tijdens HD en daaropvolgende CRRT. Hypotensie tijdens HD is zeker mogelijk met hogere debieten. CRRT heeft echter een veel lagere stroomsnelheid en hypotensie komt minder vaak voor wanneer CRRT wordt gebruikt. Dus waarom is deze persoon in shock die vasopressoren nodig heeft na de initiatie van HD?
bij het benaderen van patiënten met shock, denk ik aan de mnemonische SHOCK (septisch/spinale; hypovolemisch; obstructief; cardiogeen; anafylactische – K zoals in melkzuur). Sepsis is zeker mogelijk, gezien haar geschiedenis van bacteriëmie. Het is echter minder waarschijnlijk dat het de oorzaak is van zo ‘ n diepe decompensatie, vooral met een acuut begin bij het initiëren van HD. Hypovolemische of hemorragische shock is een andere mogelijkheid. Ze heeft risicofactoren voor zowel als ze kan worden op anticoagulatie met haar geschiedenis van DVT, evenals mogelijk met uremische bloedplaatjes storing. Dit moet verder worden onderzocht. Obstructieve shock zoals in longembolie of tamponade is een andere mogelijkheid. Ze heeft zeker risicofactoren voor dit met haar geschiedenis van DVT en onbekende antistollingsstatus. Ze is ook hypoxisch, wat niet wordt verklaard door de longontsteking omdat haar oorspronkelijke verzadiging boven 95% lag. Ze kan ook tamponade van uremische pericarditis hebben ontwikkeld, hoewel dit minder waarschijnlijk gezien het feit dat haar bloedureumstikstof (BUN) niet significant verhoogd is en ze had geen klachten van pericarditis symptomen. Een andere mogelijke oorzaak van hemodynamische ineenstorting die tot obstructieve schok leidt is een luchtembolie van de nieuwe HD-katheter en daaropvolgende initiatie van HD erdoor. Omdat dit mogelijk is, moeten we dit ook een beetje meer plagen.
cardiogene shock is minder waarschijnlijk omdat het onwaarschijnlijk is dat zij een pijnloos myocardinfarct heeft ontwikkeld dat zo ernstig was dat zij cardiogene shock kreeg. Anafylactische en endocriene problemen zijn andere mogelijke oorzaken van shock. Nochtans, waren er geen toegediende medicijnen of om het even welke vermelding van uitslag of luchtwegcompromis om anaphylaxis als oorzaak voor te stellen. Endocriene shock moet worden overwogen omdat ze prednison gebruikt, waardoor bijnierinsufficiëntie een mogelijke oorzaak is. De hyperkaliëmie en hyponatriëmie die u zou verwachten met bijnierschorsinsufficiëntie zijn aanwezig; er is echter geen melding van niet-naleving of braken van de steroïden, waardoor deze mogelijkheid minder waarschijnlijk.
beslag tijdens HD is een andere entiteit aanwezig in dit geval. Ze heeft een voorgeschiedenis van aanvallen, en geen anti-epileptica staat op haar medicijnlijst. Dus, haar aanval kan zeker komen door niet-naleving. Uremische encefalopathie kan zich op elk moment presenteren als epileptische aanvallen; het broodje is echter slechts lichtjes verhoogd, waardoor dit onwaarschijnlijk is. Dialysestoornis syndroom is een andere oorzaak van beslaglegging tijdens HD. Echter, het gebeurt meestal tijdens de allereerste HD-sessie en wordt geassocieerd met een snelle daling van het broodje. Deze patiënt is al enige tijd op HD en het broodje is niet duidelijk verhoogd, waardoor deze diagnose onwaarschijnlijk. Ten slotte kan verminderde perfusie naar de hersenen van hypotensie tijdens HD epileptische aanvallen veroorzaken. De patiënt werd hypotensief tijdens HD, wat kan gebeuren als gevolg van hogere stroomsnelheden. Ze werd vervolgens geplaatst op CRRT, die een langzamer debiet gebruikt en een veel lagere incidentie van hypotensie heeft; echter, ze werd meer hypotensief. Dit suggereert dat er waarschijnlijk een andere reden is voor de hypotensie in plaats van gewoon de HD.
ze heeft ook vrij vocht bij haar snelle onderzoek en heeft nu een opgezwollen buik. In combinatie met de verergerende bloedarmoede, moet ik aannemen dat ze in haar buik bloedt. Er is niets anders dan bloeding en hemolyse die zo ‘ n diepe daling in haar hemoglobine zou kunnen verklaren, en er is geen bewijs verdacht van hemolyse in haar geschiedenis, lichamelijk onderzoek, of bijkomende studies.
de patiënt ervaart ook verhoogde luchtwegdrukken op de beademing. Er zijn verschillende redenen waarom haar luchtwegdruk kan worden verhoogd; maar in de instelling van een opgezwollen buik en hypotensie, abdominal compartiment syndrome (ACS) komt naar de voorgrond van mijn differentiële diagnoses. Daarom moet ik aannemen dat dit een relatief stevige bloeding is, omdat ze haar hemoglobine aanzienlijk heeft laten vallen, in een ERWTENSTILSTAND is gegaan, verbeterd is met bloedtransfusies, en meerdere vasopressoren nodig heeft om haar bloeddruk te handhaven. Maar waarom bloedt ze in haar buik? Ze heeft geen trauma aan haar buik ervaren, tenzij het gebeurde tijdens de aanval in het ziekenhuis; echter, als dit het geval was zou ik aannemen dat deze geschiedenis zou zijn gegeven. Ze had zeker een soort aorta catastrofe kunnen ervaren, zoals een gescheurde abdominale aorta aneurysma, maar het zou heel vreemd zijn als dit gebeurde tijdens HD.
nu moest ik een stap terug doen en de diagnostische aanwijzingen als geheel bekijken en deze puzzelstukjes samenvoegen. Door deze hele patiëntpresentatie in beeld te brengen, ontstaat een gemeenschappelijk thema in zowat elk aspect van haar opeenvolging van gebeurtenissen. Bloeding. Bloedarmoede? Bloeding. Wordt haar bloedarmoede erger? Zeker een bloeding. Hypotensie? Bloeding. Aanval? Hypoperfusie door hypotensie door bloeding. Hypoxie? Ernstige bloedarmoede, die komt van een bloeding. ACS? Bloeding. Melkzuuracidose? Hypotensie en bloedarmoede door bloeding.
nu moeten we alleen nog uitzoeken waar deze bloeding vandaan komt. Toen de patiënt voor het eerst verscheen, leek ze opmerkelijk stabiel. Ze had geen klachten en haar vitale functies, behalve haar koorts, waren binnen de normale grenzen. Ze liet een HD katheter plaatsen zonder enige complicatie. Ze begint HD en haar bloeddruk daalt, haar hartslag stijgt, en ze wordt bijna onmiddellijk symptomatisch. Ik kon gemakkelijk de schuld HD als de oorzaak; echter, haar providers starten CRRT en haar hypotensie verergert, waardoor HD minder waarschijnlijk de oorzaak. Daarom is er iets gebeurd voorafgaand aan de initiatie van HD, omdat ze stabiel was tot HD begon. Het enige dat gebeurde voorafgaand aan de initiatie van HD was de plaatsing van de HD-katheter. Er is geen melding van complicaties of Van significant bloedverlies tijdens de plaatsing. Het is echter de enige gebeurtenis tussen de patiënt die stabiel is en onstabiel.
als er geen melding werd gemaakt van een duidelijke complicatie, wat had er dan kunnen gebeuren? Vergeet niet dat de vermoedelijke bron van de bloeding in de buik is. De HD-katheter werd geplaatst in de lies, die niet ver van de buik en retroperitoneale ruimte. Als de leverancier die de lijn heeft geplaatst, de andere kant van de vaatwand heeft doorboord, kan hij/zij de HD-katheter gemakkelijk hebben geplaatst zodat de punt in het retroperitoneum is. Als dat het geval was, zou de patiënt extravasaat bloed in de retroperitoneale ruimte veroorzaken hypotensie, verminderde perfusie, lactaatacidose, en ernstige anemie. Zodra de retroperitoneale ruimte opgevuld, zou er verhoogde intra-abdominale druk die uiteindelijk tot ACS leiden. Een overzicht van de literatuur onthult een case report van dit type complicatie.1
daarom is het diagnostische onderzoek dat ik zou uitvoeren een computertomografie (CT) angiogram van de buik en het bekken. Dit zou laten zien waar de HD-katheter werd geplaatst en onderzoek het retroperitoneum op tekenen van actieve bloeden.
casus OUTCOME
de diagnostische studie was een CT angiogram van de buik en het bekken. De linker femorale HD katheter had de linker iliacale ader van de patiënt doorboord en vormde een rechterzijdig retroperitoneaal hematoom. Het chirurgisch team beoordeelde de patiënt en voerde een tijdelijke laparotomie uit om haar acute ACS te behandelen. Dit onthulde een groot, rechtszijdig retroperitoneaal hematoom en een grote hoeveelheid ascites. De hemodynamica van de patiënt stabiliseerde na deze procedure en ze was in staat om van alle vasopressoren af te komen. Ze werd vervolgens direct naar de operatiekamer gebracht met het vasculaire operatieteam voor een spoedreparatie van haar linker iliacale ader.
tijdens het herstel bleef ze meerdere bloedtransfusies krijgen. Daarna werd ze overgebracht naar de chirurgische IC met een open buik die vervolgens werd gerepareerd. De patiënt werd neurologisch intact wakker en werd vijf weken na haar verwonding naar huis ontslagen.
RESIDENT discussie
ACS is het eindpunt van een spectrum dat begint met intra-abdominale hypertensie (IAH) en eindigt wanneer de intra-abdominale druk hoger is dan 20 mmHg en gepaard gaat met end orgaandysfunctie.De normale abdominale druk, zelfs bij ernstig zieke patiënten, moet < 12 mmHg zijn. IAH, die in fasen kan worden ingedeeld, wordt gedefinieerd als een druk van 12-25 mmHg zonder de aanwezigheid van orgaandisfunctie.
er zijn verschillende soorten ACS. Primaire ACS komt voor in trauma of chirurgische catastrofes die resulteren in een grote hemorragische gebeurtenis, zoals in het gepresenteerde geval.3 secundaire ACS treedt op wanneer IC-patiënten agressief worden gereanimeerd met grote hoeveelheden kristalloïden.4,5 minder voorkomende secundaire oorzaken zijn grote, ruimte-bezettende laesies, darm-of retroperitoneaal oedeem en pancreatitis. Secundaire ACS is verraderlijk en vaak wordt gediagnosticeerd na een vertraging, verdere complicerende een reeds hoge mortaliteit.4,5
de letaliteit van ACS is het gevolg van een gecompromitteerde orgaanperfusie en later orgaanfalen. In de nieren leidt een verminderde nierperfusie tot congestie en oligurie, terwijl toenemende compartimentdruk directe compressie van het orgaan veroorzaakt.6,7 verhoogde splanchnische vasculaire weerstand resulteert in darmoedeem, translocatie van darmbacteriën, hyperlactemie, en sepsis.6,7 cardiale preload kan verminderd zijn als gevolg van compressie van de inferieure vena cava waardoor het cardiale output afneemt, terwijl de rechter ventriculaire afterload toeneemt.7 de oxygenatie wordt verminderd aangezien het middenrif cephalad wordt geduwd en de functionele resterende capaciteit afneemt.De intracraniale druk stijgt ook als gevolg van halsaderveneuze compressie die de veneuze terugkeer belemmert. Klinisch, zal de patiënt presenteren met hypotensie, hypoxie, acuut nierletsel, veranderde mentale toestand, toevallen, of niet-reactiviteit; uiteindelijk, de patiënt ervaart totale cardiovasculaire collaps.6-8
de gouden standaard voor de diagnose van ACS is het meten van de druk van de blaas indirect met een urinekatheter.Om een nauwkeurige druk te meten, moet de patiënt zich in rugligging bevinden en moet de meting worden uitgevoerd bij het einde van de houdbaarheidsdatum, met de transducer op nul en in lijn met de iliacekam. Er is aangetoond dat deze meting correleert met direct gemeten intra-abdominale druk.10 meting van de blaasdruk om de 4-6 uur is voldoende bij ernstig zieke patiënten met een risico op het ontwikkelen van ACS.
de steunpilaar van de behandeling voor ACS is decompressieve laparotomie, waarbij de patiënt gewoonlijk postoperatief een open buik moet hebben.11 andere secundaire temporizing maatregelen omvatten sedatie en analgesie, neuromusculaire verlamming, decompressie van de darm inhoud met een naso – of endogastrische buis, diuretica, en CRRT.11,12
de mortaliteit van ACS blijft hoog ondanks medische interventie. Terwijl decompressieve laparotomie effectief onmiddellijk intra-abdominale druk vermindert, wordt deze procedure geassocieerd met veelvoudige medische comorbiditeiten met een mortaliteit die nog tot 50% blijft.Dit kan te wijten zijn aan het feit dat op het moment van decompressieve laparotomie, patiënten ernstig ziek zijn en de procedure wordt beschouwd als een laatste redmiddel.
een tweede belangrijk discussiepunt in dit geval is het ethische dilemma waarmee de zorgverleners voor deze ernstig zieke patiënt worden geconfronteerd, wier religieuze overtuigingen in strijd waren met de standaardbehandeling (bloedproducttransfusie) voor haar ziekte. De patiënt had de eerste documentatie in haar grafiek van de arts-patiënt gesprek waarin ze verklaarde haar bewuste weigering van bloedproducten. Echter, ze had niet geschreven, ondertekende documentatie van bloedproduct-transfusie weigering in de grafiek. Terwijl de patiënt bewusteloos en in extremis was, keerde haar man, die geen praktiserende Jehovah ‘ s Getuige is, haar beslissing om in een poging haar leven te redden. Waar valt deze beslissing in de balans van autonomie versus de macht van de nabestaanden om te beslissen welke medische interventies een patiënt moet krijgen? Wat gebeurt er als de nabestaanden een beslissing nemen die tegen de keuze van de patiënt is? In leven-of-dood situaties met ethische dilemma ‘ s,waar snelle besluitvorming zal beslissen patiënt uitkomst, Hoe kan deze last worden gelegd op geliefden?Het ethische dilemma ligt daarom in het idee dat transfusie weliswaar de waarde van autonomie schendt, maar tegelijkertijd het ethische concept van Weldadigheid vervult. In het algemeen moeten persoonlijke richtlijnen voor patiënten voorrang hebben op beslissingen die door de medische gevolmachtigde worden genomen. De beslissing van het gezin om namens de bewusteloze patiënt transfusie te geven, zoals in het onderhavige geval wordt gezien, is echter juridisch passend, ook al schendt het de autonomie van de patiënt.
de ethische commissie werd geraadpleegd nadat de patiënt al een massale transfusie van bloedproducten had ontvangen en nog steeds rode bloedceltransfusies kreeg. Het Comité heeft aanbevolen dat de patiënt geen bloedtransfusies meer krijgt ondanks toestemming van de naaste familie. De patiënt werd neurologisch intact wakker en werd geïnformeerd over de bloedtransfusies. Ze besloot dat ze in de toekomst alleen bloedbank plasma en familie gedoneerde rode bloedcellen zou accepteren tijdens een acute gebeurtenis. De patiënt werd vijf weken na haar iatrogene verwonding naar huis gestuurd.
definitieve diagnose
iatrogene Left common iliac aderperforatie met als gevolg abdominaal compartimentsyndroom.
belangrijke leerpunten
ACS treedt op wanneer de intra-abdominale druk hoger is dan 20 mmHg en er eindorgaanbeschadiging is.
primaire ACS wordt veroorzaakt door een trauma of een operatie, maar let op secundaire ACS die wordt gezien bij massale reanimatie, vooral bij ICUs.
de gouden standaard van ACS-diagnose is een gemeten blaasdruk.
de behandeling is zowel een laparotomie als temporaliserende maatregelen zoals evacuatie van de darminhoud en/of sedatie en verlamming.
gedocumenteerde geïnformeerde toestemming van de patiënt en / of goedkeuring van de institutionele beoordelingscommissie is verkregen en ingediend voor publicatie van dit rapport.
Voetnoten
Editor Voor De Afdeling: Rick A. McPheeters, DO
volledige tekst beschikbaar via open access op http://escholarship.org/uc/uciem_cpcem
Correspondentieadres: Laura J. Bontempo, MD, MEd, University of Maryland, Department of Emergency Medicine, 110 S Paca Street, 6th Floor, Suite 200, Baltimore, MD 21201. E-mail: [email protected]. 2:103 – 108
indiening geschiedenis: revisie ontvangen 22 januari 2018; ingediend 19 maart 2018; geaccepteerd 21 maart 2018
belangenconflicten: Door de CPC-EM artikel indiening overeenkomst, alle auteurs zijn verplicht om alle affiliaties, financieringsbronnen en financiële of management relaties die kunnen worden gezien als potentiële bronnen van vooringenomenheid openbaar te maken. De auteurs onthulden niets.
1. Pafitanis G, Spyridon K, Theodorakopoulou E, et al. Een geval van abdominaal compartiment syndroom veroorzaakt door malpositie van een femorale veneuze katheter. Int J Surg Case Rep.2015;12:84-6.
2. Maluso P, Olson J, Sarani B. abdominale compartiment hypertensie en abdominale compartiment syndroom. Crit Care Clin. 2016;32(2):213-22.
3. Morken J, West MA. Buikcompartimentsyndroom op de intensive care. Curr Opin Crit Care. 2001;7(4):268-74.
4. Biffl WL, Moore EE, Burch JM, et al. Secundair abdominaal compartiment syndroom is een zeer dodelijke gebeurtenis. Am J Sur. 2001; 182 (6):645-8.
5. Burrows R, Edington J, Robbs JV. Een wolf in wolfskleding: het buikcompartimentsyndroom. S Afr Med J. 1995; 85 (1): 46-8.
6. Caldwell CB, Ricotta JJ. Veranderingen in de viscerale bloedstroom met verhoogde intra-abdominale druk. J Surg Res. 1987;43 (1): 14-20.
7. Balogh Z, McKinley BA, Cox CS, et al. Abdominaal compartimentsyndroom: de oorzaak of het gevolg van postinjury meervoudig orgaanfalen. Geschokt. 2003;20(6):483-92.
8. Vidal MG, Ruiz Weisser J, Gonzalez F, et al. Incidentie en klinische effecten van intra-abdominale hypertensie bij ernstig zieke patiënten. Crit Care Med. 2008;36(6):1823-31.
9. Kron IL, Harman PK, Nolan SP. De meting van de intra-abdominale druk als criterium voor abdominale re-exploratie. Ann Sur. 1984; 199(1): 28-30.
10. Saggi BH, Sugerman HJ, Ivatury RR, et al. Buikcompartimentsyndroom. J Trauma. 1998;45(3):597-609.
11. Kirpatrick AW, Roberts DJ, De Waele JD, et al. Intra-abdominale hypertensie en het abdominaal compartimentsyndroom: bijgewerkte concensus-definities en klinische praktijkrichtlijnen van de World Society of the Abdominal compartimentsyndroom. Intensive Care Med. 2013;39(7):1190-206.
12. Ouellet JF, Leppaniemi A, Ball CG, et al. Alternatieven voor formele abdominale decompressie. Am Sur. 2011; 77(Sl): S51-7.
13. De Waele JJ, Hoste EA, Malbrain ML. Decompressieve laparotomie voor abdominaal compartiment syndroom-een kritische analyse. Crit Zorg. 2006; 10 (2):R51.