Inleiding
Kruppel-achtige factor 4 (KLF4) is een lid van de familie van zink-vinger transcriptiefactor,die wordt uitgedrukt in verschillende menselijke weefsels. Het is goed gekend als één van de vier factoren van de inductie aan pluripotent stamcellen (iPSCs) (Ghaleb en Yang, 2017). KLF4 kan meerdere belangrijke biologische processen zoals neuroinflammation, oxidatieve stress, proliferatie, differentiatie, en apoptosis regelen (Kaushik et al., 2010; Mamonkin et al., 2013; Zhang et al., 2015; Miao et al., 2017; Xu et al., 2017). De hoeveelheden van eerdere studies richtten zich op de rol van KLF4 in de ontwikkeling en progressie van kanker (Karam et al., 2017; Yadav et al., 2018). KLF4 is een dubbel-functie transcriptiefactor, die zijn rol als oncogeen of een tumorontstoringsgen afhankelijk van het kankertype of kankerstadium kan uitoefenen (Evans en Liu, 2008). Het kan transcriptie van genen die betrokken zijn bij celproliferatie, differentiatie en apoptose activeren of remmen (Ding et al., 2015). KLF4 kan samenwerken met andere herprogrammerende factoren om de somatische cellen om te zetten in iPSCs en de differentiatie van stamcellen te remmen (Takahashi and Yamanaka, 2006; van Schaijik et al ., 2018). Dit biedt therapeutische vooruitzichten voor vaatziekten, immuunziekten, anorexia en andere ziekten (Imbernon et al., 2014; Liu Y. et al., 2015; Murgai et al., 2017). Bovendien kan KLF4 een grote regelgevende rol spelen in het centrale zenuwstelsel (CZS). Verscheidene studies tonen aan dat KLF4 verbonden is met meerdere neurologische wanorde, met inbegrip van de ziekte van Alzheimer (AD), epilepsie, ziekte van Parkinson, hydrocefalie en schizofrenie (Qin et al., 2011; Xie et al., 2013; Han et al., 2015; Nishiguchi et al., 2015; Li L. et al., 2017).
AD is een van de meest voorkomende chronische neurodegeneratieve ziekten, die leiden tot cognitieve en geheugenstoornissen, verschillende mentale symptomen en gedragsafwijkingen en progressieve dementie is het meest voorkomende klinische kenmerk (Jiang et al., 2018). De huidige bevestigde pathogene factoren van AD omvatten de vorming van seniele plaques die door abnormale amyloid-β (Aß) depositie worden veroorzaakt en de neurofibrillary klitten of dystrofische neuritis die door Tau-accumulatie worden veroorzaakt (Querfurth en LaFerla, 2010; Shinohara et al., 2014). Bovendien kan de advertentie ook door genetische factoren worden beà nvloed. Echter, de elicit pathogenese is nog steeds onduidelijk. De meest voorkomende drugs voor ADVERTENTIEBEHANDELING omvatten neurotransmitterversterkers, anti-Amyloid agenten, neuroprotective peptides, en andere drugs (Cacabelos, 2018). Met name, hebben verscheidene studies aangetoond dat KLF4 een significante rol in de pathogenese van advertentie speelde. In dit overzicht, richten we ons op de regulerende rol van KLF4 in neuroinflammation, neuronale apoptosis, axonale regeneratie, en ijzeraccumulatie om de associatie tussen KLF4 en de pathogenese van AD te verklaren, die inzicht in de cellulaire en moleculaire mechanismen van neurodegenerative wanorde zou kunnen verstrekken.
de biologische kenmerken van KLF4
KLF4 is een zinkvinger-bevattend kerneiwit, geïsoleerd uit de NIH 3T3-bibliotheek en gelokaliseerd in de celkern. Het werd eerst geïdentificeerd en gekenmerkt door Shields et al. (1996). De molecuulmassa van menselijke KLF4 is 55kD en het wordt gevestigd op chromosoom 9q31. KLF4 behandelt een 6.3 kb gensegment en heeft vijf exons. Het cDNA codeergebied codeert een polypeptide dat bestaat uit 470 aminozuurresiduen (Yet et al., 1998; Ghaleb and Yang, 2017). Het carboxy-eindpunt van KLF4 heeft een gebied van de de bandstructuur van DNA dat drie Cys2His2 (C2H2) de vingerstructuren van het typezink bevat, die door 81 hoogst behouden aminozuren worden gevormd. Het reguleert transcriptie door hoge affiniteit met CACCC-elementen en GC-rijke DNA-sequenties van doelgen (Shields and Yang, 1998; Pearson et al., 2008). De meeste van de DNA-bindende sites van KLF4 zijn gelegen binnen de zink-vinger regio, met inbegrip van N-terminal transcriptie activering domein voor eiwitten interactie, C-terminal zink-vinger-structuur van DNA bindend en transcriptie remming zone (Bieker, 2001). KLF4 is betrokken bij het reguleren van de expressie van vele endogene genen (Shields and Yang, 1998). Er is een hoogst veranderlijk transcriptional regelgevend domein bij het aminoeindpunt van KLF4. De aminozuurresiduen die tussen 91 en 117 amino worden gevestigd vormen een transcriptional activeringsdomein, dat in proline en serine rijk is, terwijl een transcriptional onderdrukkingsdomein ook bestaat. Daarom heeft KLF4 twee nadelige gevolgen: activerende en remmende gentranscriptie (nog et al., 1998; Wei et al., 2006).
tijdens de embryonale ontwikkeling werd KLF4 hoger uitgedrukt in het late stadium van de embryonale ontwikkeling. Terwijl in volwassen weefsels en organen, KLF4 wordt voornamelijk uitgedrukt in het maag-darmkanaal, mondholte, huidepidermis, vasculair endotheel en nieren, en is minder uitgedrukt in de hersenen (Segre et al., 1999; Ghaleb et al., 2011; Liu et al., 2013; Chen et al., 2015; He et al., 2015; Bin et al., 2016). Het wordt verondersteld om significante rol in het regelen van celproliferatie en differentiatie te spelen. Bovendien, kan KLF4 celcyclus ook regelen. KLF4 kan P21 activeren op een p53-afhankelijke manier (Zhang et al., 2000). Bovendien werd gevonden dat KLF4 (–/–) cellen senescentiefase eerder dan klf4 (+/+) cellen ingingen, die door de minder antioxidant genuitdrukking en het hogere reactieve niveau van zuurstofspecies (ROS) in KLF4 (–/–) cellen kan worden verklaard. ROS kan de expressie van p53 en p21 verhogen en vervolgens de DNA-schade bevorderen (Liu C. et al., 2015). Men vond dat PRMT5 de klf4 uitdrukking in eiwitniveaus kan opheffen. Van PRMT5 werd gemeld dat het de transcriptie van p21 verhoogt en de expressie van bax vermindert via het remmen van KLF4 ubiquitylation (Hu et al., 2015). Bovendien hebben talrijke studies aangetoond dat KLF4 betrokken is bij de regulering van apoptose van neuronen (Kong et al., 2016; Cui et al., 2017; Song et al., 2018). Fysiologische regulerende rol van KLF4 die we hebben geweten zijn nog steeds weinig en verder onderzoek nodig zijn.
rol van KLF4 in AD
het is duidelijk dat AD voornamelijk wordt gekenmerkt door geheugen-en cognitieve stoornissen en executieve disfunctie (Goedert and Spillantini, 2006). Veel studies hebben aangetoond dat neuronale apoptose en synaptische dysfunctie pathologische basis van de afname van de cognitieve functie (Caccamo et al., 2017; Guo et al., 2017; Yoon et al., 2018). De geaccumuleerde schade van Aß depositie, oxidatieve spanning en ijzeraccumulatie kan tot neuronale dysfunctie en apoptosis van AD patiënten leiden. Verscheidene studies hebben aangetoond dat de regelgevende rol van KLF4 essentieel in CNS schijnt te zijn. Gezien het feit dat KLF4 werd gemeld om neuronale apoptose, synaptische regeneratie, oxidatieve stress en neuroinflammation te reguleren, kan de relatie tussen KLF4 en de pathogenese van AD een potentieel nieuw doelwit voor AD behandeling zijn.
rol van KLF4 bij Neuroinflammatie
uit klinische studies is gebleken dat Aß de extracellulaire afzettingen van het hersenweefsel van AD-patiënten kan aggregeren en de belangrijkste component is, wat de omringende synapsen en neuronen kan aantasten en tot neuronale dood kan leiden. Abnormale secretie of overmatige productie van Aß leidt tot pathologische veranderingen van AD, dus Aß depositie is de kernverbinding van AD (Rajmohan and Reddy, 2017). Bovendien hebben studies aangetoond dat overmatige Aß depositie gliacellen kan stimuleren om ROS en andere beïnvloedende factoren af te scheiden, wat leidt tot oxidatieve stress. Het was bekend dat oxidatieve stress de productie van Aß kan stimuleren. Daarom kunnen Aß en oxidatieve stress met elkaar interageren en de progressie van AD beïnvloeden (Cheignon et al., 2018).
KLF4 werd gerapporteerd als een potentiële modulator en heeft een groot effect op ontstekingen door macrofagen en endotheelcellen te mediëren (figuur 1) (Yoshida et al., 2014; Kapoor et al., 2015; Yang et al., 2018). In het CZS kunnen overmatige en chronische ontstekingsreacties schade aan neuron en neurogliocyte veroorzaken. Onlangs werd aangetoond dat de klf4-expressie positief correleerde met aß42-geïnduceerde neuroinflammation. In microgliale BV2 cellen, oligomere aß42 kan verhogen klf4 expressie, die wordt bemiddeld door geactiveerde P53 (Li L. et al., 2017). Onder ontstekingsvoorwaarden, zoals Aß-accumulatie, kan de versie van pro-inflammatoire cytokines in de generatie van ADVERTENTIE worden bevorderd (Griffin en Barger, 2010). Neurotoxiciteit potentie en pro-inflammatoire potentie van oplosbare aß42 oligomeren is relatief hoger dan onoplosbare vezel deposito (Selkoe, 1991; Weinberg et al., 2018). Stilte van KLF4 kan aß42-gemedieerde neuroinflammation herstellen, en overexpressie van KLF4 kan aß42-gemedieerde neuroinflammation verergeren (Li L. et al., 2017). Aß accumulatie induceert activering van astrocyten en microglia (Rodríguez et al., 2016). Geactiveerde astrocyten kunnen de neuroinflammation verbeteren door pro-inflammatoire factoren zoals IL-1, IL-6, en TNF-α vrij te geven (Rubio-Perez and Morillas-Ruiz, 2012; Doméné et al., 2016). De vicieuze cyclus van ontstekingsreacties leidt uiteindelijk tot dysfunctie en neuronale apoptose.
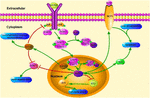
FIGUUR 1. Schematische illustratie van klf4 gerelateerde signalerende wegen. Deze figuur benadrukt de rol van KLF4 in neuroprotectie en Axon regeneratie. De pijlen in de figuur geven activering of promotie aan, en de rechte lijnen geven gerelateerde remming aan. KLF4, Kruppel-achtige factor 4; STAT3, Signaaltransducer en activator van transcriptie 3; JAK, Janus Kinase; SOCS3, Suppressor van cytokine signalerend 3; HCP1, heme dragereiwit 1; ERK5, mitogen-geactiveerde eiwitkinase 5.
KLF4 speelt een cruciale rol in het reguleren van pro-inflammatoire signalen. In gliacellen, verhoogt gemfibrozil-veroorzaakte klf4 activering suppressor van cytokine signaal 3 (SOCS3) via pi3-kinase-AKT weg (Ghosh en Pahan, 2012). De door SiRNA gemedieerde knockdown van KLF4 kan het niveau van SOC ‘ s in astroglia en microglia bij muizen verminderen, wat vervolgens de expressie van het ontstekingsgen kan beïnvloeden (Kaushik et al., 2010; Ghosh and Pahan, 2012). Bovendien kan SoCs-schrapping de overleving van gewonde neuronen bevorderen en Axon-regeneratie bevorderen (Smith et al., 2009; Sun et al., 2011). En KLF4 reguleert positief de productie van IL-1β of andere pro-inflammatoire markers. Het reguleert cyclo-oxygenase-2 (Cox-2) positief en reguleert induceerbaar stikstofmonoxide synthase (Inos) negatief (Kaushik et al., 2013). Bovendien is KLF4 een belangrijke regulerende factor voor monocyte differentiatie en een potentieel doelwit voor immuunregulatie (Alder et al., 2008). Daarom zou KLF4 neuroinflammation kunnen bevorderen door deze negatieve regelgevers te reguleren.Het is vermeldenswaard dat in het Parkinson ‘ s disease model, KLF4 MPP+-geïnduceerde oxidatieve stress en neurotoxiciteit kan bevorderen, en vervolgens neuronale apoptose kan verhogen en de celproliferatie kan vertragen (Chen et al., 2013). Oxidatieve stress is een onbalans tussen peroxidatie en antioxidatie. Vrije radicalen kunnen veranderingen in verschillende macromoleculen veroorzaken, wat leidt tot celschade, celveroudering en weefselschade (Parajuli et al., 2013; nie et al., 2015). Oxidatieve stress kan verergeren vroege ontsteking en Aß productie en dan verergeren AD (Cai et al., 2011). Daarom kan KLF4 bij oxidatieve spanning in advertentie betrokken zijn.
deze bevindingen impliceren dat KLF4 een sleutelrol speelt bij het mediëren van neuroinflammation door het activeren van de microglia en de daaruit voortvloeiende afgifte van pro-inflammatoire cytokines. Het heeft potentieel om neuroinflammation te verbeteren. Tot nu toe, hebben vele studies over de pathogenese van advertentie zich op neuroinflammation geconcentreerd. Als potentieel doel voor immune regelgeving, kan KLF4 de ontstekingsreacties van microglia via beà nvloeden verwante negatieve regelgevers bevorderen, die een groot effect op de ontwikkeling van advertentie heeft.De rol van KLF4 bij apoptose
neurodegeneratieve veranderingen omvatten geleidelijk verlies van neuronen en synapsen in de representatieve hersengebieden, zoals de hersenschors, hippocampus en andere subcorticale gebieden. De functionele stoornissen van het CZS veroorzaakt door neuronaal verlies zijn permanent (Citron, 2010). Aanhoudende oxidatieve stress kan leiden tot neuronale apoptose (Wu et al., 2010). Een groot aantal studies hebben bevestigd dat AD nauw verwant is aan oxidatieve stress (Lee et al., 2012; Yui et al., 2015). Het bleek dat chronische oxidatieve stress de expressie van fosfolipase A2 groep 3 (Pla2g3) in astrocyten kan verbeteren en de balans van Aß kan verstoren, en bijgevolg kan leiden tot de ontwikkeling van AD (Yui et al., 2015).Vele studies hebben aangetoond dat KLF4 een belangrijke rol speelt bij het remmen van de ontwikkeling van oxidatieve stress (Shi et al., 2014; Liu C. et al., 2015). Men vond dat KLF4 de cellen apoptosis kan bevorderen die door H2O2 wordt veroorzaakt, wordt deze actie waarschijnlijk veroorzaakt door verhoogde Bax uitdrukking en verminderde Bcl-2 uitdrukking (Li et al., 2010). Quercetine kon klf4 uitdrukking in menselijke neuroblastoma sh-SY5Y cellen verminderen, en de uitdrukking van Bcl-2/bax verhouding verhogen. Bovendien kan quercetine de apoptose van SH-5YSY-cel matigen en de caspase-3-enzymactiviteit verminderen (Xi et al., 2012). Een recente studie onderzocht het neuroprotectieve effect van mitogen-geactiveerd eiwit (MAP) kinase 5 (ERK5) tegen oxidatieve stress. Activering van ERK5 kan de H2O2-geïnduceerde hippocampale neuronendood gedeeltelijk verminderen en de NGF-en PC-geïnduceerde neuroprotectie verhogen (su et al., 2014). Nils et al. gebruikte een mutant van MEK5 (MEK5D) om de erk5-geactiveerde transcriptie en functionele reacties in menselijke endothelial cellen te bestuderen, en geà dentificeerde KLF4 was een nieuw downstream erk5 doel (Ohnesorge et al., 2010). Men vond dat overexpressie van KLF4 TNF-gemedieerde ontstekingsreacties kan onderdrukken en leukocytenadhesie en basale celapoptosis kan verminderen. Deze resultaten bevestigen dat KLF4 ontstekingsremmende en anti-apoptotische eigenschappen heeft (Ohnesorge et al., 2010). Latere experimenten hebben aangetoond dat het verdwijnen van cerebrale caverneuze malformatie 1 (CCM1) in endotheelcellen erk5 activeert via MEKK3-MEK5 signaalweg en KLF4 expressie verhoogt (Cuttano et al., 2016). ERK5 speelt een bemiddelende rol in preconditionering (PC) en zenuwgroeifactor (NGF) die de expressie van KLF4 (Su et al., 2014). Bovendien kan RNAi-bemiddelde het neerhalen van KLF4 NGF – of PC-veroorzaakte neuroprotection ook verminderen. Overexpressie van KLF4 leidt tot hogere Bcl-2/bax ratio in H2O2-gestresste cellen (su et al., 2014). Over-uitgedrukte KLF4 versnelt veranderingen in bcl-2 en bax door te combineren met de bijbehorende promotor (Li et al., 2010). Erk5 / KLF4 cascade kan fungeren als een spil in verschillende routes die neuronen beschermen tegen oxidatieve stress-geïnduceerde dood (su et al., 2014).Oxidatieve stress wordt beschouwd als een nauw verband met vele degeneratieve ziekten. KLF4 speelt significante rollen in het handhaven van genomic stabiliteit in oxydatieve spanning. KLF4 en ERK5 werken samen om neuronen te beschermen tegen oxidatieve stress-geïnduceerde apoptose. Daarom kan KLF4 als therapeutisch doel dienen om tegen oxidatieve stress te handelen wanneer het geactiveerd wordt. Men heeft gemeld dat statinedrugs ERK5 kunnen activeren, leidend tot de uitdrukking van KLF4 en zijn afhankelijke genen (Ohnesorge et al., 2010), maar het mechanisme blijft onduidelijk, en KLF4 verwante upstream en downstream doelgenen worden minder bestudeerd in oxidatieve spanning, is er een behoefte aan verdere studie.
rol van KLF4 bij Axon-regeneratie
vroeg Axon-verlies is een veel voorkomend kenmerk van neurodegeneratieve ziekten. Synaptisch verlies en transportstoornis in AD kan cognitieve stoornissen veroorzaken (Holtzman et al., 2011; Coleman, 2013). De mate van declaratieve geheugenschade is gerelateerd aan de synaptische dichtheid in de hippocampus en cortex. Oplosbare Aß-oligomeren verminderen de opname van glutamaat en bevorderen synaptische dysfunctie, waardoor synaptische plasticiteit wordt verstoord (Li et al., 2009). Daarom is het bijzonder belangrijk om te bestuderen hoe de axonen in het CZS kunnen worden hersteld. In retinale ganglioncellen hebben axonen een sterk vermogen om te groeien en te regenereren tijdens de vroege ontwikkeling, maar in het CNS van volwassen zoogdieren verliezen axonen hun regeneratiecapaciteit en kunnen de neuronen afstuderen om te sterven of atrofie (Goldberg and Barres, 2000; Goldberg et al., 2002).
KLF4 speelt een belangrijke rol bij het remmen van de Axon-groei. In embryonale RGCs, kan de overexpressie van KLF4 het percentage van neurietverlenging, de lengte van axons en dendrites, en het neuriet vertakking verminderen. Bovendien werd vastgesteld dat de overexpressie van KLF4 de postnatale groeicijfers van axon op lange termijn kan verminderen, maar de groeicijfers van axon op korte termijn niet kan verminderen (Moore et al., 2009; Steketee et al., 2014). Latere studies hebben aangetoond dat de Axon bundels van KLF4-cKO muizen dikker waren dan controle muizen (Fang et al., 2016). Bovendien kan de verwijdering van klf4-expressie tijdens de ontwikkeling het voortplantingspotentieel van volwassen RGC ‘ s verhogen. Bovendien had KLF4 zonder het C-terminale DNA-bindingsdomein geen effect op de Axon-groei. Er was geen invloed op de overleving van cellen nadat netvliescellen gewond waren geraakt als de KLF4 knock-out was (Moore et al., 2009).
KLF4 kan ook de axonale regeneratie beïnvloeden. Een recente studie meldde dat de afname van KLF4-expressie in volwassen retinale ganglioncellen Axon-regeneratie bevorderde via de Jak-STAT3-route (Qin et al., 2013). KLF4 verhoogde phosphorylation van STAT3, en regelde de Axon groei via jak-STAT signaleren (Qin en Zhang, 2012). Onder de behandeling van cytokines, zijn de leden van STAT familie van proteã nen phosphorylated bij de carboxy-eindtyrosine en serine plaatsen binnen de cel om een stabiel dimeer te vormen. Deze wijziging verbetert de transcriptie van cel-geassocieerde genen (Yuan et al., 2005). De interactie tussen KLF4 en STAT3 op cytokine-geïnduceerde fosforylering van tyrosin705 remt de expressie van STAT3 door de binding van STAT3 aan DNA te remmen (Qin et al., 2013). Klf4 knockdown verbetert duidelijk de regeneratie van Axon in retinale ganglioncellen na verwonding van de oogzenuw, en voorkomt de zenuw van verwonding na mild hersenletsel. De acties worden gemedieerd door een afname van p-p53 en een toename van pstat3 niveaus. KLF4 reguleert positief neuronale apoptose via de p53 en jak-STAT3 wegen, en KLF4 reguleert negatief axonale reparatie via de Jak-STAT3 weg (cui et al., 2017).
daarom werd verondersteld dat in AD axonale regeneratie kan worden bereikt door de expressie van KLF4 te veranderen of intracellulaire gerelateerde signaalwegen te veranderen, en de progressie van AD te controleren door ontbrekende axonen te verminderen of axonale disfunctie te verminderen. Nochtans, hoe te om de transcriptiefactor van KLF4 in potentiële therapeutiek te gebruiken vergt nog verdere exploratie.
rol van KLF4 in Ijzeraccumulatie
ijzer wordt op grote schaal aangetroffen in biologische systemen, ijzergerelateerde metalloproteïnasen spelen een sleutelrol bij het transport van zuurstof, het overbrengen van elektronen en het katalyseren van biochemische reacties (Aisen et al., 2001). Een overmaat aan ijzer buiten het normale fysiologische bereik kan echter de menselijke gezondheid schaden (Adlard and Bush, 2006). Studies hebben aangetoond dat ijzergehalte in de hippocampus negatief gecorreleerd is met de uitvoering van geheugentests (Ding et al., 2009). Verhoogde ijzerbelasting in de hersenen versnelt de vorming van Aß plaques en hyperfosforylated Tau klitten, terwijl ook het verbeteren van oxidatieve stress (Peters et al., 2015). Ijzer, dat een hoge mate van permeabiliteit heeft, bevordert zenuwgroei en cel-naar-cel verbindingen tijdens de ontwikkeling van de hersenen (Dallman and Spirito, 1977).Een recente studie toonde aan dat fysiologische stress de activering van de klf4-HCP1 signaalweg veroorzaakte en verhoogde heme opname (Li H. et al., 2017). Heme is goed voor 95% van het functionele ijzer in het menselijk lichaam. Het is een van de belangrijkste componenten van heme oxygenase (Hooda et al., 2014; Kurucz et al., 2018). Het verhogen van de activiteit van oxygenase-1 kan de oxidatie van de verouderende hersenen vertragen (Verdile et al., 2015; Serini and Calviello, 2016; Kurucz et al., 2018). Dit heeft een verlichting effect op AD. Fysiologische stress veroorzaakt een stijging van het glucocorticoïdenpeil, glucocorticoïdenpeil verhoogt de expressie van heme carrier protein 1 (HCP1) via KLF4 en HCP1 bevordert vervolgens de opname van heme (Li H. et al., 2017). Glucocorticoïd en KLF4 regelen ontstekingsremmende genen samen, en cellen met een laag glucocorticoïdgehalte kunnen KLF4-expressie niet volledig induceren (Sevilla et al., 2015). KLF4-geïnduceerde toename van heme-inname leidt tot ijzeraccumulatie in de hersenen. Ijzer bevordert de afgifte van ROS (Tronel et al., 2013). Ijzer element verbetert hersenen oxidatieve stress bij ratten onder psychologische stress (Yu et al., 2011). Daarom kan HCP1 samen gereguleerd worden door KLF4 en glucocorticoïd. Het verhogen van HCP1 verhoogt de opname van heme, wat direct leidt tot ijzerophoping in de hersenen, verergert oxidatie, verhoogt apoptose of disfunctie en verergert hersenbeschadiging.
algemeen wordt aangenomen dat geheugen-en leerstoornissen de belangrijkste symptomen van AD zijn. Een groot aantal klinische gegevens hebben aangetoond dat Aß plaque belasting en ijzer accumulatie reactie op de ontwikkeling van het leren en cognitieve dysfunctie in AD (van Bergen et al., 2018). Onlangs gepubliceerde gegevens hebben gesuggereerd dat, hoge-dosis ijzer verhoogt Aß depositie en verzwakt het leren en het geheugen in muizen (Guo et al., 2013). Klinische studies hebben aangetoond dat ijzerhoudende microglia wordt gevonden in de hippocampus van AD patiënten onder magnetic resonance imaging (zeineh et al., 2015). Microglia verwerft ijzer uit overbrengende of niet-overbrengende, extracellulaire en intracellulaire bronnen (McCarthy et al., 2018). Selectieve en aanhoudende klf4 expressie kan worden geïnduceerd in de kern en cytoplasma van ischemische hippocampale reactieve astrocyten (Park et al., 2014). De Studies hebben aangetoond dat KLF4 als transcriptional repressor dienst doet. Het down-reguleert de expressie van ELK-3, en dan elk-3 remt de expressie van HO-1 (Tsoi et al., 2015). Heme oxygenase-1 (HO-1) is een stress-eiwit dat heme afbreekt tot bilirubine, vrij ijzer en koolmonoxide. Up-regulatie van HO – 1 in astrocyten kan leiden tot abnormale ijzerdepositie en mitochondriale disfunctie in de hersenen, wat leidt tot verminderde cognitieve capaciteit (Schipper, 1999, 2004). Daarom kan KLF4 betrokken zijn bij het proces van ijzeraccumulatie in astrocyten, waardoor oxidatie in AD verergert en hersenbeschadiging verergert.
conclusie
het is algemeen bekend dat KLF4 een centrale rol speelt bij het reguleren van celproliferatie, apoptose en differentiatie. Eerdere studies hebben zich gericht op de regulering van KLF4 in verschillende belangrijke neurofysiologische processen, waaronder neuroinflammation, neuroprotection en synaptische regeneratie. Onlangs, is KLF4 gevonden om een belangrijke rol in de pathogenese van advertentie te spelen. In dit artikel, bespreken wij de rol van KLF4 in neuroprotection en neurogenesis in advertentie.
KLF4 is niet alleen een regulator van de regulatie van celproliferatie en-differentiatie, maar ook een potentieel doelwit voor het reguleren van immuunresponsen. KLF4 kan negatieve ontstekingsfactoren regelen en ontstekingsreactie bevorderen, en een groot effect hebben op de expressie van astrocyte nucleaire microglia. Bovendien kunnen KLF4 en ERK5 samenwerken om neuroprotectieve acties uit te oefenen. Voorts kan de regeneratie van axon door de inhoud van specifieke transcriptiefactoren, intracellular inhibitors, of het veranderen van intracellular signalerende wegen worden bereikt. Het uitschakelen van KLF4 kan de Axon-regeneratie verbeteren en de Axon-groeisnelheid versnellen. Vermindering van klf4-expressie bevordert de regeneratie van axon via de Jak-STAT3-route en KLF4 bevordert de Jak-STAT3-route naar verdere Axon-regeneratie. Daarom kan KLF4 betrokken zijn bij het proces van anti-inflammatoire, anti-apoptose, Axon-regeneratie en ijzeraccumulatie in het CZS, dat een centrale rol speelt bij de ADVERTENTIEGENERATIE. Deze bevindingen suggereren dat KLF4 een potentieel therapeutisch doel voor AD vertegenwoordigt. Nochtans, blijven de diepe cellulaire en moleculaire mechanismen van de gevolgen van KLF4 op Advertentie onduidelijk en zijn verder onderzoek nodig.
Auteursbijdragen
ZQC, XHZ en YJ schreven het manuscript. SHG en JYL wijzigden het kader van het manuscript. BJL en RJC zorgden voor de kritische herzieningen. Alle auteurs hebben de definitieve versie van het manuscript goedgekeurd.
financiering
dit werk werd ondersteund door subsidies van de Natural Science Foundation of China (NSFC) (81871070, 31571126, 31471120) en Jilin Science and Technology Agency funding (subsidie nrs. 20180519003JH, 20180414051GH, 20170414034GH en 20180414050GH).
verklaring inzake belangenconflicten
de auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.
Cacabelos, R. (2018). Zijn er verbeteringen in de ziekte van Alzheimer drug discovery in de afgelopen 5 jaar. Exp. Opin. Drug Discov. 13, 523–538. doi: 10.1080/17460441.2018.1457645
PubMed Abstract / CrossRef Full Text / Google Scholar
Liu, Y., Shi, J., and Chen, X. (2015). Identificatie van nieuwe targets voor seizoengebonden allergische rhinitis tijdens en buiten het pollenseizoen door microarray analyse. Acta Otolaryngol. 135, 1330–1336. doi: 10.3109 / 00016489.2015.1067906
PubMed Abstract / CrossRef Full Text / Google Scholar
Serini, S., and Calviello, G. (2016). Vermindering van oxidatieve / nitrosatieve stress in de hersenen en zijn betrokkenheid bij het neuroprotectieve effect van n-3 PUFA bij de ziekte van Alzheimer. Curr. Alzheimer Res. 13, 123-134. doi: 10.2174/1567205012666150921101147
PubMed Abstract / CrossRef Full Text / Google Scholar