Generieke naam: natriumpolystyreensulfonaat
doseringsvorm: oraal, rectaal poeder
medisch beoordeeld door Drugs.com. laatst bijgewerkt op 21 Sep 2020.
- Overzicht
- bijwerkingen
- Dosering
- Professionele
- Interactions
- Meer
- Kalexate Poeder Beschrijving
- Kalexaatpoeder-Klinische Farmacologie
- indicaties en gebruik voor Kalexaatpoeder
- contra-indicaties
- voorzorgsmaatregelen
- geneesmiddelinteracties
- moeders die borstvoeding geven
- pediatrisch gebruik
- bijwerkingen
- overdosering
- Kalexaatpoeder dosering en toediening
- Hoe wordt Kalexaatpoeder geleverd
- VERPAKKINGSETIKET.Hoofdscherm
- meer over Kalexaat (natriumpolystyreensulfonaat))
- Consument resources
- Professional resources
- behandeling in Verband met gidsen
Kalexate Poeder Beschrijving
Natrium Polystyreen Sulfonaat, USP, is een benzeen, diethenyl-polymeer, met ethenylbenzene, sulfonated, sodium salt en heeft de volgende structuurformule:
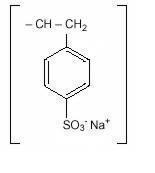
De drug is een crème tot lichtbruin fijn gemalen poeder vorm van natrium polystyreen sulfonaat, een kation-uitwisseling hars opgesteld in de natrium-fase met een in vitro exchange capaciteit van ongeveer 3.1 meq (in vivo ongeveer 1 meq) kalium per gram. Het natriumgehalte is ongeveer 100 mg (4,1 mEq) per gram van het geneesmiddel. Het kan oraal of in een klysma worden toegediend.
Kalexaatpoeder-Klinische Farmacologie
naarmate de hars door de darm gaat of na toediening door klysma in de dikke darm wordt vastgehouden, komen de natriumionen gedeeltelijk vrij en worden ze vervangen door kaliumionen. Voor het grootste deel vindt deze actie plaats in de dikke darm, die kaliumionen in grotere mate uitscheiden dan de dunne darm. De efficiëntie van dit proces is beperkt en onvoorspelbaar variabel. Het benadert gewoonlijk de Orde van 33 percenten maar het bereik is zo groot dat definitieve indices van elektrolytenbalans duidelijk moeten worden gecontroleerd.Metabole gegevens zijn niet beschikbaar.
indicaties en gebruik voor Kalexaatpoeder
Natriumpolystyreensulfonaat is USP geïndiceerd voor de behandeling van hyperkaliëmie.
contra-indicaties
Natriumpolystyreensulfonaat, USP is gecontra-indiceerd onder de volgende aandoeningen: patiënten met hypokaliëmie, patiënten met een voorgeschiedenis van overgevoeligheid voor polystyreensulfonaatharsen, obstructieve darmziekte, pasgeborenen met verminderde darmmotiliteit (postoperatief of geneesmiddelgeïnduceerd) en orale toediening bij pasgeborenen (zie voorzorgsmaatregelen).Intestinale necrose: gevallen van intestinale necrose, die fataal kan zijn, en andere ernstige gastro-intestinale bijwerkingen (bloeding, ischemische colitis, perforatie) zijn gemeld in samenhang met Natriumpolystyreensulfonaat, USP-gebruik. De meeste van deze gevallen meldden gelijktijdig gebruik van sorbitol. In veel van de gevallen waren risicofactoren voor gastro-intestinale bijwerkingen aanwezig, waaronder prematuriteit, voorgeschiedenis van intestinale ziekte of chirurgie, hypovolemie en nierinsufficiëntie en nierfalen. Gelijktijdige toediening van sorbitol wordt niet aanbevolen (zie voorzorgsmaatregelen, geneesmiddelinteracties).
* alleen gebruiken bij patiënten met een normale darmfunctie. Vermijd het gebruik bij patiënten die na de operatie geen stoelgang hebben gehad.
• vermijd het gebruik bij patiënten met een risico op het ontwikkelen van constipatie of impactie (inclusief patiënten met een voorgeschiedenis van impactie, chronische constipatie, inflammatoire darmziekte, ischemische colitis, vasculaire intestinale atherosclerose, eerdere darmresectie of darmobstructie).
• stop het gebruik bij patiënten die constipatie ontwikkelen.
alternatieve therapie bij ernstige hyperkaliëmie
aangezien een effectieve verlaging van het serumkalium met Natriumpolystyreensulfonaat, USP uren tot dagen kan duren, kan de behandeling met dit geneesmiddel alleen onvoldoende zijn om ernstige hyperkaliëmie snel te corrigeren geassocieerd met staten van snelle weefselafbraak (bijv. brandwonden en nierfalen) of hyperkaliëmie die zo gemarkeerd is dat het een medische noodsituatie vormt. Daarom moeten andere definitieve maatregelen, waaronder dialyse, altijd worden overwogen en kunnen deze noodzakelijk zijn.
hypokaliëmie
ernstige kaliumdeficiëntie kan optreden na behandeling met Natriumpolystyreensulfonaat, USP. Het effect moet zorgvuldig worden gecontroleerd door frequente serumkaliumbepalingen binnen elke periode van 24 uur. Aangezien intracellulaire kaliumdeficiëntie niet altijd wordt weerspiegeld in serumkaliumspiegels, moet het niveau waarop de behandeling met Natriumpolystyreensulfonaat, USP moet worden gestaakt, voor elke patiënt afzonderlijk worden bepaald. Belangrijke hulpmiddelen bij het maken van deze bepaling zijn de klinische toestand van de patiënt en elektrocardiogram. Vroege klinische tekenen van ernstige hypokaliëmie omvatten een patroon van prikkelbare verwarring en vertraagde denkprocessen.Elektrocardiografisch wordt ernstige hypokaliëmie vaak geassocieerd met een verlengd Q-T-interval, verbreding, afvlakking of inversie van de T-golf en prominente u-golven. Ook kan hartritmestoornissen optreden, zoals premature atriale, nodale en ventriculaire contracties, en supraventriculaire en ventriculaire tachycardie. De toxische effecten van digitalis zijn waarschijnlijk overdreven. Uitgesproken hypokaliëmie kan ook worden gemanifesteerd door ernstige spierzwakte, soms tot openhartige verlamming.
elektrolytverstoringen
zoals alle kationenuitwisselingsharsen, Natriumpolystyreensulfonaat, is USP niet volledig selectief (voor kalium) in zijn werking en kunnen ook kleine hoeveelheden andere kationen zoals magnesium en calcium tijdens de behandeling verloren gaan. Dienovereenkomstig moet bij patiënten die Natriumpolystyreensulfonaat krijgen, USP worden gecontroleerd op alle van toepassing zijnde elektrolytverstoringen.
systemische alkalose
systemische alkalose is gemeld na orale toediening van kationenuitwisselende harsen in combinatie met niet-absorbeerbare kationdonerende antacida en laxeermiddelen zoals magnesiumhydroxide en aluminiumcarbonaat. Magnesiumhydroxide mag niet worden toegediend met Natriumpolystyreensulfonaat, USP. Eén geval van grand mal-aanvallen is gemeld bij een patiënt met chronische hypocalciëmie van nierfalen die Natriumpolystyreensulfonaat, USP met magnesiumhydroxide als laxeermiddel kreeg. (Zie voorzorgsmaatregelen, geneesmiddelinteracties.)
voorzorgsmaatregelen
voorzichtigheid is geboden wanneer NATRIUMPOLYSTYREENSULFONAAT, USP wordt toegediend aan patiënten die zelfs geen kleine toename van de natriumbelasting verdragen (d.w.z. ernstig congestief hartfalen, ernstige hypertensie of uitgesproken oedeem). In dergelijke gevallen kan een compenserende beperking van de natriumopname uit andere bronnen worden aangegeven.
in geval van klinisch significante constipatie dient de behandeling met Natriumpolystyreensulfonaat, USP te worden gestaakt totdat de normale stoelgang is hervat (zie waarschuwingen, intestinale necrose).
geneesmiddelinteracties
antacida
gelijktijdige orale toediening van Natriumpolystyreensulfonaat, USP met niet-absorbeerbare kation-donerende antacida en laxeermiddelen kan het kaliumuitwisselingsvermogen van de hars verminderen.
niet-absorbeerbare kation-donerende antacida en laxeermiddelen
systemische alkalose is gemeld na orale toediening van kation-exchange harsen in combinatie met niet-absorbeerbare kation-donerende antacida en laxeermiddelen zoals magnesiumhydroxide en aluminiumcarbonaat. Magnesiumhydroxide mag niet worden toegediend met Natriumpolystyreensulfonaat, USP. Eén geval van grand mal-aanvallen is gemeld bij een patiënt met chronische hypocalciëmie van nierfalen die Natriumpolystyreensulfonaat, USP met magnesiumhydroxide als laxeermiddel kreeg.
darmobstructie als gevolg van concreties van aluminiumhydroxide bij gebruik in combinatie met Natriumpolystyreensulfonaat, is USP gemeld.
Digitalis
de toxische effecten van digitalis op het hart, met name verschillende ventriculaire aritmieën en A-V-nodale dissociatie, zullen waarschijnlijk worden versterkt door hypokaliëmie, zelfs bij serumconcentraties digoxine binnen het “normale bereik”. (Zie waarschuwingen).
Sorbitol
gelijktijdig gebruik van Sorbitol met Natriumpolystyreensulfonaat, is USP betrokken bij gevallen van intestinale necrose, die fataal kan zijn. Daarom wordt gelijktijdige toediening niet aanbevolen. (Zie waarschuwingen).
Lithium
Natriumpolystyreensulfonaat, USP kan de absorptie van lithium verminderen.
Thyroxine
Natriumpolystyreensulfonaat, USP kan de absorptie van thyroxine verminderen.
carcinogenese, mutagenese, verminderde vruchtbaarheid
er zijn geen Studies uitgevoerd.
zwangerschapscategorie C
reproductiestudies bij dieren zijn niet uitgevoerd met Natriumpolystyreensulfonaat, USP. Het is ook niet bekend of Natriumpolystyreensulfonaat, USP foetale schade kan veroorzaken bij toediening aan een zwangere vrouw of de reproductiecapaciteit kan beïnvloeden. Natriumpolystyreensulfonaat, USP mag alleen aan een zwangere vrouw worden gegeven als dat duidelijk nodig is.
moeders die borstvoeding geven
het is niet bekend of dit geneesmiddel wordt uitgescheiden in de moedermelk. Omdat veel geneesmiddelen worden uitgescheiden in de moedermelk, moet voorzichtigheid worden betracht wanneer Natriumpolystyreensulfonaat, USP wordt toegediend aan een zogende vrouw.
pediatrisch gebruik
de werkzaamheid van Natriumpolystyreensulfonaat, USP bij pediatrische patiënten is niet vastgesteld. Bij pasgeborenen, Natriumpolystyreensulfonaat, mag USP niet oraal worden toegediend. Bij zowel kinderen als pasgeborenen dient bijzondere voorzichtigheid in acht te worden genomen bij rectale toediening, aangezien een overmatige dosering of inadequate verdunning kan leiden tot impactie van de hars.
vanwege het risico op spijsverteringsbloeding of intestinale necrose moet bijzondere aandacht worden besteed aan prematuren of zuigelingen met een laag geboortegewicht.
bijwerkingen
Natriumpolystyreensulfonaat, USP kan tot op zekere hoogte maagirritatie veroorzaken. Anorexia, misselijkheid, braken en constipatie kunnen optreden, vooral als hoge doses worden gegeven. Ook kunnen hypokaliëmie, hypocalciëmie, hypomagnesiëmie en significante natriumretentie en de daarmee verband houdende klinische manifestaties optreden (zie waarschuwingen). Soms ontwikkelt zich diarree. Grote doses bij ouderen kunnen fecale impactie veroorzaken (zie voorzorgsmaatregelen). Zeldzame gevallen van intestinale necrose zijn gemeld. Intestinale obstructie als gevolg van concreties van aluminiumhydroxide, bij gebruik in combinatie met Natriumpolystyreensulfonaat, USP, is gemeld.
de volgende bijwerkingen zijn gemeld uit postmarketingervaring over de hele wereld:
* fecale impactie na rectale toediening, met name bij kinderen;
* gastro-intestinale concreties (bezoars) na orale toediening;
• ischemische colitis, gastro-intestinale ulceratie of necrose die kan leiden tot intestinale perforatie; en
• zeldzame gevallen van acute bronchitis en/of bronchopneumonie geassocieerd met inhalatie van deeltjes van polystyreensulfonaat.
overdosering
overdosering kan resulteren in elektrolytstoornissen waaronder hypokaliëmie, hypocalciëmie en hypomagnesiëmie .Biochemische stoornissen als gevolg van overdosering kunnen leiden tot klinische tekenen en symptomen van hypokaliëmie, waaronder: prikkelbaarheid, verwardheid, vertraagde denkprocessen, spierzwakte, hyporeflexie, die kan overgaan tot openlijke verlamming en/of apneu. Tetanie kan optreden. Elektrocardiografische veranderingen kunnen consistent zijn met hypokaliëmie of hypercalciëmie; hartritmestoornissen kunnen optreden. Passende maatregelen moeten worden genomen om serumelektrolyten (kalium, calcium, magnesium) te corrigeren en de hars moet uit het spijsverteringskanaal worden verwijderd door het juiste gebruik van laxeermiddelen of klysma ‘ s.
Kalexaatpoeder dosering en toediening
suspensie van dit geneesmiddel dient vers bereid te worden en niet langer dan 24 uur bewaard te worden.
de gemiddelde dagelijkse dosis hars voor volwassenen is 15 g tot 60 g. Dit wordt het best verstrekt door 15 g (ongeveer 4 afgestreken theelepels) Natriumpolystyreensulfonaat toe te dienen, USP één tot vier keer per dag. Eén gram Natriumpolystyreensulfonaat, USP bevat 4,1 mEq natrium; een afgestreken theelepel bevat ongeveer 3,5 g Natriumpolystyreensulfonaat, USP en 15 meq natrium. (Een volle theelepel kan wel 10 g tot 12 g Natriumpolystyreen Sulfonaat, USP bevatten. Aangezien de efficiëntie van natrium-kalium-uitwisselingsharsen in vivo ongeveer 33 procent is, wordt ongeveer een derde van het werkelijke natriumgehalte van de hars aan het lichaam geleverd.
bij kleinere kinderen en zuigelingen dienen lagere doses te worden gebruikt door als leidraad een hoeveelheid van 1 mEq kalium per gram hars als basis voor de berekening te gebruiken.
elke dosis moet worden toegediend als suspensie in een kleine hoeveelheid water of, voor een betere smaak, in siroop. De hoeveelheid vloeistof varieert gewoonlijk van 20 mL tot 100 mL, afhankelijk van de dosis, of kan eenvoudig worden bepaald door 3 ml tot 4 mL per gram hars toe te staan. Beroepsbeoefenaren in de gezondheidszorg dienen zich bij de toediening van dit product volledig aan aspiratievoorschriften te houden, bijvoorbeeld door de patiënt rechtop te plaatsen en te houden terwijl de hars wordt toegediend.
de hars kan via een plastic buisje in de maag worden ingebracht en, indien gewenst, worden gemengd met een dieet dat geschikt is voor een patiënt met nierfalen.
het hars mag ook worden toegediend, zij het met minder effectieve resultaten, in een klysma bestaande (voor volwassenen) van 30 tot 50 g om de zes uur. Elke dosis wordt toegediend als een warme emulsie (bij lichaamstemperatuur) in 100 mL waterig medium. De emulsie moet tijdens de toediening voorzichtig worden bewogen. De klysma moet zo lang mogelijk worden bewaard en gevolgd door een reinigende klysma.
na een eerste reiniging van de klysma, een zachte, grote (French 28) rubberen buis wordt ingebracht in het rectum over een afstand van ongeveer 20 cm, met de tip goed in de sigmoid colon, en geplakt op zijn plaats. De hars wordt vervolgens gesuspendeerd in de juiste hoeveelheid waterig medium bij lichaamstemperatuur en ingebracht door zwaartekracht, terwijl de deeltjes in suspensie worden gehouden door roeren. De suspensie wordt gespoeld met 50 mL of 100 mL vloeistof, waarna de tube wordt geklemd en op zijn plaats blijft. Als ruglekkage optreedt, worden de heupen verhoogd op kussens of wordt een knieborst-positie tijdelijk ingenomen. Een iets dikkere suspensie kan worden gebruikt, maar er moet op worden gelet dat er geen pasta wordt gevormd, omdat deze een sterk verminderd uitwisselingsoppervlak heeft en bijzonder ineffectief zal zijn indien afgezet in de rectale ampulla. De suspensie wordt, indien mogelijk, enkele uren in de sigmoïde colon bewaard. Vervolgens wordt de dikke darm geïrrigeerd met nonsodium bevattende oplossing op lichaamstemperatuur om de hars te verwijderen. Twee liter spoeloplossing kan nodig zijn. De retouren worden constant afgevoerd via een Y-buisaansluiting. Hoewel het gebruik van sorbitol niet wordt aanbevolen, dient bijzondere aandacht te worden besteed aan deze reinigende klysma als sorbitol
is gebruikt, hangen de intensiteit en duur van de behandeling af van de ernst en resistentie van hyperkaliëmie.
Natriumpolystyreensulfonaat, USP mag niet worden verhit, omdat dit de uitwisselingseigenschappen van de hars kan veranderen.
Hoe wordt Kalexaatpoeder geleverd
Natriumpolystyreensulfonaat, USP is verkrijgbaar als een crème tot lichtbruin, fijngemalen poeder in potten van 1 pond (454 g),
NDC 10702-036-45.
Bewaren bij 20 ° tot 25°C (68° tot 77°F) met toegestane excursies tussen 15° en 30°C (59° tot 86°F) .
Rx alleen
vervaardigd door:
KVK-TECH INC.
110 Terry Drive
Newtown, PA 18940 USA.
Item ID # 006067/04
code van de fabrikant: 10702 10/13
VERPAKKINGSETIKET.Hoofdscherm
454 g Jar-etiket
NDC 10702-036-45
NATRIUMPOLYSTYREENSULFONAAT, USP
KATIONENUITWISSELINGSHARS
454 g
Rx alleen
gemiddelde dosis voor volwassenen: 15 g (ongeveer 4 afgestreken theelepels) een tot vier keer per dag in water. Zie de volledige voorschrijfinformatie.
het effect moet zorgvuldig worden gecontroleerd door frequente serumkaliumbepalingen binnen elke periode van 24 uur. Natriumgehalte ongeveer 60 mEq per 15 g
suspensie moet vers worden bereid en niet langer dan 24 uur worden bewaard. Doseer in strakke, lichtbestendige containers zoals gedefinieerd in de officiële compendia.
Bewaren bij 20 ° tot 25°C (68° tot 77°F) met toegestane excursies tussen 15° en 30°C (59° tot 86°F) .
KVK-TECH, INC.

| KALEXATE sodium polystyrene sulfonate powder |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – KVK-Tech, Inc. (173360061)
Registrant-KVK-Tech, Inc. (173360061)
| oprichting | |||
| naam | adres | ID / FEI | operaties |
| KVK-Tech, Inc. | 173360061 | vervaardiging(10702-036) | |
meer over Kalexaat (natriumpolystyreensulfonaat))
- bijwerkingen
- tijdens zwangerschap of borstvoeding
- doseringsinformatie
- geneesmiddelinteracties
- prijzen & Coupons
- Spaans
- Drug klasse: cation exchange resins
- FDA Waarschuwingen (2)
Consument resources
- Patiënt Informatie
Professional resources
- Prescribing Information
- Natrium Polystyreen Sulfonaat Orale Poeder (FDA)
Overige merken Kayexalate, Kionex
behandeling in Verband met gidsen
- Hyperkaliëmie
Medische Disclaimer