doseringsvorm: aerosol, foam
medisch beoordeeld door Drugs.com. laatst bijgewerkt op sep 1, 2019.
- overzicht
- bijwerkingen
- dosering
- professionele
- zwangerschap
- meer
- indicaties en gebruik voor Ketoconazolschuim
- Ketoconazole Foam dosering en toediening
- doseringsvormen en sterktes
- Contra-Indicaties
- Wanneer moet u extra voorzichtig zijn met dit middel
- Contactsensibilisatie
- ontvlambare inhoud
- systemische effecten
- bijwerkingen
- klinische studies ervaring
- dermale Veiligheidsstudies
- postmarketingervaring
- gebruik bij specifieke populaties
- zwangerschap
- borstvoeding
- vrouwelijke en mannelijke dieren met voortplantingsvermogen
- gebruik bij kinderen
- geriatrisch gebruik
- Ketoconazole Foam beschrijving
- Ketoconazole Foam-Klinische Farmacologie
- werkingsmechanisme
- farmacodynamiek
- farmacokinetiek
- Microbiologie
- niet-klinische Toxicologie
- carcinogenese, mutagenese, verminderde vruchtbaarheid
- klinische Studies
- Hoe Meegeleverde/Opslag en overslag
- informatie over Patiëntbegeleiding
- gebruiksaanwijzing
- PATIËNT INFORMATIE
- verpakking / etiket hoofddisplay – doos
- meer over ketoconazol)
- Consumer resources
- Professional resources
- Related treatment guides
indicaties en gebruik voor Ketoconazolschuim
Ketoconazolschuim is 2% geïndiceerd voor de topische behandeling van seborrheic dermatitis bij immunocompetente patiënten van 12 jaar en ouder.
gebruiksbeperkingen
veiligheid en werkzaamheid van Ketoconazole Foam, 2% voor de behandeling van schimmelinfecties zijn niet vastgesteld.
Ketoconazole Foam dosering en toediening
Ketoconazole Foam, dient 2% tweemaal daags gedurende vier weken op het(de) aangetaste gebied (en) te worden aangebracht.
houd de container rechtop en breng 2% Ketoconazole schuim in de dop van de bus of een ander koel oppervlak in een hoeveelheid die voldoende is om het(de) aangetaste gebied (en) te bedekken. Het direct op de handen toedienen wordt afgeraden, omdat het schuim onmiddellijk begint te smelten bij contact met een warme huid. Neem kleine hoeveelheden Ketoconazole schuim, 2% met de vingertoppen, en masseer zachtjes in het(de) aangetaste gebied (en) totdat het schuim verdwijnt. Voor haardragende gebieden, deel het haar, zodat Ketoconazole schuim, 2% kan direct worden toegepast op de huid (in plaats van op het haar).
Vermijd contact met de ogen en andere slijmvliezen. Ketoconazole schuim, 2% is niet voor oogheelkundig, oraal of intravaginaal gebruik.
doseringsvormen en sterktes
Ketoconazole Foam, 2% bevat 20 mg ketoconazole, USP per gram, geleverd in 50 g en 100 g verpakkingen.
Contra-Indicaties
Geen.
Wanneer moet u extra voorzichtig zijn met dit middel
Contactsensibilisatie
Ketoconazole Foam, 2% kan leiden tot contactsensibilisatie, inclusief fotoallergeniciteit.
ontvlambare inhoud
de inhoud van Ketoconazole schuim, 2% omvat alcohol en propaan/butaan, die ontvlambaar zijn. Vermijd vuur, vlam en/of roken tijdens en onmiddellijk na het aanbrengen. De containers niet doorprikken en/of verbranden. De recipiënten Niet blootstellen aan warmte en/of bewaren bij temperaturen boven de 120°F (49°C).
systemische effecten
Hepatitis is waargenomen bij oraal toegediende ketoconazol (1: 10.000 gemelde incidentie). Verlaagde serumspiegels van testosteron en ACTH–geïnduceerde corticosteroïden zijn waargenomen bij hoge doses oraal toegediende ketoconazol. Deze effecten zijn niet waargenomen bij gebruik van topische ketoconazol.
bijwerkingen
klinische studies ervaring
omdat klinische studies onder zeer uiteenlopende omstandigheden worden uitgevoerd, kunnen de percentages bijwerkingen die in de klinische studies met een geneesmiddel zijn waargenomen, niet direct worden vergeleken met de percentages in de klinische studies met een ander geneesmiddel, en weerspiegelen zij mogelijk niet de percentages die in de praktijk zijn waargenomen. De informatie over bijwerkingen uit klinische studies verschaft echter wel een basis voor het identificeren van de bijwerkingen die verband lijken te houden met drugsgebruik en voor het benaderen van de percentages.
de veiligheidsgegevens in Tabel 1 weerspiegelen de blootstelling aan Ketoconazolschuim, 2% bij 672 proefpersonen van 12 jaar en ouder met seborrheic dermatitis. Proefpersonen brachten gedurende 4 weken tweemaal daags Ketoconazole schuim, 2% of vehiculum schuim aan op de aangetaste delen van het gezicht, de hoofdhuid en/of de borst. Bijwerkingen die optraden bij > 1% van de patiënten worden weergegeven in Tabel 1.
Tabel 1: Bijwerkingen die Gemeld zijn door >1% van de Proefpersonen in Klinische Studies
|
Negatieve Reacties |
Ketoconazole Schuim, 2% N=672 n (%) |
Voertuig Schuim N=497 n (%) |
|
personen met een Negatieve Reactie |
188 (28%) |
122 (25%) |
|
Toepassing site branden |
67 (10%) |
49 (10%) |
|
reactie op de toedieningsplaats |
41 (6%) |
24 (5%) |
reacties op de toedieningsplaats die werden gemeld bij <1% van de patiënten waren droogheid, erytheem, irritatie, paresthesie, pruritus, huiduitslag en warmte.
dermale Veiligheidsstudies
in een onderzoek naar fotoallergeniciteit hadden 9 van de 53 proefpersonen (17%) tijdens de challenge-periode reacties op zowel de bestraalde als niet-bestraalde plaatsen behandeld met Ketoconazolschuim, 2%. Ketoconazole schuim, 2% kan contactsensibilisatie veroorzaken.
postmarketingervaring
de volgende bijwerkingen zijn vastgesteld tijdens het gebruik van Ketoconazole Foam na het in de handel brengen, 2%:
Maagdarmstelselaandoeningen: Cheilitis
Algemene aandoeningen en toedieningsplaatsstoornissen: pijn en brandwonden op de toedieningsplaats
huid-en onderhuidaandoeningen: Brandend gevoel van de huid en erytheem
omdat deze voorvallen vrijwillig worden gemeld vanuit een populatie van onzekere grootte, is het niet altijd mogelijk om de frequentie ervan betrouwbaar in te schatten of een causaal verband met blootstelling aan het geneesmiddel vast te stellen.
gebruik bij specifieke populaties
zwangerschap
samenvatting van het risico
er zijn geen gegevens beschikbaar over Ketoconazole Foam, 2% gebruikt bij zwangere vrouwen om een geneesmiddelgeassocieerd risico op ernstige geboorteafwijkingen, miskramen of nadelige maternale of foetale uitkomsten vast te stellen. Er zijn geen reproductiestudies bij dieren uitgevoerd met Ketoconazole Foam, 2%. In reproductiestudies bij dieren met drachtige muizen, ratten en konijnen werden zowel embryotoxische als ontwikkelingseffecten (structurele afwijkingen) waargenomen na orale toediening van ketoconazol tijdens de organogenese. Uitgaande van een equivalente systemische absorptie van topische en orale doses ketoconazol en een Ketoconazolschuim, 2% maximale aanbevolen humane dosis (MRHD) van 8 gram (equivalent aan 160 mg ketoconazol), werden embryotoxische effecten waargenomen bij 0,8 tot 2,4 maal de MRHD en werden ontwikkelingseffecten waargenomen bij 4.8 keer de MRHD .
het achtergrondrisico op ernstige geboorteafwijkingen en miskramen voor de aangegeven populatie is onbekend. Alle zwangerschappen hebben een achtergrondrisico van geboorteafwijking, verlies, of andere ongunstige resultaten. In de algemene bevolking van de V. S., is het geschatte achtergrondrisico van belangrijke geboortetekorten en miskraam in klinisch erkende zwangerschappen 2 tot 4% en 15 tot 20%, respectievelijk.
gegevens
Diergegevens
de veelvouden van berekeningen voor menselijke blootstelling zijn gebaseerd op vergelijkingen van orale doses toegediend aan dieren met een Ketoconazolschuim, 2% maximale aanbevolen humane dosis (MRHD) van 8 gram (equivalent aan 2,67 mg ketoconazol/kg/dag voor een individu van 60 kg of 98,8 mg ketoconazol/m2/dag).
embryofoetale ontwikkelingsstudies zijn uitgevoerd bij muizen, ratten en konijnen met oraal toegediend ketoconazol. Bij orale toediening aan muizen op zwangerschapsdagen 6 tot en met 18 (die de periode van organogenese beslaan) was ketoconazol embryotoxisch (25 mg/kg en hoger; 0,8 maal de maximaal aanbevolen humane dosis op basis van BSA-vergelijkingen) met een hoge incidentie van resorpties, een verhoogd aantal doodgeborenen en een vertraagde bevalling. Ook werden vertragingen in de rijping waargenomen. Er was geen bewijs van maternale toxiciteit of misvormingen bij maximaal 50 mg/kg (1,5 keer de maximaal aanbevolen humane dosis op basis van vergelijkingen van het lichaamsoppervlak). Er werden geen behandelingsgerelateerde ontwikkelingseffecten waargenomen bij 10 mg / kg (0,3 maal de maximaal aanbevolen humane dosis op basis van BSA-vergelijkingen).
In de aanwezigheid van maternale toxiciteit bij ratten, oraal toegediend ketoconazole was zowel embryotoxic (40 mg/kg en hoger; 2,4 maal de MRHD op basis van de BSA vergelijkingen), met inbegrip van meer geresorbeerd foetussen en doodgeborenen, en teratogeen (80 mg/kg en hoger; 4.8 maal de MRHD op basis van de BSA vergelijkingen), met inbegrip van syndactylia, oligodactylia, zwaaide ribben en een gespleten gehemelte. Bovendien was 100 mg/kg (6 keer de maximaal aanbevolen humane dosis op basis van BSA-vergelijkingen) ketoconazol oraal toegediend op één dag tijdens de zwangerschap (zwangerschapsdagen 9 tot en met 12) embryotoxisch (verhoogde resorpties). Dezelfde orale dosis, gegeven op dag 12, 13, 14 of 15 van de dracht, veroorzaakte externe misvormingen, waaronder gespleten gehemelte, micromelia en digitale anomalieën (brachydactylie, ectrodactylie, syndactylie).
Bij zwangere konijnen oraal toegediend ketoconazol, bewijs van embryotoxicity (verhoogde resorptions) werd waargenomen bij 10 mg/kg (1,2 maal de MRHD op basis van de BSA vergelijkingen) en hoger en een verhoogde incidentie van het skelet afwijkingen waargenomen bij 40 mg/kg (4.8 maal de MRHD op basis van de BSA vergelijkingen).
borstvoeding
samenvatting van het risico
er is geen informatie beschikbaar over de aanwezigheid van ketoconazol in moedermelk, of de effecten op het kind dat borstvoeding krijgt, of de effecten op de melkproductie na lokale toediening van Ketoconazolschuim, 2% bij vrouwen die borstvoeding geven. In dierstudies werd na orale toediening ketoconazol in de melk gevonden. De voordelen voor de ontwikkeling en de gezondheid van borstvoeding moeten in overweging worden genomen, samen met de klinische behoefte van de moeder aan Ketoconazole schuim, 2% en eventuele mogelijke bijwerkingen van Ketoconazole schuim, 2% of van de onderliggende maternale aandoening.
vrouwelijke en mannelijke dieren met voortplantingsvermogen
onvruchtbaarheid
in vruchtbaarheidsstudies bij dieren bij ratten en honden resulteerde toediening van orale doses ketoconazol tussen periodes van 3 dagen en 3 maanden in onvruchtbaarheid die reversibel was .
gebruik bij kinderen
de veiligheid en werkzaamheid van Ketoconazole Foam, 2% bij kinderen jonger dan 12 jaar zijn niet vastgesteld.
van de 672 patiënten behandeld met Ketoconazole schuim, was 2% in de klinische onderzoeken, 44 (7%) van 12 tot 17 jaar oud. .
geriatrisch gebruik
van de 672 patiënten behandeld met Ketoconazolschuim, was 2% in de klinische studies, 107 (16%) 65 jaar en ouder.
klinische studies met Ketoconazolschuim omvatten 2% niet voldoende personen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere personen.
Ketoconazole Foam beschrijving
Ketoconazole Foam, 2% bevat 2% ketoconazole USP, een antischimmelmiddel, in een thermolabiel Hydro-ethanolschuim voor lokale toepassing.
de chemische naam voor ketoconazol is piperazine, 1-acetyl-4-methoxy]fenyl] -, cis-met de molecuulformule C26H28CI2N4O4 en een molecuulgewicht van 531,43.
de volgende chemische structuur is:
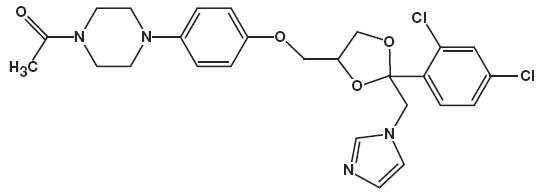
Ketoconazole Foam, 2% bevat 20 mg ketoconazol per gram in een thermolabiel Hydro-ethanolschuim bestaande uit cetylalcohol, citroenzuur, ethanol (gedenatureerd met tert-butylalcohol en brucinesulfaat) 58%, polysorbaat 60, kaliumcitraat, propyleenglycol, gezuiverd water en stearylalcohol onder druk gezet met een koolwaterstof (propaan/butaan) drijfgas.
Ketoconazole Foam-Klinische Farmacologie
werkingsmechanisme
het werkingsmechanisme van ketoconazole bij de behandeling van seborrheic dermatitis is niet bekend.
farmacodynamiek
de farmacodynamiek van Ketoconazole Foam is niet vastgesteld.
farmacokinetiek
in een onderzoek naar de biologische beschikbaarheid brachten 12 proefpersonen met matige tot ernstige seborrheic dermatitis 3 g Ketoconazole schuim, 2% tweemaal daags gedurende 4 weken aan. Circulerende plasmaspiegels van ketoconazol waren < 6 ng/mL voor een meerderheid van de proefpersonen (75%), met een maximumniveau van 11 ng/mL waargenomen bij één proefpersoon.
Microbiologie
ketoconazol is een antischimmelmiddel dat de in vitro synthese remt van ergosterol, een sleutelsterol in het celmembraan van Malassezia furfur. De klinische betekenis van antischimmelactiviteit bij de behandeling van seborrheic dermatitis is niet bekend.
niet-klinische Toxicologie
carcinogenese, mutagenese, verminderde vruchtbaarheid
er zijn geen langetermijnstudies bij dieren uitgevoerd om het carcinogene of fotokankerpotentieel van Ketoconazole Foam, 2%, te evalueren.
in orale carcinogeniciteitsstudies bij muizen (18 maanden) en ratten (24 maanden) bij doses van 5, 20 en 80 mg/kg/dag was ketoconazol niet carcinogeen. De hoge dosis in deze onderzoeken was ongeveer 2,4 tot 4,8 maal de maximaal aanbevolen humane dosis op basis van vergelijkingen van het lichaamsoppervlak. In een bacteriële reverse mutatietest vertoonde ketoconazol geen mutageen potentieel. In drie in vivo testen (zusterchromatide-uitwisseling bij mensen, dominant letale en micronucleustesten bij muizen) vertoonde ketoconazol geen genotoxisch potentieel.
in vruchtbaarheidsstudies bij dieren verminderde orale ketoconazol zowel de mannelijke als de vrouwelijke vruchtbaarheid bij ratten op een dosis-en duurafhankelijke manier. Bij vrouwen, orale doses tot 40 mg/kg (2,4 maal de MRHD op basis van de BSA vergelijkingen) had geen effect op de vruchtbaarheid, en een dosis van 75 mg/kg (4,5 maal de MRHD op basis van de BSA vergelijkingen) en hoger verminderde de kans op zwangerschap en het nummer van de implantatie sites. In mannelijke ratten, orale toediening van 200 mg/kg/dag (12 maal de MRHD op basis van de BSA vergelijkingen) voor drie dagen verminderde vruchtbaarheid en 400 mg/kg/dag (24 maal de MRHD op basis van de BSA vergelijkingen) voor drie dagen tot een compleet verlies van de vruchtbaarheid. Bij toediening gedurende langere perioden (tot 3 maanden) werd een verminderde vruchtbaarheid bij mannelijke ratten waargenomen bij doses vanaf 24 mg/kg/dag (1,4 maal de maximaal aanbevolen humane dosis gebaseerd op vergelijkingen van het lichaamsoppervlak). Bij mannelijke beagle-honden, een orale dosis van 25 mg/kg / dag ketoconazol gedurende maximaal 4 weken (5.2 maal de MRHD op basis van BSA-vergelijkingen) resulteerde in een verminderde beweeglijkheid van het sperma, een verlaagd aantal zaadcellen, een verhoogd abnormaal sperma en atrofie van de testes. Deze effecten werden hersteld na het staken van de behandeling.
klinische Studies
de veiligheid en werkzaamheid van Ketoconazole Foam, 2% werd geëvalueerd in een gerandomiseerd, dubbelblind, vehiculumgecontroleerd onderzoek bij patiënten van 12 jaar en ouder met lichte tot ernstige seborrheic dermatitis. In het onderzoek kregen 427 proefpersonen Ketoconazolschuim, 2% en 420 proefpersonen voertuigsschuim. Proefpersonen brachten gedurende 4 weken tweemaal daags Ketoconazole schuim, 2% of vehiculum schuim aan op de aangetaste delen van het gezicht, de hoofdhuid en/of de borst. De totale ernst van de ziekte in termen van erytheem, schaalvergroting en induratie werd beoordeeld bij Baseline en in week 4 op een 5-punts Investigator ‘ s Static Global Assessment (ISGA) schaal.
het succes van de behandeling werd gedefinieerd als het bereiken van een week 4 (einde van de behandeling) ISGA-score van 0 (duidelijk) of 1 (de meerderheid van de laesies heeft individuele scores voor schilfering, erytheem en induratie die gemiddeld 1 bedraagt ) en ten minste twee graad van verbetering ten opzichte van de uitgangswaarde. De resultaten zijn weergegeven in Tabel 2. De database was niet groot genoeg om te beoordelen of er verschillen waren in effecten in subgroepen van leeftijd, geslacht of ras.
Tabel 2: Werkzaamheid
|
Aantal Vakken |
Ketoconazole Schuim, 2% N = 427 n (%) |
Voertuig Schuim N = 420 n (%) |
|
Onderwerpen die het Bereiken van het Succes van de Behandeling |
239 (56%) |
176 (42%) |
Hoe Meegeleverde/Opslag en overslag
Ketoconazole Schuim, 2% bevat 20 mg ketoconazol, USP per gram. Het thermolabiele Hydro-ethanolschuim is als volgt verkrijgbaar:
NDC 45802-532-32
50 g aluminium blik
NDC 45802-532-33
100 g aluminium blik
Bewaren bij 20° tot 25°C (68° tot 77°F). .
niet in de koelkast bewaren.
de inhoud is ontvlambaar. De recipiënten Niet blootstellen aan warmte en/of bewaren bij temperaturen boven 49°C (120°F). Niet bewaren in direct zonlicht.
inhoud onder druk. De container niet doorprikken en / of verbranden.
buiten bereik van kinderen houden.
informatie over Patiëntbegeleiding
zie FDA-goedgekeurde patiëntetikettering (bijsluiter voor patiënten).
Instrueer patiënten over een juist gebruik van Ketoconazole Foam, 2%.
* vermijd vuur, vlam en/of roken tijdens en onmiddellijk na het aanbrengen. * Breng Ketoconazole Foam, 2% niet direct aan op de handen. Doseer op een koel oppervlak en breng aan op de getroffen gebieden met behulp van de vingertoppen. • Was hun handen na het aanbrengen * Ketoconazole schuim, 2% Kan huidirritatie veroorzaken (branderig gevoel op de plaats van aanbrengen en/of reacties) • Instrueer een patiënt contact op te nemen met een zorgverlener als het gebied van aanbrengen tekenen van verhoogde irritatie vertoont en alle tekenen van bijwerkingen te melden.
Made in Israel
vervaardigd door Perrigo
Yeruham, Israel
verdeeld door
Perrigo®
Allegan, MI 49010
www.perrigo.com
Rev 08-18
5K200RCJ3
gebruiksaanwijzing
Ketoconazole Foam, 2%
belangrijke informatie: Ketoconazole Foam, 2% is uitsluitend bestemd voor gebruik op de huid. Gebruik 2% Ketoconazole schuim niet in uw ogen, mond of vagina.
Stap 1: Verwijder de doorzichtige dop van het Ketoconazole schuim, 2% blik.
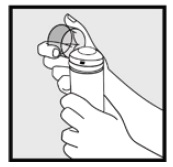
Stap 2: houd het blikje rechtop en druk stevig op het mondstuk om 2% Ketoconazole-schuim in de doorzichtige dop te spuiten. * Doseer voldoende Ketoconazole schuim, 2% om het gehele getroffen gebied(en) te bedekken.
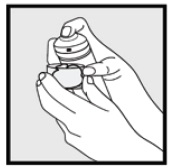
• als het blikje warm lijkt of het schuim vloeibaar lijkt, laat het blikje dan onder koud water lopen.
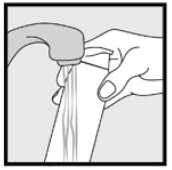
Stap 3: Neem kleine hoeveelheden Ketoconazole schuim, 2% , op met uw vingertoppen en wrijf het schuim zachtjes in het(de) aangetaste gebied (en) totdat het schuim verdwijnt.
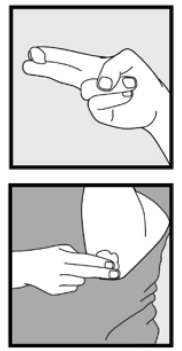
• als u behandeld gebieden zoals uw hoofdhuid, deel het haar zodat Ketoconazole schuim, 2% kan direct worden toegepast op de huid.

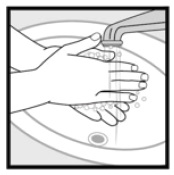
Stap 4: Was uw handen na het aanbrengen van 2% Ketoconazole schuim. * Gooi het ongebruikte geneesmiddel dat nog in de dop zit, weg.
Hoe moet ik Ketoconazole Foam, 2% bewaren?
* bewaar Ketoconazole schuim, 2% bij kamertemperatuur tussen 20 ° C en 25°C. * Bewaar het Ketoconazole schuim, 2% blikje niet in de koelkast of vriezer. * Houd Ketoconazole Foam, 2% uit de buurt van warmte. Gooi het blik nooit in een vuur, zelfs als het blik leeg is. * Bewaar Ketoconazole schuim, 2% niet bij temperaturen boven 120°F (49 ° C). * Breek het Ketoconazole schuim niet door (prik het door), 2% kan het.
houd Ketoconazole Foam, 2% en alle geneesmiddelen buiten het bereik van kinderen.
deze gebruiksaanwijzing is goedgekeurd door de Amerikaanse Food and Drug Administration.
Rx Only
Made in Israel
Vervaardigd Door Perrigo
Yeruham, Israël
Gedistribueerd Door
Perrigo®
Allegan, MI 49010
www.perrigo.com
Rev 08-18
PATIËNT INFORMATIE
Ketoconazole Schuim, 2%
Belangrijke Informatie: Ketoconazol Schuim, 2% is voor gebruik op de huid alleen. Gebruik 2% Ketoconazole schuim niet in uw ogen, mond of vagina.
Wat is 2% Ketoconazole Foam?
Ketoconazole Foam, 2% is een geneesmiddel op recept dat op de huid wordt gebruikt (topisch) voor de behandeling van seborrheic dermatitis bij mensen van 12 jaar en ouder met een normaal immuunsysteem.
het is niet bekend of 2% Ketoconazole schuim veilig en werkzaam is bij gebruik voor de behandeling van schimmelinfecties.
het is niet bekend of 2% Ketoconazole schuim veilig en werkzaam is bij kinderen jonger dan 12 jaar.Voordat u Ketoconazole schuim gebruikt, 2%, vertel uw zorgverlener over al uw medische aandoeningen, ook als u:
• zwanger bent of van plan bent zwanger te worden. Het is niet bekend of 2% van het Ketoconazole schuim schadelijk is voor uw ongeboren baby. * borstvoeding geeft of van plan bent borstvoeding te geven. Het is niet bekend of 2% Ketoconazole schuim in de moedermelk terechtkomt. Praat met uw zorgverlener over de beste manier om uw baby te voeden tijdens de behandeling met Ketoconazole Foam, 2%.
vertel uw zorgverlener over alle geneesmiddelen die u gebruikt, inclusief geneesmiddelen op recept en vrij verkrijgbare geneesmiddelen, vitaminen en kruidensupplementen.
Hoe moet ik Ketoconazole Foam gebruiken, 2%?
* gebruik Ketoconazole Foam, 2% precies zoals uw zorgverlener u vertelt het te gebruiken. Zie de gedetailleerde “gebruiksaanwijzing” aan het einde van deze bijsluiter voor aanwijzingen over het op de juiste manier aanbrengen van Ketoconazole Foam, 2%. * Breng 2% Ketoconazole Foam gedurende 4 weken 2 keer per dag aan op de aangetaste huid. U dient voldoende Ketoconazole schuim, 2%, aan te brengen om het gehele aangetaste gebied(en) te bedekken. * Neem contact op met uw zorgverlener als uw huid niet verbetert na 4 weken behandeling met Ketoconazole Foam, 2%. * Breng 2% Ketoconazole schuim rechtstreeks in de dop. Geef Ketoconazole Foam, 2%, niet direct op uw handen, omdat het schuim begint te smelten bij contact met een warme huid. * Was uw handen na het aanbrengen van Ketoconazole Foam, 2%.
wat moet ik vermijden tijdens het gebruik van 2% Ketoconazole Foam?
* 2% Ketoconazole schuim is ontvlambaar. Vermijd vuur, vlammen of roken tijdens en direct na het aanbrengen van Ketoconazole Foam, 2% op uw huid. * Vermijd het krijgen van Ketoconazole schuim, 2% in of in de buurt van uw ogen, mond, lippen of vagina. Als u 2% Ketoconazole schuim op uw lippen of in uw ogen, mond of vagina krijgt, spoel dan goed met water.
Wat zijn de mogelijke bijwerkingen van Ketoconazole Foam, 2%?
Ketoconazole Foam, 2% kan ernstige bijwerkingen veroorzaken, waaronder:
* huidirritatie op de toedieningsplaats(en), waaronder huidreacties veroorzaakt door blootstelling aan licht. Vertel het uw zorgverlener als u huidirritatie ontwikkelt tijdens de behandeling met Ketoconazole Foam, 2%.
de meest voorkomende bijwerkingen van Ketoconazole Foam, 2%, zijn branderig gevoel, droogheid, roodheid, irritatie, gevoelloosheid, jeuk, uitslag en warmte op de toedieningsplaats.
dit zijn niet alle mogelijke bijwerkingen van Ketoconazole Foam, 2%.
bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan FDA op 1-800-FDA-1088.
Hoe moet ik Ketoconazole Foam, 2% bewaren?
* bewaar Ketoconazole schuim, 2% bij kamertemperatuur tussen 20 ° C en 25°C. * Bewaar het Ketoconazole schuim, 2% blikje niet in de koelkast of vriezer. * Houd Ketoconazole Foam, 2% uit de buurt van warmte. Gooi het Ketoconazole schuim, 2% blikje nooit in een vuur, zelfs niet als het blikje leeg is. * Bewaar Ketoconazole schuim, 2% niet bij temperaturen boven 120°F (49 ° C). * Breek het Ketoconazole schuim niet door (prik het door), 2% kan het. Houd Ketoconazole Foam, 2% en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over een veilig en doeltreffend gebruik van Ketoconazole Foam, 2%.
geneesmiddelen worden soms voorgeschreven voor andere doeleinden dan die vermeld in een bijsluiter. Gebruik Geen Ketoconazole schuim, 2% voor een aandoening waarvoor het niet was voorgeschreven. Geef 2% Ketoconazole Foam niet aan andere mensen, zelfs niet als zij dezelfde symptomen hebben als u. Het kan schadelijk voor hen zijn. U kunt uw apotheker of zorgverlener om informatie vragen over Ketoconazole Foam, 2% dat is geschreven voor gezondheidswerkers.
welke stoffen zitten in 2% Ketoconazole Foam?
werkzaam bestanddeel: ketoconazol
inactieve bestanddelen: cetylalcohol, citroenzuur, ethanol (gedenatureerd met tert-butylalcohol en brucinesulfaat) 58%, polysorbaat 60, kaliumcitraat, propyleenglycol, gezuiverd water en stearylalcohol onder druk gezet met een koolwaterstof (propaan/butaan) stuwstof
voor meer informatie, bel Perrigo op 1-866-634-9120
deze bijsluiter voor patiënten is goedgekeurd door de Amerikaanse Food and Drug Administration.
verpakking / etiket hoofddisplay – doos
alleen Rx
Ketoconazole Foam, 2%
alleen voor topisch gebruik.
niet voor oftalmisch, oraal of intravaginaal gebruik.
100 g

de volgende afbeelding is een plaatshouder die de productidentificatie vertegenwoordigt die tijdens de verpakkingsoperatie op het etiket van het geneesmiddelpakket is aangebracht of is bedrukt.

| ketoconazol ketoconazol aerosol, schuim |
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
Labeler – Perrigo New York Inc (078846912)
meer over ketoconazol)
- bijwerkingen
- tijdens zwangerschap of borstvoeding
- doseringsinformatie
- alternatieven vergelijken
- prijzen & Coupons
- Spaans
- 36 beoordelingen
- Drug klasse: topical antifungals
Consumer resources
- Patient Information
- Ketoconazole Topical (Advanced Reading)
Professional resources
- Prescribing Information
- Ketoconazole (Topical) (Professional Patient Advice)
- Ketoconazole Cream (FDA)
- Ketoconazole Shampoo (FDA)
Other brands Nizoral Shampoo, Ketodan, Extina, Xolegel
Related treatment guides
- Seborrheic Dermatitis
- Cutaneous Candidiasis
- Androgenetic Alopecia
- Dandruff
- … + 4 meer
medische Disclaimer