| Autor | Afiliação |
|---|---|
| Lindsay A. Weiner, MD | Universidade de Maryland Medical Center, em Baltimore, Maryland |
| George Willis, MD | Universidade de Maryland School of Medicine, Departamento de Medicina de Emergência, Baltimore, Maryland |
| Zachary D. W. Dezman, MD, MS, MS | Universidade de Maryland Escola de Medicina, Departamento de Medicina de Emergência, Baltimore, Maryland |
| Laura J. Bontempo, MD, MEd | Universidade de Maryland Escola de Medicina, Departamento de Medicina de Emergência, Baltimore, Maryland |
apresentação de Caso
discussão de Caso
em Caso de resultado
Resident discussão
diagnóstico Final
Chave de pontos de ensino
APRESENTAÇÃO de CASO
52 anos de idade da mulher veio para o departamento de emergência (ED) para hemodiálise (HD), devido à insuficiência renal em estágio terminal (IRCT). Ela passou as semanas anteriores em um hospital externo sendo tratado por pneumonia e bacteremia com Daptomicina. Posteriormente, ela saiu contra aconselhamento médico (AMA) depois de ter seu cateter de acesso à diálise removido. Ela apresentou ao nosso De porque precisava de colocação de acesso vascular À HD e re-iniciação de tratamentos de diálise. Sua história médica incluiu doença renal crônica secundária a nefroesclerose hipertensiva, anemia, hipertensão, tromboses venosas profundas (TVP), lúpus eritematoso sistêmico e um distúrbio convulsivo de etiologia desconhecida.
o paciente, testemunha de Jeová, recusou transfusões de sangue; portanto, sua anemia estava sendo tratada com administração intravenosa (IV) de ferro, epoetina alfa e folato. Outros medicamentos incluíram nifedipina, clonidina, metoprolol, sevelamer e prednisona. Ela era alérgica a amoxicilina, azitromicina, hidralazina, labetolol, linezolida, morfina e vancomicina. Ela relatou o uso anterior de heroína IV muitos anos antes e o tabagismo anterior. Ela negou o uso de álcool ou qualquer uso atual de drogas ou tabaco.
na chegada, ela estava alerta e sem sofrimento agudo com febre de 38.3 ° Celsius, frequência cardíaca de 87 batimentos por minuto( bpm), pressão arterial de 110/65 milímetros de mercúrio (mmHg), frequência respiratória de 17 respirações por minuto e oximetria de pulso de 99% enquanto respira ar ambiente. Ela pesava 80 quilos e tinha 5 pés e 6 polegadas de altura. Sua cabeça era normocefálica e atraumática com membranas mucosas úmidas. Os alunos eram anictéricos, iguais, redondos e reativos à luz e acomodação. O pescoço era flexível e sem linfadenopatia ou sensibilidade. Seus pulmões tinham sons de respiração grosseira com crepitações bibasilares suaves, mas sem sibilos ou rhonchi. Não houve retrações ou aumento do trabalho respiratório. Seu coração era de frequência e ritmo regulares, sem murmúrios, fricções ou galope. Seu abdômen era macio com sons intestinais normais e sem distensão, ternura, rebote ou guarda. Não havia sensibilidade do ângulo costovertebral. As extremidades inferiores apresentavam edema de 1 + pitting, pulsos de 2 + dorsalis pedis e não apresentavam sensibilidade ou deformidade. O paciente apresentava força normal e tônus muscular em todas as extremidades com sensação intacta. Fístulas antigas estavam presentes nas extremidades superiores esquerda e direita sem emoções palpáveis. Ela estava alerta e orientada para a pessoa, lugar, e tempo.
os valores laboratoriais iniciais do paciente são mostrados na Tabela 1. Estes foram significativos para uma leve leucocitose, anemia a 5,3 g/dL, trombocitopenia, hipercalemia e creatinina elevada de 11,9 mg/dL. Seu eletrocardiograma inicial (ECG) mostrou taquicardia sinusal com inversões de onda T nas derivações I e V6 (imagem 1). Isso permaneceu inalterado em relação a um ECG anterior. O paciente foi internado na equipe de medicamentos e foi iniciado com Daptomicina. Enquanto aguardava a colocação no leito, um cateter de diálise femoral esquerdo não tunelado foi inserido pelo sujeito da unidade de terapia intensiva médica (UTI) para o início da HD. A colocação foi confirmada pela fácil desvantagem do sangue de todas as portas. Durante o processo de consentimento para a colocação do cateter, foi documentado que a paciente afirmou que “preferiria morrer do que receber transfusões de sangue.”Após a colocação do cateter, foi feita uma tentativa de iniciar a DH, mas ela ficou hipotensora e queixou-se de fraqueza quase imediatamente. Seus sinais vitais durante a tentativa inicial de HD foram pressão arterial de 85/56 mmHg com frequência cardíaca de 105 bpm.
| Valores | |
|---|---|
| hemograma | |
| contagem de leucócitos | 12.4 K/mcl |
| Hemoglobina | de 5,3 g/dL |
| Hematócrito | 15.8% |
| Platelets | 133 K/mcl |
| Basic metabolic panel | |
| Sodium | 135 mmol/L |
| Potassium | 5.8 mmol/L |
| Chloride | 99 mmol/L |
| Bicarbonate | 27 mmol/L |
| Blood urea nitrogen | 56 mg/dL |
| Creatinine | 11.9 mg/dL |
| Glucose | 189 mg/dL |
| Calcium | 7.2 mg / dL |
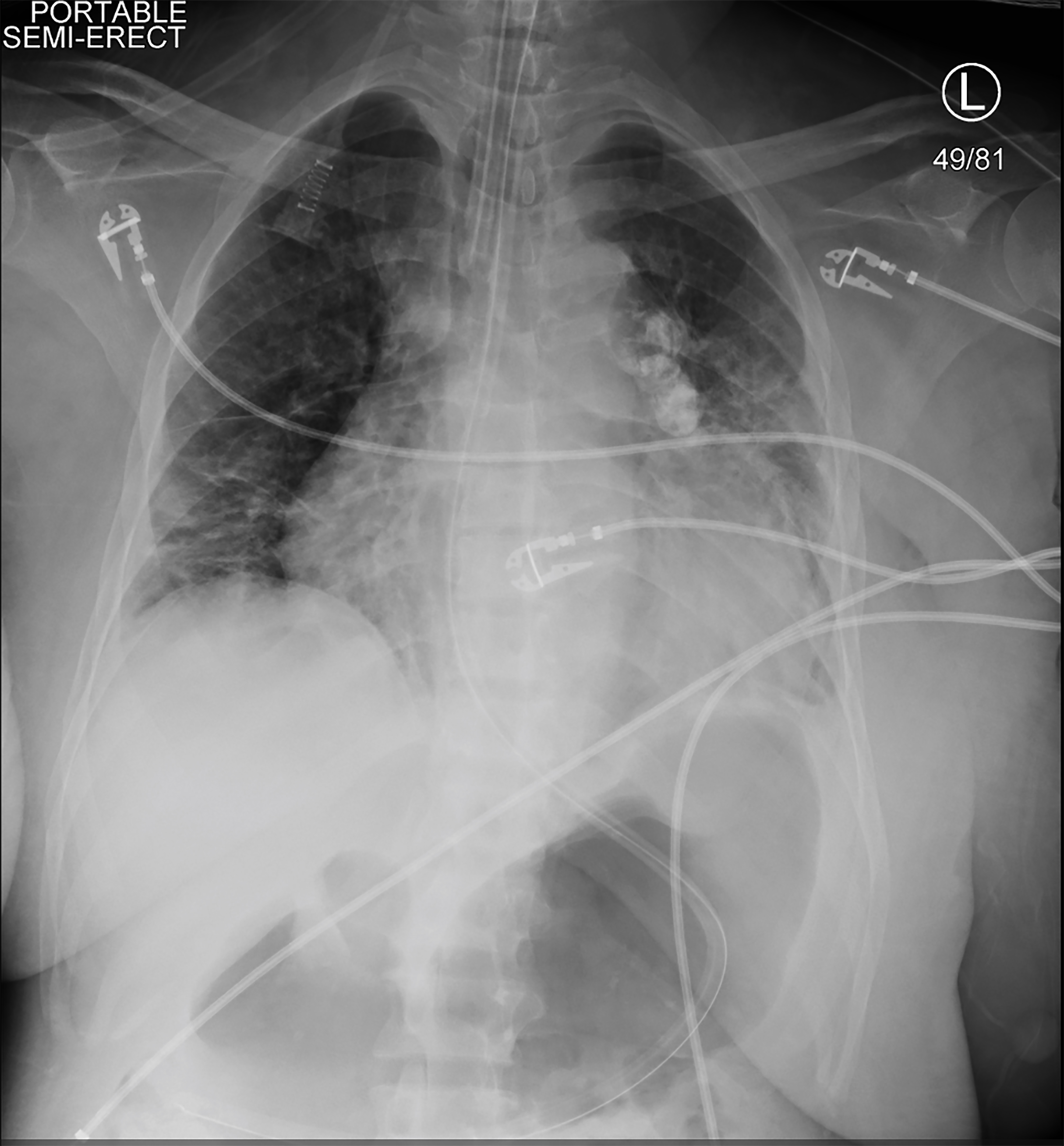
como o paciente era sintomático e hipotensor durante a HD, foi iniciada terapia de reposição renal contínua (TRC). Pouco depois, ela ficou hipotensora, sem resposta e teve uma convulsão clônica tônica. Os sinais vitais naquela época eram uma frequência cardíaca de 113 bpm, pressão arterial 75/48 mmHg, frequência respiratória de 20 respirações por minuto e saturação de oxigênio de 78% no ar ambiente. Um exame físico breve e repetido mostrou que a paciente não respondia a estímulos dolorosos e suas pupilas eram iguais e reativas. Ela recebeu 4 mg de lorazepam e intubou para proteção das vias aéreas. Uma linha femoral arterial direita e uma linha central venosa de lúmen Triplo femoral direito foram colocadas. Uma radiografia de tórax confirmou a colocação do tubo endotraqueal (imagem 2). O CRRT foi interrompido, mas o paciente permaneceu em choque apesar das infusões em bolus de cristalóide, então os vasopressores foram iniciados. Ela estava recebendo doses crescentes de vasopressores quando valores laboratoriais repetidos indicaram hemoglobina de 1,6 g / dL (Tabela 2).
| Values (prior value) | |
|---|---|
| Complete blood cell count | |
| White blood cell count | 13.4 K/mcl (12.4 K/mcl) |
| Hemoglobin | 1.6 g/dL (5.3 g/dL) |
| Hematocrit | 5.7% (15.8%) |
| Platelets | 167 K/mcl (133K/mcl) |
| Complete metabolic panel | |
| Sodium | 131 mmol/L |
| Potassium | 6.7 mmol/L |
| Chloride | 99 mmol/L |
| Bicarbonate | 14 mmol/L |
| Blood urea nitrogen | 56 mg/dL |
| Creatinine | 11.9 mg/dL |
| Glucose | 169 mg/dL |
| Alanine aminotransferase | 23 u/L |
| Aspartate aminotransferase | 31 u/L |
| Alkaline phosphatase | 145 u/L |
| Total bilirubin | 0.4 mg/dL |
| proteína Total | de 5,8 g/dL |
| Albumina | 3,2 g/dL |
| Lactato | 15 u/L |
| sangue Arterial de gás | |
| pH | 7.23 |
| PCO2 | 28 mm hg |
| PO2 | 214 mm hg |
Logo depois ela entrou em parada cardíaca com um ritmo de pulseless atividade elétrica (PEA). O retorno da circulação espontânea foi alcançado após seis minutos de ressuscitação cardiopulmonar. O aumento da distensão abdominal foi observado durante a ressuscitação; portanto, um cateter urinário com detecção de pressão foi introduzido. Seu pico de pressão das vias aéreas e da bexiga foi medido em mais de 60 cmH2O e 50 mmHg, respectivamente. A cirurgia foi então consultada. Um protocolo de transfusão maciça foi iniciado depois que seus parentes mais próximos concordaram em permitir a transfusão de hemoderivados. Foi realizada uma avaliação focada com ultrassonografia para trauma (FAST), mostrando fluido livre na bolsa de Morrison. Como as medidas de ressuscitação foram continuadas, um estudo adicional foi obtido e um diagnóstico foi feito.
discussão de casos
este caso apresentou uma sequência única e tortuosa de eventos que espiralaram muito rapidamente em uma direção infeliz. Quando apresentado com pacientes com queixas vagas ou mínimas, cabe aos provedores procurar pistas para auxiliar na realização do diagnóstico. Portanto, comecei procurando as pistas neste caso.
a paciente apresentou queixa principal de necessidade de diálise. Recentemente, ela foi internada em outra instalação por pneumonia e bacteremia e teve seu cateter de HD removido devido a suspeita de sepse de linha. Ela assinou AMA desta instalação depois de receber Daptomicina. Não se sabe há quanto tempo ela ficou sem DH ou se ela terminou seu curso de antibióticos antes de sair. No entanto, ela é essencialmente assintomática.
seu histórico médico anterior é notável por convulsões, bem como TVP e anemia. Não há menção a nenhum medicamento anticoagulante ou antiepiléptico, o que indica que ela não se lembrava dos nomes de seus medicamentos ou que não estava tomando nenhum. Digno de nota, ela é testemunha de Jeová e, portanto, recebeu terapias alternativas para sua anemia, incluindo ferro, folato e epógeno.
seu exame físico revela que ela é febril, mas com sinais vitais estáveis. Eu esperaria isso considerando que ela havia deixado a outra instalação e provavelmente não terminou seu curso de antibiótico para sua pneumonia e bacteremia. Outras possibilidades incluem uma infecção resistente ao antibiótico ou uma infecção nosocomial recém-adquirida de sua internação hospitalar anterior. Ela tem alguns sons de respiração grosseiros e crepitações bibasilares em seu exame pulmonar, o que corrobora sua história de pneumonia. A pneumonia é provavelmente a fonte de sua febre, bem como a bacteremia, que pode não apresentar sintomas.
seus estudos laboratoriais revelaram alguns achados pertinentes. Ela era anêmica e hipercalêmica. Ela também era hipocalcêmica e hiperfosfatêmica. Ela também teve uremia leve. A maioria desses achados seria um pouco esperada em um paciente com DRT. A anemia pode ser o resultado de doença renal. Outras possibilidades no diagnóstico diferencial de anemia incluem hemorragia, deficiência de ferro e deficiência de folato. Ela não se queixa de nenhuma perda de sangue nem temos os índices de glóbulos vermelhos, como o volume corpuscular médio, para poder fazer esses diagnósticos alternativos neste momento. Sua hipercalemia é mais provável por sua falta de HD. Sua hiperfosfatemia também é mais provável por falta de HD; no entanto, a Daptomicina também pode causar hiperfosfatemia.
enquanto aguarda a colocação na cama, ela começou a ter DH durante a qual começa a queixar-se de sentir-se fraca e é notada como hipotensora e taquicárdica. Ela então tem CRRT iniciado e permanece hipotensora, torna-se hipóxica, sem resposta e tem uma convulsão tônico-clônica que requer intubação e iniciação vasopressora. O exame mostra alunos iguais e reativos em um paciente que não responde a estímulos dolorosos. Estudos laboratoriais revelam um agravamento profundo da anemia, agravamento da hipercalemia e desenvolvimento intervalado de uma acidose láctica. Ela então entra em uma parada de ervilha e, após o retorno bem-sucedido da circulação espontânea, tem sangue transfundido. No entanto, ela ainda é hipotensora e hipóxica, apesar da intubação. Ela também tem um abdômen distendido e pressões máximas das vias aéreas maiores que 60 cmH2O. um exame rápido revela fluido livre na bolsa de Morrison.
uma mudança de status tão profunda após uma intervenção terapêutica requer um pensamento sério. Vamos começar com a hipotensão e taquicardia durante a HD e subsequente CRRT. A hipotensão durante a HD é certamente possível com taxas de fluxo mais altas. No entanto, o CRRT tem taxas de fluxo muito mais lentas e a hipotensão é menos frequente quando o CRRT é usado. Então, por que essa pessoa em choque requer vasopressores após o início da DH?
ao se aproximar de pacientes com choque, o choque mnemônico (séptico/espinhal; hipovolêmico; obstrutivo; cardiogênico; anafilático – K como no láctico) vem à minha mente. A sepse é certamente possível, dada sua história de bacteremia. No entanto, é menos provável que seja a causa de uma descompensação tão profunda, especialmente com um início agudo no cenário de início da HD. O choque hipovolêmico ou hemorrágico é outra possibilidade. Ela tem fatores de risco para ambos, pois pode estar em anticoagulação com sua história de TVP, bem como possivelmente com mau funcionamento urêmico das plaquetas. Isso precisará ser investigado mais adiante. Choque obstrutivo como na embolia pulmonar ou tamponamento é outra possibilidade. Ela certamente tem fatores de risco para isso com sua história de TVP e status de anticoagulação desconhecido. Ela também é hipóxica, o que não é explicado pela pneumonia porque suas saturações originais estavam acima de 95%. Ela também poderia ter desenvolvido tamponamento a partir de pericardite urêmica, embora isso seja menos provável, uma vez que seu nitrogênio ureico no sangue (BUN) não está significativamente elevado e ela não teve queixas de sintomas de pericardite. Outra Possível causa de colapso hemodinâmico que leva ao choque obstrutivo é uma embolia aérea do novo cateter de HD e subsequente iniciação de HD através dele. Porque isso é possível, precisamos provocar isso um pouco mais também.
o choque cardiogênico é menos provável, pois é improvável que ela tenha desenvolvido um infarto do miocárdio indolor tão grave que entrou em choque cardiogênico. Problemas anafiláticos e endócrinos são outras possíveis causas de choque. No entanto, não houve medicação administrada ou qualquer menção de erupção cutânea ou comprometimento das vias aéreas para sugerir anafilaxia como causa. O choque endócrino deve ser considerado como ela está em prednisona, tornando a insuficiência adrenal uma possível causa. A hipercalemia e a hiponatremia que você esperaria com insuficiência adrenal estão presentes; no entanto, não há menção de descumprimento ou vômito dos esteróides, tornando essa possibilidade menos provável.
a apreensão durante a DH é outra entidade presente neste caso. Ela tem histórico de convulsões e nenhum antiepiléptico está em sua lista de medicamentos. Então, sua apreensão certamente poderia ser de descumprimento. A encefalopatia urêmica pode se apresentar como convulsões em qualquer ponto; no entanto, o coque é apenas ligeiramente elevado, tornando isso improvável. A síndrome do desequilíbrio dialítico é outra causa de convulsão durante a HD. No entanto, geralmente ocorre durante a primeira sessão de HD e está associada a uma queda rápida no pão. Este paciente está em HD há algum tempo e o coque não está marcadamente elevado, tornando esse diagnóstico improvável. Por último, a diminuição da perfusão cerebral por hipotensão durante a DH pode induzir convulsões. O paciente tornou-se hipotensor durante a HD, o que pode acontecer devido a maiores taxas de fluxo. Ela foi então colocada no CRRT, que usa uma taxa de fluxo mais lenta e tem uma incidência muito menor de hipotensão; no entanto, ela se tornou mais hipotensora. Isso sugere que provavelmente há algum outro motivo para a hipotensão, em vez de simplesmente a DH.
ela também tem fluido livre em seu exame rápido e agora tem um abdômen distendido. Juntamente com a anemia profundamente piorando, eu tenho que assumir que ela está sangrando em seu abdômen. Não há nada além de hemorragia e hemólise que possam explicar uma queda tão profunda em sua hemoglobina, e não há evidências suspeitas de hemólise em sua história, exame físico ou estudos auxiliares.
o paciente também está experimentando pressões elevadas das vias aéreas no ventilador. Existem várias razões pelas quais suas pressões das vias aéreas podem ser elevadas; mas no cenário de um abdômen distendido e hipotensão, a síndrome do compartimento abdominal (SCA) vem à tona em meus diagnósticos diferenciais. Portanto, tenho que assumir que este é um sangramento relativamente rápido, pois ela deixou cair sua hemoglobina significativamente, entrou em Parada de ervilha, melhorou com transfusões de sangue e está exigindo vários vasopressores para manter sua pressão arterial. Mas por que ela está sangrando no abdômen? Ela não sofreu nenhum trauma no abdômen, a menos que tenha acontecido durante a convulsão no hospital; no entanto, se esse tivesse sido o caso, presumiria que esse histórico teria sido dado. Ela certamente poderia ter experimentado algum tipo de catástrofe aórtica, como um aneurisma da aorta abdominal rompido, mas seria muito estranho que isso tivesse acontecido durante a DH.
agora eu tive que dar um passo para trás e ver as pistas de diagnóstico como um todo e colocar essas peças do quebra-cabeça juntas. Ao ter em vista toda essa apresentação do paciente, um tema comum surge em quase todos os aspectos de sua sequência de eventos. Hemorragia. Anemia? Hemorragia. Sua anemia piora? Definitivamente hemorragia. Hipotensão? Hemorragia. Apreensão? Hipoperfusão proveniente de hipotensão proveniente de hemorragia. Hipoxia? Anemia profunda, que vem da hemorragia. ACS? Hemorragia. Acidose láctica? Hipotensão e anemia por hemorragia.
agora só temos que descobrir de onde vem essa hemorragia. Quando a paciente se apresentou pela primeira vez, ela parecia notavelmente estável. Ela não tinha queixas e seus sinais vitais, além de sua febre, estavam dentro dos limites normais. Ela tinha um cateter HD colocado sem qualquer menção de complicação. Ela começa a DH e sua pressão arterial cai, sua freqüência cardíaca aumenta e ela se torna sintomática quase imediatamente. Eu poderia facilmente culpar a DH como a causa; no entanto, seus provedores iniciam o CRRT e sua hipotensão piora, tornando a DH menos provável de ser a causa. Portanto, algo aconteceu antes do início da DH, pois ela estava estável até o início da DH. A única coisa que aconteceu antes do início da HD foi a colocação do cateter HD. Não há menção de complicações ou perda significativa de sangue durante a colocação. No entanto, é o único evento entre o paciente ser estável e instável.
se não houvesse menção a uma complicação óbvia, o que poderia ter acontecido? Lembre-se de que a fonte presumida do sangramento está no abdômen. O cateter de HD foi colocado na virilha, que não fica longe do abdômen e do espaço retroperitoneal. Se o provedor que colocou a linha penetrasse no outro lado da parede do vaso, ele/ela poderia facilmente ter colocado o cateter HD para que sua ponta fique no retroperitônio. Se fosse esse o caso, o paciente extravasaria sangue para o espaço retroperitoneal causando hipotensão, diminuição da perfusão, acidose láctica e anemia profunda. Uma vez preenchido o espaço retroperitoneal, haveria aumento da pressão intra-abdominal levando eventualmente à SCA. Uma revisão da literatura revela um relato de caso desse tipo de complicação.1
portanto, o estudo diagnóstico que eu realizaria é um tomografia computadorizada (TC) angiograma do abdômen e pelve. Isso mostraria onde o cateter de HD foi colocado e examinaria o retroperitônio em busca de sinais de sangramento ativo.
resultado do caso
o estudo diagnóstico foi uma angiografia por TC do abdome e da pelve. O cateter de HD femoral esquerdo puncionou a veia ilíaca comum esquerda do paciente e formou um hematoma retroperitoneal do lado direito. A equipe cirúrgica avaliou a paciente e realizou uma laparotomia de cabeceira temporizante para tratar sua SCA aguda. Isso revelou um hematoma retroperitoneal grande e do lado direito e uma grande quantidade de ascite. A hemodinâmica da paciente se estabilizou após esse procedimento e ela conseguiu sair de todos os vasopressores. Ela foi então transportada diretamente para a sala de cirurgia com a equipe de Cirurgia vascular para um reparo emergente de sua veia ilíaca comum esquerda.
ela continuou a receber múltiplas transfusões de sangue durante o reparo. Posteriormente, ela foi transferida para a UTI cirúrgica com um abdome aberto que foi posteriormente reparado. A paciente acordou completamente neurologicamente intacta e recebeu alta em casa cinco semanas após sua lesão.
discussão residente
ACS é o ponto final de um espectro que começa com hipertensão intra-abdominal (IAH) e termina quando a pressão intra-abdominal excede 20 mmHg e é acompanhada por disfunção do órgão final.2 a pressão abdominal Normal, mesmo em pacientes críticos, deve ser < 12 mmHg. A IAH, que pode ser classificada em etapas, é definida como uma pressão de 12-25 mmHg sem a presença de disfunção orgânica.
existem vários tipos distintos de ACS. A SCA primária ocorre em traumas ou catástrofes cirúrgicas que resultam em um grande evento hemorrágico, como no caso apresentado.3 a SCA secundária ocorre quando pacientes de UTI são agressivamente ressuscitados com grandes volumes de cristaloides.4,5 causas secundárias menos comuns incluem lesões grandes que ocupam espaço, edema intestinal ou retroperitoneal e pancreatite. A SCA secundária é insidiosa e comumente é diagnosticada após um atraso, complicando ainda mais uma mortalidade já alta.4,5
a letalidade da SCA deve-se à perfusão de órgãos comprometida e posterior falência de órgãos. Nos rins, a diminuição da perfusão renal leva a congestão e oligúria, enquanto o aumento da pressão compartimental causa compressão direta do órgão.6,7 o aumento da resistência vascular esplânica resulta em edema intestinal, translocação de bactérias intestinais, hiperlactemia e sepse.6,7 a pré-carga cardíaca pode ser diminuída devido à compressão da veia cava inferior, causando diminuição do débito cardíaco, enquanto a pós-carga do ventrículo direito aumenta.7 a oxigenação é prejudicada à medida que o diafragma é empurrado cefaleia e a capacidade residual funcional diminui.7 a pressão intracraniana também aumenta como resultado da compressão venosa jugular que prejudica o retorno venoso. Clinicamente, o paciente apresentará hipotensão, hipóxia, lesão renal aguda, estado mental alterado, convulsões ou falta de resposta; eventualmente, o paciente experimenta colapso cardiovascular total.6-8
o padrão-ouro para o diagnóstico de SCA é a medição da pressão da bexiga indiretamente com um cateter urinário.9 para medir uma pressão precisa, o paciente deve estar em decúbito dorsal e a medida tomada na expiração final, com o transdutor zerado e alinhado com a crista ilíaca. Esta medida mostrou-se correlacionada com a pressão intra-abdominal medida diretamente.10 a medição das pressões da bexiga a cada 4-6 horas é adequada em pacientes críticos em risco de desenvolver SCA.
o esteio do tratamento para SCA é a laparotomia descompressiva, geralmente exigindo deixar o paciente com abdome aberto pós-operatório.11 outras medidas temporárias secundárias incluem sedação e analgesia, paralisia neuromuscular, descompressão do conteúdo intestinal com sonda Naso ou endogástrica, diuréticos e TRC.11,12
a mortalidade de SCA permanece elevada apesar da intervenção médica. Embora a laparotomia descompressiva efetivamente reduza imediatamente a pressão intra-abdominal, esse procedimento está associado a múltiplas comorbidades médicas com uma mortalidade que ainda permanece até 50%.13 Isso pode ser devido ao fato de que, no momento da laparotomia descompressiva, os pacientes estão gravemente doentes e o procedimento é considerado um último recurso.
Um segundo problema importante para a discussão, neste caso, é o dilema ético enfrentado pelos provedores de cuidados para este criticamente doente cujas crenças religiosas estavam em oposição ao tratamento padrão (produto sanguíneo transfusão) para sua doença. A paciente tinha documentação inicial em seu prontuário da conversa médico-paciente durante a qual declarou sua recusa consciente de hemoderivados. No entanto, ela não escreveu, documentação assinada do produto sanguíneo-recusa de transfusão no gráfico. Enquanto a paciente estava inconsciente e em extremis, seu marido, que não é uma testemunha de Jeová praticante, reverteu sua decisão na tentativa de salvar sua vida. Onde essa decisão cai no equilíbrio da autonomia versus o poder dos parentes mais próximos de decidir quais intervenções médicas um paciente deve receber? O que acontece quando o parente mais próximo toma uma decisão que é contra a escolha do paciente? Em situações de vida ou morte com dilemas éticos, onde a tomada de decisão rápida decidirá o resultado do paciente, como esse fardo pode ser colocado sobre os entes queridos?
o dilema ético, portanto, reside na ideia de que, embora a transfusão viole o valor da autonomia, cumpre simultaneamente o conceito ético de beneficência. Em geral, as diretivas pessoais do paciente devem ter precedência sobre quaisquer decisões tomadas pelo procurador médico. No entanto, a decisão da família de transfundir em nome do paciente inconsciente, como visto no caso atual, é legalmente apropriada, embora viole a autonomia do paciente.
o Comitê de ética foi consultado após o paciente já ter recebido uma transfusão maciça de hemoderivados e continuar recebendo mais transfusões de glóbulos vermelhos. O Comitê recomendou que o paciente não recebesse mais transfusões de hemoderivados, apesar do consentimento da parente mais próxima. O paciente acordou completamente neurologicamente intacto e foi informado das transfusões de sangue. Ela decidiu que no futuro ela só aceitaria plasma de banco de sangue e glóbulos vermelhos doados pela família durante um evento agudo. A paciente recebeu alta em casa cinco semanas após sua lesão iatrogênica.
diagnóstico FINAL
perfuração iatrogênica da veia ilíaca comum esquerda com síndrome do compartimento abdominal resultante.
pontos-chave de ensino
a SCA ocorre quando a pressão intra-abdominal está acima de 20 mmHg e o dano ao órgão final está presente.
a SCA primária é causada por trauma ou cirurgia, mas esteja atento à SCA secundária observada em ressuscitação maciça, especialmente em UTIs.
o padrão-ouro do diagnóstico de SCA é uma pressão medida da bexiga.
o tratamento é uma laparotomia, bem como medidas de temporização, como evacuação do conteúdo intestinal e/ou sedação e paralisia.O consentimento informado do paciente documentado e/ou a aprovação do Conselho de revisão Institucional foram obtidos e arquivados para publicação deste relato de caso.
Notas De Rodapé
Editor De Seção: Rick A. McPheeters, DO
texto completo disponível através de acesso aberto emhttp://escholarship.org/uc/uciem_cpcem
endereço para correspondência: Laura J. Bontempo, MD, MEd, University of Maryland, Department of Emergency Medicine, 110 S Paca Street, 6th Floor, Suite 200, Baltimore, MD 21201. E-mail: [email protected]. 2:103 – 108
Histórico de Submissão: revisão recebida 22 de janeiro de 2018; submetido 19 de Março de 2018; aceito 21 de Março de 2018
conflitos de interesse: Pelo associação digital, todos os autores são obrigados a divulgar todas as afiliações, fontes de financiamento e relações financeiras ou de gestão que possam ser percebidas como fontes potenciais de viés. Os autores não divulgaram nenhum.
1. Pafitanis G, Spyridon K, Theodorakopoulou e, et al. Um relato de caso da síndrome do compartimento abdominal causada pela má posição de um cateter venoso femoral. Int J Surg Case Rep. 2015;12:84-6.
2. Maluso P, Olson J, Sarani B. hipertensão do compartimento Abdominal e síndrome do compartimento abdominal. Crit Care Clin. 2016;32(2):213-22.
3. Morken J, West MA. Síndrome do compartimento Abdominal na unidade de terapia intensiva. Curr Opin Crit Care. 2001;7(4):268-74.
4. Biffl WL, Moore ee, Burch JM, et al. A síndrome do compartimento abdominal secundário é um evento altamente letal. Am J Surg. 2001; 182 (6): 645-8.
5. Burrows R, Edington J, Robbs JV. Um lobo em roupas de lobo: a síndrome do compartimento abdominal. S Afr Med J. 1995;85(1):46-8.
6. Caldwell CB, Ricotta JJ. Alterações no fluxo sanguíneo visceral com pressão intraabdominal elevada. J Surg Res. 1987;43(1):14-20.
7. Balogh Z, McKinley BA, Cox CS, et al. Síndrome do compartimento Abdominal: a causa ou efeito da falência de múltiplos órgãos pós-parto. Choque. 2003;20(6):483-92.
8. Vidal MG, Ruiz Weisser J, Gonzalez F, et al. Incidência e efeitos clínicos da hipertensão intra-abdominal em pacientes críticos. Crit Care Med. 2008;36(6):1823-31.
9. Kron IL, Harman PK, Nolan SP. A medida da pressão intra-abdominal como critério de reexploração abdominal. Ann Surg. 1984;199(1):28-30.
10. Aggi BH, Sugerman HJ, Ivatury RR, et al. Síndrome do compartimento Abdominal. J Trauma. 1998;45(3):597-609.
11. Kirpatrick AW, Roberts DJ, De Waele JD, et al. Hipertensão Intra-abdominal e síndrome do compartimento abdominal: definições de consenso atualizadas e diretrizes de prática clínica da Sociedade Mundial da síndrome do compartimento Abdominal. Cuidados Intensivos Med. 2013;39(7):1190-206.
12. Ouellet JF, Leppaniemi a, Ball CG, et al. Alternativas à descompressão abdominal formal. Am Surg. 2011; 77 (Sl): S51-7.
13. De Waele JJ, Hoste EA, Malbrain ML. Laparotomia descompressiva para síndrome do compartimento abdominal-uma análise crítica. Cuidado Crítico. 2006; 10 (2):R51.