- Introdução
- materiais e métodos
- coleta de ovos
- Ecdysteroid Quantificação
- quantificação hormonal Juvenil
- análises estatísticas
- resultados
- discussão
- ecdisteróides
- hormônio juvenil
- Declaração de disponibilidade de dados
- contribuições dos autores
- financiamento
- conflito de interesses
- agradecimentos
- Material Suplementar
Introdução
A radiação adaptativa dos insetos em diferentes climas tenha sido, em parte, facilitado pela repetida evolução da diapause, uma antecipação de desenvolvimento prisão com antecedência de condições desfavoráveis (por exemplo, no inverno, época de seca; Waterhouse e Norris, 1980; Tauber et al., 1986; Danks, 1987; Hodkova e Hodek, 2004). A diapausa é normalmente iniciada em resposta a uma sugestão ambiental simbólica (por exemplo,, mudança sazonal no fotoperíodo), mantido por um período geneticamente determinado e, em seguida, encerrado após o retorno de condições favoráveis. Assim, a diapausa permite que os insetos alinhem seu crescimento e reprodução com os ciclos sazonais locais (Tauber et al., 1986; Danks, 1987). A diapausa é um regulador chave da história de vida, alcance geográfico e abundância sazonal para muitos polinizadores de insetos (por exemplo, Kemp e Bosch, 2005; Fründ et al., 2013), pragas agrícolas (por exemplo, Pullin et al., 1991; Li et al., 2012; Levine et al., 2015), e vetores de doenças (por exemplo, Denlinger e Armbruster, 2014; Gray et al., 2016). Além disso, diapause invoca generalizada modificações fisiológicas, incluindo a acumulação de reservas de nutrientes, supressão da atividade metabólica, aumento do catabolismo anaeróbico, ciclo celular prisão, alterações na sinalização Wnt, e upregulation de vários mecanismos de tolerância ao estresse (Denlinger, 2002; Hahn e Denlinger, 2007, 2011; o Rei e MacRae, 2015; Ragland e Manter, em 2017. Compreender os mecanismos regulatórios subjacentes à diapausa é um problema de longa data na biologia organismal e facilitará o desenvolvimento de novas abordagens de manejo para espécies-chave.
ecdisteróides e hormônios juvenis regulam uma ampla gama de processos fisiológicos e de desenvolvimento em insetos (Gruntenko e Rauschenbach, 2008; Jindra et al., 2013; Palli, 2016), incluindo diapausa (Denlinger, 1985; Denlinger et al., 2012). O sinal hormonal específico que regula a diapausa tende a variar de acordo com o estágio em que ocorre a parada do desenvolvimento (Denlinger et al., 2012). Por exemplo, a parada do desenvolvimento durante a diapausa larval ou pupal é normalmente regulada por mudanças na abundância ecdisteróide (por exemplo, Ohtaki e Takahashi, 1972; Bowen et al., 1984; Richard et al., 1987). Em contraste, a parada do desenvolvimento durante a diapausa adulta é frequentemente regulada por mudanças na abundância hormonal juvenil (por exemplo, Spielman, 1974; Schooneveld et al., 1977; Saunders et al., 1990 e ver revisão em Denlinger et al., 2012).
existe uma grande lacuna em nossa compreensão da regulação hormonal da diapausa embrionária, que é amplamente observada em Lepidoptera, Orthoptera, Hemiptera e Diptera. Pesquisas anteriores documentaram extensivamente a regulação endócrina da diapausa embrionária na traça do bicho-da-seda (Bombyx mori) pelo hormônio diapausa (Hasegawa, 1963; Yamashita e Hasegawa, 1966; Yamashita, 1996). No entanto, esse papel regulatório para o hormônio da diapausa parece ser exclusivo de B. mori e, portanto, forneceu pouca visão sobre a base hormonal da diapausa embrionária em outras espécies (Denlinger et al., 2012). Além de B. mori, a regulação hormonal da diapausa embrionária foi estabelecida em apenas três espécies. A mariposa cigana (Lymantria dispar) sofre uma prisão de desenvolvimento iniciada e mantida por maior abundância de ecdisteróides (Lee et al., 1997; Lee e Denlinger, 1997) enquanto a baixa abundância ecdisteróide regula a diapausa em dois gafanhotos( Chortoicetes terminifera, Locusta migratoria; Gregg et al., 1987; Tawfik et al., 2002).
até o momento, nenhum estudo caracterizou a abundância hormonal durante a diapausa embrionária de qualquer espécie Dipterana. Aqui, abordamos essa lacuna investigando a regulação hormonal da diapausa embrionária no mosquito tigre asiático, Aedes albopictus. Nos últimos 30 anos, este vetor medicamente importante (Paupy et al., 2009) invadiu com sucesso regiões temperadas em todo o mundo (Benedict et al., 2007) devido em parte a uma diapausa embrionária que facilitou a sobrevivência durante o transporte de longa distância (Juliano e Lounibos, 2005; Diniz et al. 2017) e evoluiu rapidamente para alinhar o momento da parada do desenvolvimento com as condições climáticas locais (Urbanski et al., 2012). Populações temperadas de Ae. albopictus entra em uma diapausa fotoperiódica regulada maternalmente. Em dias curtos e outonais, as fêmeas produzem ovos que completam o desenvolvimento embrionário, mas permanecem refratários a estímulos de eclosão como larvas faráticas dentro do córion do ovo até a primavera seguinte. Na última década, a regulação transcricional da diapausa embrionária na Ae. albopictus tem sido amplamente caracterizado (Urbanski et al., 2010; Poelchau et al., 2011, 2013a, B; Huang X. et al., 2015; Batz et al., 2017), mas a regulação hormonal dessa adaptação crucial permanece desconhecida. Nós quantificados 20-hydroxyecdysone (20ELE) e hormônio juvenil III (JH3) em diapausing e não diapausing ovos em três pontos de suporte principais fases do desenvolvimento embrionário e interpretados nossos resultados no contexto da coletados anteriormente RNAseq (Poelchau et al., 2013a, b) e dados manipulativos (Suman et al., 2015).
materiais e métodos
coleta de ovos
todas as medições usaram ovos F11 de uma colônia de laboratório de Ae. albopictus estabelecido em agosto de 2015 a partir de mais de 200 larvas coletadas em Manassas, VA, Estados Unidos. Antes deste experimento, a população foi mantida sob condições descritas anteriormente . Para gerar amostras de ovos para este experimento, as larvas de F10 foram mantidas em recipientes de Esterlita de 5,5 L a uma densidade de aproximadamente 250 larvas por 2.5 L deionizado (DI) água com 5 mL de pasta de alimentos (Armbruster e Conn, 2006) sob fotoperíodo LD a 21°C e 80% RH. Todas as segundas–quartas-sextas-feiras, as larvas eram filtradas através de uma rede de malha fina, em seguida, transferidas para um recipiente limpo de 5,5 L de Esterlina; as pupas eram distribuídas para gaiolas adultas mantidas sob Fotoperíodo de diapausa ou Fotoperíodo de diapausa (SD, 8:16 L:D).
as fêmeas adultas receberam sangramentos semanais e um copo de oviposição forrado com toalha de papel não branqueada e meio cheio de água DI até que a oviposição cessasse. Os ovos foram coletados diariamente, mantidos em uma toalha de papel úmida por 48 h, depois secos ao ar e armazenados em recipientes sob condições de DP. 5, 7 e 11 dias pós-oviposição (dpov), coletados ovos foram pesados para o mais próximo de 1 µg (média: 11.460 mg, alcance: 9.1–de 19,5 mg) em um MX5 microbalance (Mettler-Toledo, Columbia, OH, Estados Unidos), colocados em tubos de 1,5 mL, snap-congelado em nitrogênio líquido entre 11 e 12 horas (Zeitgeber tempo 3-4 h), e armazenadas a -80°C. Um subconjunto de ovos foi mantido para confirmar que as condições de Fotoperíodo LD e SD estimularam a produção de ovos não diapausa e diapausa, respectivamente (ver Urbanski et al., 2012).
nós amostramos ovos em 5, 7 e 11 dpov por duas razões. Primeiro, Ae. albopictus inicia a diapausa (sensu Koštál, 2006; Koštál et al., 2017) após a conclusão do desenvolvimento embrionário (Mori et al., 1981). Sob as condições utilizadas em nossos experimentos, Ae. os embriões de albopictus sofrem segmentação em aproximadamente 5 dpov e os embriões não diapausa são competentes para eclodir em aproximadamente 7 dpov (Poelchau et al., 2013a). Em 11 dpov, a parada do desenvolvimento está firmemente estabelecida em embriões de diapausa (Poelchau et al., 2013b). Assim, optou-se por comparar embriões de diapausa e não diapausa em pontos temporais entre o período de competência para eclosão, incluindo o estabelecimento de parada do desenvolvimento durante a diapausa. Em segundo lugar, escolhemos pontos de tempo semelhantes aos usados para experimentos rnaseq anteriores de embriões (Poelchau et al., 2013a, b) para que esses dados possam ser aproveitados para interpretar nossos resultados atuais. Estes resultados de RNAseq foram encontrados previamente para ser bem correlacionados com os resultados da expressão genética obtidos através de qRT-PCR (Poelchau et al., 2013a).
Ecdysteroid Quantificação
Para extrair ecdysteroids, amostras de ovos foram colocados em um vidro de borosilicato de 0,5 mL cónico de fundo de micro tecido moinho de tubo (Wheaton, Millville, NJ, Estados Unidos) com 1 µg de farnesol (Sigma-Aldrich, St. Louis, MO, Estados Unidos) adicionado como um padrão interno. Os ovos foram homogeneizados manualmente três vezes com um pilão de Teflon em 300 µL HPLC-grade refrigerada MeOH então girou em 12.000 RCF por 10 min em uma centrífuga refrigerada (4°C). O sobrenadante resultante foi agrupado em seguida, eluído através de colunas de óxido de alumínio duas vezes com meoh 90% refrigerado e uma vez com MeOH. As amostras foram secas em uma centrífuga a vácuo refrigerada (4°C), ressuspendidas em 20 µL de MeOH e armazenadas a -80°C até a análise. Os controles positivos foram preparados adicionando 1 µg cada de 20he (Sigma-Aldrich) e farnesol aos tubos vazios que foram processados de outra forma de forma idêntica. A análise amostral da concentração de ecdisteróides foi realizada usando um Micromass Quattro micro LC-MS / MS (Waters Co., Milford, MA, Estados Unidos). Os volumes de injeção foram de 5,0 µL, com separações realizadas utilizando colunas ACQUITY UPLC BEH C18 2,1 mm por 50 mm com uma fase estacionária de 1,7 µm (Waters Co.). As condições de operação para corridas de LC foram uma taxa de fluxo de fase móvel de 0,37 mL min – 1 com uma fase móvel binária de ácido fórmico a 0,1% em acetonitrila e ácido fórmico a 0,1% em água. As condições iniciais foram 1: 99 acetonitrila: água, seguida de fluxo isocrático por 0,3 min. A 0,3 min, um gradiente linear de 1:99 a 99: 1 acetonitrila: a água foi aplicada em 4,2 min, seguida por 1,0 min fluxo isocrático em 99: 1 acetonitrila: água, após o qual a fase móvel retornou a 1:99 acetonitrila:água. Espectrômetro de massa definições foram electrospray positivo, com um desolvation temperatura de 350°C. 20ELE e farnesol eluídas em 2.89 e 4.97 min, respectivamente, e foram quantificados utilizando vários reação de monitoramento da característica transições: 481.22 (m/z) > 445.24 (m/z), e 205.41 (m/z) > 121.09 (m/z), respectivamente. O limite de detecção do ensaio é de aproximadamente 5 pg.
quantificação hormonal Juvenil
cada amostra de ovo foi colocada em um vidro de borosilicato 0,5 mL tubo de moedor de micro tecido de fundo cônico (Wheaton) com 1 µg de farnesol (Sigma-Aldrich) adicionado como padrão interno. Os ovos foram homogeneizados manualmente três vezes com um pilão de Teflon em hexano refrigerado de grau HPLC de 500 µL, depois girados a 12.000 RCF por 10 min em uma centrífuga refrigerada (4°C). As frações de hexano foram recombinadas em um frasco de vidro de borosilicato limpo e secas por centrifugação A Vácuo. JH foi quantificado usando cromatografia gasosa / espectrometria de massa conforme descrito anteriormente (Brent e Vargo, 2003). Resumidamente, o resíduo foi lavado dos frascos com três enxaguamentos de hexano e adicionado a colunas de vidro de borosilicato preenchidas com óxido de alumínio. Para filtrar contaminantes, as amostras foram eluídas através das colunas sucessivamente com hexano, 10% éter etílico-hexano e 30% éter etílico-hexano. Após a secagem, as amostras foram derivatizadas por aquecimento a 60 ° C por 20 min em uma solução de álcool metil-d (Sigma-Aldrich) e ácido trifluoroacético (Sigma-Aldrich). As amostras foram secas, ressuspendidas em hexano e novamente eluídas através de colunas de óxido de alumínio. Os componentes não derivatizados foram removidos com éter etílico a 30%. O derivado JH foi coletado em novos frascos por adição de 50% de etil-acetato–hexano. Após a secagem, as amostras foram ressuspendidas em hexano e, em seguida, analisadas usando um HP 7890A Series GC (Agilent Technologies, Santa Clara, CA, Estados Unidos) equipado com uma coluna de cera ZEBRON ZB de 30 m × 0,25 mm (Phenomenex, Torrance, CA, Estados Unidos) acoplada a um detector seletivo de massa inerte HP 5975C. O hélio foi usado como gás transportador. A forma de JH foi confirmada pela primeira vez executando amostras de teste em Modo de varredura para assinaturas conhecidas de JH 0, JH I, JH II, JH3 e JH3 ethyl; JH3 foi confirmado como a forma endógena primária nesta espécie. As amostras subsequentes foram analisadas usando o modo MS SIM, monitorando em m / z 76 e 225 para garantir especificidade para o derivado D3-metoxidrina de JH3. A abundância Total foi quantificada em relação a uma curva padrão de JH3 derivatizada e ajustada para a massa inicial de ovos. O limite de detecção do ensaio é de aproximadamente 1 pg.
análises estatísticas
análises foram realizadas em R (R Core Team, 2019). A abundância de JH3 foi log-transformada e analisada usando ANOVA para testar os efeitos do status da diapausa, idade e sua interação. 20A abundância foi não linear e ajustada usando dois modelos de regressão polinomial: um modelo completo incluindo idade e estado de desenvolvimento (diapausa, não diapausa) e um modelo reduzido contendo apenas idade. Os modelos foram comparados usando ANOVA para determinar se a inclusão do status de desenvolvimento melhorou significativamente o poder explicativo.
as análises transcricionais utilizaram dados rnaseq coletados anteriormente de diapausa e não diapausa Ae. ovos de albopictus (conjunto de dados suplementar 1; Poelchau et al., 2013A, b). Genes diferencialmente expressos em 3, 6 e 11 dpov foram investigados por análises de enriquecimento de conjunto de genes (Mootha et al., 2003) usando o pacote de Piano (Väremo et al., 2013) defina os parâmetros padrão seguidos pela correção FDR. Um conjunto de genes de referência foi anotado com os Termos do processo biológico Go atribuídos à VectorBase (Giraldo-Calderón et al., 2015). Os genes da via de síntese de JH3 e ecdisteróides, bem como os receptores JH3 e os genes de degradação foram anotados manualmente de acordo com a literatura anterior (Bai et al., 2007; Li et al., 2011; Nouzova et al., 2011; Niwa e Niwa, 2014; Matthews et al., 2016). Além disso, anotamos genes indutores de JH3 e ecdisteróides com base nas descrições genéticas fornecidas na VectorBase (Giraldo-Calderón et al., 2015). Uma visão geral completa desses conjuntos de genes é fornecida no conjunto de dados suplementar 1.
resultados
a incidência média de diapausa foi de 95,9% (intervalo: 90,5–100%) sob fotoperíodo SD e 5.4% (Intervalo: 1,8–9,5%) sob fotoperíodo LD (conjunto de dados suplementar 2); assim, nossos tratamentos fotoperiódicos induziram as respostas esperadas da diapausa. 20ele atingiu o Pico nas condições de diapausa e não diapausa em 7 dpov,mas incluir o status de diapausa como fator em um modelo quadrático para 20ele abundância não melhorou o poder explicativo do Modelo (Figura 1a e conjunto de dados suplementar 3; F3, 43 = 0,21, p = 0,890). Esses resultados indicam que o status da diapausa não explica significativamente a variação no título 20HE. A análise da via de RNAseq indicou que nem a via de síntese de 20HE nem os genes induzíveis por 20HE foram significativamente alterados sob condições de diapausa vs. não diapausa em 3, 6 ou 11 dpov (Tabela 1).

Tabela 1. Resultados da análise de enriquecimento do conjunto de genes, consulte o conjunto de dados suplementar 1 para obter um resumo completo desses conjuntos de genes.
JH3 foi confirmado como a principal forma de hormônio juvenil nesta espécie. A abundância de JH3 foi significativamente reduzida em embriões de diapausa (figura 1b e conjunto de dados suplementar 3; F1,64 = 5,08, p = 0,028). No entanto,a idade (F2, 64 = 0,66,p = 0,518) e a interação do status e idade da diapausa (F2, 64 = 0,13, p = 0,883) não afetaram os níveis de JH3. A análise de Via dos dados de RNAseq indicou que a via de síntese de JH3 foi significativamente reprimida em 3 dpov e os genes induzíveis por JH foram significativamente reprimidos em 6 dpov (Figura 2 e Tabela 1).
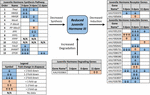
Figura 2. Resumo da expressão diferencial de genes envolvidos na síntese, degradação e indução de JH3 para EA. albopictus (Poelchau et al., 2013A, b). Reduções significativas induzidas pela diapausa (azul) ou aumentos (laranja) são indicadas por células sombreadas. A magnitude diferencial é indicada por setas conforme descrito na legenda no canto inferior esquerdo. ∗Genes sem nomes comuns são identificados pelo número de identificação da VectorBase.
discussão
a diapausa é uma adaptação generalizada que permite que os insetos alinhem seu crescimento e reprodução com condições sazonalmente favoráveis (Tauber et al., 1986; Danks, 1987). Compreender as mudanças hormonais pelas quais os insetos coordenam a percepção de pistas externas induzidas pela diapausa com os mecanismos fisiológicos que levam à parada do desenvolvimento é um objetivo de longa data na biologia (Lees, 1956; Denlinger, 2002). Décadas de pesquisa levaram à identificação de estratégias hormonais comuns para a diapausa nos estágios larval, pupal e adulto; no entanto, a regulação hormonal da diapausa embrionária permanece amplamente desconhecida, particularmente em Diptera (Denlinger, 1985, 2002; Denlinger et al., 2012). Neste estudo, nossa medição direta da abundância reduzida de JH3 na diapausa é corroborada pelo perfil de expressão gênica anterior (Poelchau et al., 2013A, b) e experimentos manipulativos (Suman et al., 2015) apoiando a hipótese de que o JH3 regula a diapausa embrionária nesta espécie.
ecdisteróides
no presente estudo, medimos diretamente a abundância de ecdisteróides em três pontos de tempo sob condições de diapausa e não diapausa em embriões do mosquito Ae. albopictus. Consistente com os resultados anteriores de Toxorhynchites amboinensis (Russo e Westbrook, 1986), 20ELE níveis de pico perto da conclusão do desenvolvimento embrionário (7 dpov; Figura 1A). No entanto, o título 20HE não diferiu significativamente entre os ovos de diapausa e não diapausa. Além disso, nem a via de síntese de 20HE nem os genes induzíveis por 20HE sofreram alterações significativas e coordenadas na expressão gênica (Tabela 1). Concluímos que, em contraste com as diapausas embrionárias previamente examinadas em Lepidoptera e Orthoptera (Hasegawa, 1963; Yamashita e Hasegawa, 1966; Gregg et al., 1987; Yamashita, 1996; Lee and Denlinger, 1997; Lee et al., 1997; Tawfik et al., 2002), 20ELE não regula a iniciação da diapausa no Ae. albopictus.
hormônio juvenil
em contraste, observamos uma abundância aproximadamente duas vezes menor de JH3 em embriões de diapausa (figura 1b). Embora menor em magnitude do que as diferenças na abundância de JH3 detectadas sob diapausa vs. condições de não diapausa em insetos que diapausa em outros estágios da vida (por exemplo, Yin e Chippendale, 1979; Walker e Denlinger, 1980; Readio et al., 1999), nossas medidas diretas são corroboradas por evidências transcricionais (Figura 2). Por exemplo, a via de síntese JH3 é significativamente reprimida durante a preparação precoce da diapausa (3 dpov). Apoiando nossa interpretação desses resultados, estudos anteriores descobriram que a expressão reduzida de genes ao longo da via de síntese JH3 está fortemente correlacionada com a menor abundância de JH3 em ambos Aedes aegypti (Nouzova et al., 2011; Rivera-Perez et al., 2014) e Diploptera punctata (Huang J. et al., 2015). Os genes induzíveis por JH também são significativamente reprimidos durante a preparação tardia da diapausa (6 dpov; Tabela 1), sugerindo que os embriões destinados à diapausa têm uma capacidade limitada de responder à sinalização JH3 perto do momento em que os embriões não diapausa se tornam competentes para eclodir. Além disso, a expressão do gene para um JH3 degradantes de enzima (JH esterase) é significativamente upregulated no início de diapause de manutenção (11 dpov; Figura 2), bem como, mais tarde, em diapause de manutenção (21 e 40 dpov; Poelchau et al., 2013b) sugerindo que o JH3 pode permanecer em baixa abundância em toda a diapausa nesta espécie.
a abundância reduzida de JH3 durante a parada do desenvolvimento é um tanto contra-intuitiva porque o baixo título de hormônio juvenil é tipicamente associado a mudas progressivas, particularmente do estágio larval ao pupal (Palli, 2016). No entanto, a aplicação de um análogo JH3 (pyriproxyfen) para diapausa Ae. os ovos de albopictus aceleram a taxa de terminação da diapausa de maneira dependente da dose (Suman et al., 2015). Na dosagem mais eficaz, aproximadamente 80% dos ovos expostos a piriproxifeno terminam a diapausa em 30 dpov em comparação com apenas 1% de terminação da diapausa em 80 dpov para ovos de controle (Suman et al., 2015). Alterações na abundância de JH3 também podem gerar um fenótipo embrionário semelhante à diapausa em outras espécies. Por exemplo, em B. mori, redução experimental da síntese de JH3 por nocaute de JHAMT resulta em larvas de farato totalmente desenvolvidas que não respondem a estímulos de eclosão; este fenótipo pode ser resgatado de maneira dependente da dose por aplicação de JH3 extraído ou metopreno, um análogo de JH3 (Nakao et al., 2015). Da mesma forma, a suplementação experimental de outro análogo hormonal juvenil (RO-20-3600) para ovos de Drosophila melanogaster recém-depositados produz larvas de farato que são móveis dentro do ovo, mas não eclodem (Smith e Arking, 1975). Juntos, esses dados indicam que a abundância hormonal juvenil provavelmente contribui para a regulação das respostas de eclosão em diversos insetos. A diapausa embrionária no estágio larval do farato é definida por uma falha em responder aos estímulos de eclosão, portanto, alterações na abundância hormonal juvenil podem representar uma estratégia hormonal comum para regular essa forma de diapausa.
em conjunto com dados transcricionais e manipulativos anteriores, nossos resultados implicam fortemente uma abundância reduzida de JH3 como o provável regulador da diapausa embrionária em Ae. albopictus. Esta pesquisa é a primeira quantificação direta da abundância hormonal durante a diapausa embrionária em qualquer espécie Dipterana e representa um passo importante para esclarecer a regulação hormonal dessa adaptação crucial a ambientes adversos. Caracterizar a ligação entre estímulos externos e parada do desenvolvimento via sinalização hormonal continua sendo um grande desafio (Denlinger, 1985; Denlinger et al., 2012). A elucidação desses caminhos em uma variedade de espécies fornecerá uma visão crítica para problemas fundamentais e aplicados, incluindo a compreensão da Base molecular e fisiológica da evolução da história de vida, a previsão de respostas de espécies às mudanças climáticas e a identificação de novos alvos para o manejo de Pragas e espécies vetoriais (Denlinger, 2008).
Declaração de disponibilidade de dados
todos os conjuntos de dados gerados para este estudo estão incluídos no artigo/Material suplementar.
contribuições dos autores
ZB, CB e AF contribuíram para a concepção, desenho do estudo e elaboração do esboço inicial do manuscrito. ZB, MM e JS realizaram a criação de animais e coletaram as amostras de ovos. A CB realizou as análises LC-MS / MS e GC-MS. A ZB realizou as análises estatísticas. Todos os autores contribuíram para a revisão do manuscrito e aprovaram a versão submetida.
financiamento
este trabalho foi apoiado pelos Institutos Nacionais de saúde (1r15a|111328-01) e pela doação da família Davis à AF.
conflito de interesses
os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
agradecimentos
agradecemos a Allan Knopf e Dan Langhorst pela assistência na medição dos títulos hormonais. Agradecemos também a David Denlinger por comentários úteis sobre versões anteriores do manuscrito. O uso de nomes comerciais ou produtos comerciais neste artigo é exclusivamente para fins de fornecer informações específicas e não implica recomendação ou endosso do Departamento de Agricultura dos Estados Unidos. O USDA é um provedor e empregador de oportunidades iguais.
Material Suplementar
R Core Team (2019). R: uma linguagem e ambiente para computação estatística. Viena: R Core Team.
Google Scholar
Väremo, L., Nielsen, J., e Nookaew, I. (2013). Enriquecendo a análise do conjunto genético de dados em todo o genoma, incorporando direcionalidade da expressão gênica e combinando hipóteses e métodos estatísticos. Ácidos Nucleicos Res. 41, 4378-4391. doi: 10.1093 / nar / gkt111
PubMed Abstract / CrossRef Full Text / Google Scholar