introdução
Kruppel-like factor 4 (KLF4) é um membro da família do fator de transcrição zinco-dedo,que é expresso em vários tecidos humanos. É bem conhecido como um dos quatro fatores da indução para células-tronco pluripotentes (iPSCs) (Ghaleb e Yang, 2017). KLF4 pode regular vários processos biológicos importantes, como neuroinflamação, estresse oxidativo, proliferação, diferenciação e apoptose (Kaushik et al., 2010; Mamonkin et al., 2013; Zhang et al., 2015; Miao et al., 2017; Xu et al., 2017). Quantidades de estudos anteriores focaram no papel da KLF4 no desenvolvimento e progressão do câncer (Karam et al., 2017; Yadav et al., 2018). KLF4 é um fator de transcrição de dupla função, que pode exercer seu papel como oncogene ou gene supressor de tumor, dependendo do tipo de câncer ou estágio de câncer (Evans e Liu, 2008). Pode ativar ou inibir a transcrição de genes envolvidos na proliferação celular, diferenciação e apoptose (Ding et al., 2015). KLF4 pode colaborar com outros fatores de reprogramação para converter as células somáticas em iPSCs e inibir a diferenciação de células-tronco (Takahashi e Yamanaka, 2006; van Schaijik et al., 2018). Isso fornece perspectivas terapêuticas para doenças vasculares, doenças imunológicas, anorexia e outras doenças (Imbernon et al., 2014; Liu Y. et al., 2015; Murgai et al., 2017). Além disso, o KLF4 pode desempenhar um papel amplamente regulatório no sistema nervoso central (SNC). Vários estudos indicam que o KLF4 Está ligado a vários distúrbios neurológicos, incluindo doença de Alzheimer (da), epilepsia, doença de Parkinson, hidrocefalia e esquizofrenia (Qin et al., 2011; Xie et al., 2013; Han et al., 2015; Nishiguchi et al., 2015; Li L. et al., 2017).
A DA é uma das doenças neurodegenerativas crônicas mais comuns, o que leva a deficiências cognitivas e de memória, vários sintomas mentais e anormalidade comportamental e demência progressiva é a característica clínica mais comum (Jiang et al., 2018). Os fatores patogênicos confirmados atuais da da incluem a formação de placas senis induzidas por deposição anormal de amilóide-β (Aß) e os emaranhados neurofibrilares ou neurite distrófica induzida por acumulação de tau (Querfurth e LaFerla, 2010; Shinohara et al., 2014). Além disso, a da também pode ser afetada por fatores genéticos. No entanto, a patogênese elicit ainda é obscura. Os medicamentos mais prevalentes para o tratamento da DA incluem potenciadores de neurotransmissores, agentes anti-amilóides, peptídeos neuroprotetores e outros medicamentos (Cacabelos, 2018). Notavelmente, vários estudos mostraram que o KLF4 desempenhou um papel significativo na patogênese da da. Nesta revisão, focamos no papel regulador do KLF4 na neuroinflamação, apoptose neuronal, regeneração axonal e acúmulo de ferro para explicar a associação entre KLF4 e a patogênese da DA, o que pode fornecer insights sobre os mecanismos celulares e moleculares dos distúrbios neurodegenerativos.
as características biológicas do KLF4
KLF4 é uma proteína nuclear contendo zinco, isolada da biblioteca NIH 3T3 e localizada no núcleo celular. Foi identificado pela primeira vez e caracterizado por Shields et al. (1996). A massa molecular do KLF4 humano é 55kD e está localizada no cromossomo 9q31. KLF4 cobre um segmento de gene de 6,3 kb e tem cinco exons. Sua região codificadora de cDNA codifica um polipeptídeo que consiste em 470 resíduos de aminoácidos (ainda et al., 1998; Ghaleb and Yang, 2017). O terminal carboxi de KLF4 tem uma região de estrutura de ligação de DNA contendo três estruturas de dedo de zinco do tipo Cys2His2 (C2H2), que são formadas por 81 aminoácidos altamente conservados. Regula a transcrição por alta afinidade com elementos CACCC e sequências de DNA de genes alvo ricos em GC (Shields e Yang, 1998; Pearson et al., 2008). A maioria dos locais de ligação ao DNA de KLF4 estão localizados dentro da região do dedo de zinco, incluindo domínio de ativação de transcrição N-terminal para proteínas interagindo, estrutura do dedo de zinco C-terminal para ligação ao DNA e zona de inibição de transcrição (Bieker, 2001). KLF4 está envolvido na regulação da expressão de muitos genes endógenos (Shields e Yang, 1998). Existe um domínio regulatório transcricional altamente variável no terminal amino do KLF4. Os resíduos de aminoácidos localizados entre o 91 e o 117 amino constituem um domínio de ativação transcricional, que é rico em prolina e serina, enquanto um domínio de repressão transcricional também existe. Portanto, KLF4 tem dois efeitos adversos: ativar e inibir a transcrição gênica (Yet et al., 1998; Wei et al., 2006).
durante o desenvolvimento embrionário, o KLF4 foi maior expresso no estágio final do desenvolvimento embrionário. Enquanto em tecidos e órgãos maduros, KLF4 é expresso principalmente no trato gastrointestinal, cavidade oral, epiderme da pele, endotélio vascular e rim, e é menos expresso no cérebro (Segre et al., 1999; Ghaleb et al., 2011; Liu et al., 2013; Chen et al., 2015; ele et al., 2015; Bin et al., 2016). Acredita-se que desempenhe um papel significativo na regulação da proliferação e diferenciação celular. Além disso, o KLF4 também pode regular o ciclo celular. KLF4 pode ativar P21 de maneira dependente de P53 (Zhang et al., 2000). Além disso, verificou – se que as células KLF4 ( – / – ) entraram na fase de senescência mais cedo do que as células KLF4 ( + / + ), o que pode ser explicado pela expressão gênica menos antioxidante e pelo nível mais alto de espécies reativas de oxigênio (ROS) nas células KLF4 ( – / -). ROS pode aumentar a expressão de p53 e p21 e, posteriormente, promover o dano ao DNA (Liu C. et al., 2015). Verificou-se que o PRMT5 pode elevar a expressão de KLF4 nos níveis de proteína. PRMT5 foi relatado para aumentar a transcrição de p21 e diminuir a expressão de bax via inibição da ubiquitilação KLF4 (Hu et al., 2015). Além disso, numerosos estudos demonstraram que o KLF4 está envolvido na regulação da apoptose dos neurônios (Kong et al., 2016; Cui et al., 2017; Canção et al., 2018). O papel regulatório fisiológico do KLF4 que conhecemos ainda é pouco e são necessárias mais investigações.
papel do KLF4 na da
está bem estabelecido que a DA é caracterizada principalmente por deficiências de memória e cognitivas e disfunção executiva (Goedert e Spillantini, 2006). Muitos estudos demonstraram que a apoptose neuronal e a disfunção sináptica são bases patológicas do declínio da função cognitiva (Caccamo et al., 2017; Guo et al., 2017; Yoon et al., 2018). O dano acumulado da deposição de Aß, estresse oxidativo e acúmulo de ferro pode levar à disfunção neuronal e apoptose de pacientes com da. Vários estudos mostraram que o papel regulatório da KLF4 parece ser crucial no SNC. Considerando que KLF4 foi relatado para regular apoptose neuronal, regeneração sináptica, estresse oxidativo e neuroinflamação, a relação entre KLF4 e a patogênese da DA pode ser um novo alvo potencial para o tratamento da da.
papel do KLF4 na neuroinflamação
quantidades de estudos clínicos mostraram que Aß pode se agregar e é o principal componente dos depósitos extracelulares do tecido cerebral de pacientes com DA, o que pode prejudicar as sinapses e neurônios circundantes e levar à morte neuronal. Secreção anormal ou produção excessiva de Aß leva a alterações patológicas da da, então a deposição de Aß é o elo central da da (Rajmohan e Reddy, 2017). Além disso, estudos mostraram que a deposição excessiva de Aß pode estimular as células gliais a secretar ROS e outros fatores de influência, levando ao estresse oxidativo. Sabe-se que o estresse oxidativo pode estimular a produção de Aß. Portanto, Aß e o estresse oxidativo podem interagir entre si e afetar a progressão da da (Cheignon et al., 2018).
KLF4 foi relatado como um modulador potencial e tem um grande efeito na inflamação mediando macrófagos e células endoteliais (Figura 1) (Yoshida et al., 2014; Kapoor et al., 2015; Yang et al., 2018). No SNC, reações inflamatórias excessivas e crônicas podem causar danos ao neurônio e ao neurogliócito. Recentemente, foi demonstrado que a expressão KLF4 se correlacionou positivamente com a neuroinflamação induzida por Aß42. Nas células BV2 microgliais, a Aß42 oligomérica pode aumentar a expressão de KLF4, que é mediada por p53 ativado (Li L. et al., 2017). Sob condições inflamatórias, como o acúmulo de Aß, a liberação de citocinas pró-inflamatórias pode ser estimulada na geração de da (Griffin and Barger, 2010). A potência de neurotoxicidade e a potência pró-inflamatória dos oligômeros Aß42 solúveis são relativamente maiores do que o depósito de fibra insolúvel (Selkoe, 1991; Weinberg et al., 2018). O silêncio de KLF4 é capaz de restaurar a neuroinflamação mediada por Aß42, e a superexpressão de KLF4 pode exacerbar a neuroinflamação mediada por Aß42 (Li L. et al., 2017). O acúmulo de Aß induz a ativação de astrócitos e microglia (Rodríguez et al., 2016). Os astrócitos ativados podem aumentar a neuroinflamação liberando fatores pró-inflamatórios como IL-1, IL-6 e TNF-α (Rubio-Perez e Morillas-Ruiz, 2012; Doméné et al., 2016). O ciclo vicioso de respostas inflamatórias eventualmente leva à disfunção e apoptose neuronal.
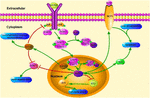
FIGURA 1. Schematicillustration de klf4 caminhos de sinalização relacionados. Esta figura destaca o papel do KLF4 na neuroproteção e regeneração de axônios. As setas na figura indicam ativação ou promoção, e as linhas retas indicam inibição relacionada. KLF4, fator semelhante a Kruppel 4; STAT3, transdutor de sinal e ativador da transcrição 3; JAK, Janus quinase; SOCS3, supressor da sinalização de citocinas 3; HCP1, proteína transportadora heme 1; ERK5, proteína quinase ativada por mitogênio 5.
o KLF4 desempenha um papel crucial na regulação dos sinais pró-inflamatórios. Em células gliais, a ativação klf4 induzida por gemfibrozil aumenta o supressor do sinal de citocina 3 (SOCS3) via Via Via PI3-quinase-AKT (Ghosh e Pahan, 2012). O knockdown mediado por SiRNA de KLF4 poderia atenuar o nível de SOCS em astroglia e microglia de camundongos, o que poderia afetar subsequentemente a expressão do gene inflamatório (Kaushik et al., 2010; Ghosh e Pahan, 2012). Além disso, a deleção de SOCS pode promover a sobrevivência de neurônios lesionados e promover a regeneração de axônios (Smith et al., 2009; Sun et al., 2011). E KLF4 regula positivamente a produção de IL-1β ou outros marcadores pró-inflamatórios. Regula positivamente a ciclooxigenase – 2 (Cox-2) e regula negativamente a óxido nítrico sintase induzível (iNOS) (Kaushik et al., 2013). Além disso, o KLF4 é um importante fator regulador para a diferenciação de monócitos e um alvo potencial para a regulação imunológica (Alder et al., 2008). Portanto, o KLF4 pode promover neuroinflamação regulando esses reguladores negativos.
vale ressaltar que, no modelo da doença de Parkinson, o KLF4 pode promover estresse oxidativo e neurotoxicidade induzidos por MPP+e, em seguida, aumentar a apoptose neuronal e retardar a proliferação celular (Chen et al., 2013). O estresse oxidativo é um desequilíbrio entre peroxidação e antioxidação. Os radicais livres podem causar alterações em diferentes macromoléculas, levando a danos celulares, envelhecimento celular e danos aos tecidos (Parajuli et al., 2013; Nie et al., 2015). O estresse oxidativo pode agravar a inflamação precoce e a produção de Aß e, em seguida, agravar a da (Cai et al., 2011). Portanto, KLF4 pode estar envolvido no estresse oxidativo na da.
esses achados implicam em KLF4 um papel fundamental na mediação da neuroinflamação, ativando a microglia e consequentemente a liberação de citocinas pró-inflamatórias. Tem potencial para aumentar a neuroinflamação. Até agora, muitos estudos sobre a patogênese da DA se concentraram na neuroinflamação. Como um alvo potencial para a regulação imunológica, o KLF4 pode promover as respostas inflamatórias da microglia, afetando os reguladores negativos relacionados, O que tem um grande efeito no desenvolvimento da da.
papel do KLF4 na apoptose
as alterações neurodegenerativas incluem perda gradual de neurônios e sinapses nas regiões cerebrais representativas, como o córtex cerebral, hipocampo e outras regiões subcorticais. As deficiências funcionais do SNC induzidas pela perda neuronal são permanentes (Citron, 2010). O estresse oxidativo sustentado pode levar à apoptose neuronal (Wu et al., 2010). Um grande número de estudos confirmou que a DA está intimamente relacionada ao estresse oxidativo (Lee et al., 2012; Yui et al., 2015). Verificou-se que o estresse oxidativo crônico pode aumentar a expressão da enzima Fosfolipase A2 grupo 3 (Pla2g3) em astrócitos e perturbar o equilíbrio de Aß, e, consequentemente, levar ao desenvolvimento de AD (Yui et al., 2015).
muitos estudos demonstraram que o KLF4 desempenha um papel importante na inibição do desenvolvimento do estresse oxidativo (Shi et al., 2014; Liu C. et al., 2015). Verificou-se que o KLF4 pode promover a apoptose celular induzida por H2O2, esta ação provavelmente será causada pelo aumento da expressão de bax e diminuição da expressão de bcl-2 (Li et al., 2010). A quercetina pode reduzir a expressão de KLF4 nas células Sh-SY5Y do neuroblastoma humano e aumentar a expressão da relação bcl-2/bax. Além disso, a quercetina pode moderar a taxa de apoptose da célula Sh-5ysy e reduzir a atividade da enzima caspase-3 (Xi et al., 2012). Um estudo recente investigou o efeito neuroprotetor da proteína ativada por mitogênio (MAP) quinase 5 (ERK5) contra o estresse oxidativo. A ativação do ERK5 pode reduzir parcialmente a morte dos neurônios hipocampais induzidos por H2O2 e aumentar a neuroproteção induzida por NGF e PC (Su et al., 2014). Nils et al. usou um mutante de MEK5 (MEK5D) para estudar a transcrição ativada por ERK5 e Respostas funcionais em células endoteliais humanas, e identificou que KLF4 era um novo alvo erk5 a jusante (Ohnesorge et al., 2010). Verificou-se que a superexpressão de KLF4 pode suprimir as respostas inflamatórias mediadas por TNF e reduzir a adesão de leucócitos e a apoptose basocelular. Estes resultados confirmam que KLF4 tem propriedades anti-inflamatórias e anti-apoptóticas (Ohnesorge et al., 2010). Experimentos subsequentes demonstraram que o desaparecimento da malformação cavernosa cerebral 1 (CCM1) nas células endoteliais ativa ERK5 via via via sinal MEKK3-MEK5 e aumenta a expressão de KLF4 (Cuttano et al., 2016). ERK5 desempenha um papel mediador no pré-condicionamento (PC) e fator de crescimento nervoso (NGF) regulou a expressão de KLF4 (Su et al., 2014). Além disso, a derrubada mediada por RNAi de KLF4 também pode reduzir a neuroproteção induzida por NGF ou PC. A superexpressão de KLF4 leva a uma maior relação bcl-2 / bax em células estressadas por H2O2 (Su et al., 2014). O KLF4 sobre-expresso acelera mudanças em bcl – 2 e em bax combinando com seu promotor correspondente (Li et al., 2010). A cascata ERK5 / KLF4 pode atuar como um pivô em várias vias que protegem os neurônios da morte induzida pelo estresse oxidativo (Su et al., 2014).
o estresse oxidativo tem sido considerado intimamente relacionado a muitas doenças degenerativas. KLF4 desempenha papéis significativos na manutenção da estabilidade genômica no estresse oxidativo. KLF4 e ERK5 atuam juntos para proteger os neurônios da apoptose induzida pelo estresse oxidativo. Portanto, KLF4 pode atuar como um alvo terapêutico para agir contra o estresse oxidativo quando ativado. Foi relatado que as estatinas podem ativar o ERK5, levando à expressão de KLF4 e seus genes dependentes (Ohnesorge et al., 2010), mas o mecanismo permanece obscuro, e os genes-alvo a montante e a jusante relacionados ao KLF4 são menos estudados no estresse oxidativo, há necessidade de um estudo mais aprofundado.
papel do KLF4 na regeneração Axônica
a perda precoce do axônio é uma característica comum das doenças neurodegenerativas. A perda sináptica e o comprometimento do transporte na DA podem causar deficiências cognitivas (Holtzman et al., 2011; Coleman, 2013). O grau de dano à memória declarativa está relacionado à densidade sináptica no hipocampo e no córtex. Os oligômeros Aß solúveis reduzem a absorção de glutamato e promovem a disfunção sináptica, interrompendo a plasticidade sináptica (Li et al., 2009). Portanto, é particularmente importante estudar como reparar os axônios no SNC. Nas células ganglionares da retina, os axônios têm uma forte capacidade de crescer e se regenerar durante o desenvolvimento inicial, mas no SNC de mamíferos adultos, os axônios perdem sua capacidade de regeneração e os neurônios podem se formar para morrer ou atrofiar (Goldberg e Barres, 2000; Goldberg et al., 2002).
KLF4 desempenha um papel importante na inibição do crescimento do axônio. Em RGCs embrionários, a superexpressão de KLF4 pode reduzir a porcentagem de alongamento de neurite, o comprimento de axônios e dendritos e a ramificação de neurite. Além disso, verificou-se que a superexpressão do KLF4 pode reduzir as taxas de crescimento do axônio pós-natal de longo prazo, mas não conseguiu reduzir as taxas de crescimento do axônio de curto prazo (Moore et al., 2009; Steketee et al., 2014). Estudos posteriores descobriram que os feixes de axônios dos ratos KLF4–cKO eram mais grossos do que os ratos controle (Fang et al., 2016). Além disso, a remoção da expressão de KLF4 durante o desenvolvimento pode aumentar o potencial reprodutivo dos RGCs adultos. Além disso, KLF4 sem o domínio de ligação de DNA c-terminal não teve efeito sobre o crescimento do axônio. Não houve impacto na sobrevivência das células depois que as células ganglionares da retina foram feridas se o KLF4 estivesse nocauteando (Moore et al., 2009).
KLF4 também pode afetar a regeneração axonal. Um estudo recente relatou que a diminuição da expressão de KLF4 em células ganglionares retinianas adultas promoveu a regeneração do axônio através da via JAK-STAT3 (Qin et al., 2013). KLF4 aumentou a fosforilação de STAT3 e regulou o crescimento do axônio via sinalização JAK-STAT (Qin e Zhang, 2012). Sob o tratamento de citocinas, os membros da família de proteínas STAT são fosforilados nos locais de tirosina e serina carboxi-terminais dentro da célula para formar um dímero estável. Esta modificação aumenta a transcrição de genes associados a células (Yuan et al., 2005). A interação entre KLF4 e STAT3 na fosforilação induzida por citocinas da tirosin705 inibe a expressão de STAT3 inibindo a ligação de STAT3 ao DNA (Qin et al., 2013). KLF4 knockdown obviamente melhora a regeneração do axônio em células ganglionares da retina após lesão do nervo óptico, e impede que o nervo de lesão após lesão cerebral leve. As ações são mediadas por uma diminuição no p-p53 e um aumento nos níveis de pSTAT3. KLF4 regula positivamente a apoptose neuronal através das vias p53 e JAK-STAT3, e KLF4 regula negativamente o reparo axonal através da via JAK-STAT3 (Cui et al., 2017).
portanto, hipotetizamos que, na da, a regeneração axonal pode ser realizada alterando a expressão de KLF4 ou alterando as vias de sinalização relacionadas intracelulares e controlando a progressão da da reduzindo os axônios ausentes ou reduzindo a disfunção axonal. No entanto, como usar o Fator de transcrição KLF4 em terapias potenciais ainda precisa de mais exploração.
o papel do KLF4 no acúmulo de ferro
o ferro é amplamente encontrado em sistemas biológicos, as metaloproteinases relacionadas ao ferro desempenham um papel fundamental no transporte de oxigênio, na transferência de elétrons e na catalisação de reações bioquímicas (Aisen et al., 2001). No entanto, qualquer excesso de ferro além da faixa fisiológica normal pode prejudicar a saúde humana (Adlard e Bush, 2006). Estudos descobriram que o teor de ferro no hipocampo está negativamente correlacionado com o desempenho de testes de memória (Ding et al., 2009). O aumento da carga de ferro no cérebro acelera a formação de placas Aß e emaranhados Tau hiperfosforilados, além de aumentar o estresse oxidativo (Peters et al., 2015). O ferro, que tem um alto grau de permeabilidade, promove o crescimento nervoso e as conexões célula a célula durante o desenvolvimento do cérebro (Dallman e Spirito, 1977).
um estudo recente demonstrou que o estresse fisiológico causou ativação da via de sinalização KLF4-HCP1 e aumento da captação de heme (Li H. et al., 2017). Heme é responsável por 95% do ferro funcional no corpo humano. É um dos principais componentes da heme oxigenase (Hooda et al., 2014; Kurucz et al., 2018). Aumentar a atividade da oxigenase – 1 pode retardar a oxidação do cérebro envelhecido (Verdile et al., 2015; Serini and Calviello, 2016; Kurucz et al., 2018). Isso tem um efeito de alívio no anúncio. O estresse fisiológico induz o aumento do nível de glicocorticóides, o glicocorticóide aumenta a expressão da proteína transportadora de heme 1 (HCP1) via KLF4 e, em seguida, o HCP1 promove a absorção de heme (Li H. et al., 2017). Os glicocorticóides e KLF4 regulam os genes anti-inflamatórios juntos, e as células com baixo teor de glicocorticóides não podem induzir totalmente a expressão de KLF4 (Sevilla et al., 2015). O aumento induzido por KLF4 na ingestão de heme leva ao acúmulo de ferro no cérebro. O ferro promove a liberação de ROS (Tronel et al., 2013). O elemento ferro aumenta o estresse oxidativo cerebral em ratos sob estresse psicológico (Yu et al ., 2011). Portanto, o HCP1 pode ser regulado por KLF4 e glicocorticóide juntos. O aumento do HCP1 aumenta a absorção de heme, o que leva diretamente ao acúmulo de ferro no cérebro, exacerba a oxidação, aumenta a apoptose ou disfunção e piora os danos cerebrais.
é geralmente aceito que a deficiência de memória e aprendizagem são os principais sintomas da da. Um grande número de dados clínicos mostrou que a carga da placa Aß e a resposta do acúmulo de ferro ao desenvolvimento da aprendizagem e disfunção cognitiva na da (van Bergen et al., 2018). Dados publicados recentemente sugeriram que, o ferro em altas doses aumenta a deposição de Aß e atenua o aprendizado e a memória em camundongos (Guo et al., 2013). Estudos clínicos mostraram que a microglia contendo ferro é encontrada no hipocampo de pacientes com DA sob ressonância magnética (Zeineh et al., 2015). Microglia adquire Ferro de transferência ou não transferência, extracelular e intracelular fontes (McCarthy et al., 2018). A expressão seletiva e sustentada de KLF4 pode ser induzida no núcleo e no citoplasma de astrócitos reativos hipocampais isquêmicos (Park et al., 2014). Estudos mostraram que o KLF4 atua como um repressor transcricional. Ele regula para baixo a expressão de ELK-3 e, em seguida, Elk-3 inibe a expressão de HO-1 (Tsoyi et al., 2015). A heme oxigenase – 1 (HO-1) é uma proteína de estresse que degrada o heme em bilirrubina, ferro livre e monóxido de carbono. A regulação positiva do HO-1 em astrócitos pode levar à deposição anormal de ferro e disfunção mitocondrial no cérebro, levando à diminuição da capacidade cognitiva (Schipper, 1999, 2004). Portanto, KLF4 pode estar envolvido no processo de acumulação de ferro em astrócitos, exacerbando a oxidação na DA e agravando danos cerebrais.
Conclusão
KLF4 é comumente conhecido por desempenhar um papel fundamental na regulação da proliferação celular, apoptose e diferenciação. Estudos anteriores se concentraram na regulação do KLF4 em vários processos neurofisiológicos importantes, incluindo neuroinflamação, neuroproteção e regeneração sináptica. Recentemente, descobriu-se que o KLF4 desempenha um papel importante na patogênese da da. Neste artigo, revisamos o papel do KLF4 na neuroproteção e neurogênese na da.
KLF4 não é apenas um regulador da regulação da proliferação e diferenciação celular, mas também um alvo potencial para regular as respostas imunes. KLF4 pode regular fatores inflamatórios negativos e promover a resposta inflamatória, e ter um grande efeito sobre a expressão de microglia nuclear de astrócitos. Além disso, KLF4 e ERK5 podem atuar juntos para exercer ações neuroprotetoras. Além disso, a regeneração do axônio pode ser realizada alterando o conteúdo de fatores de transcrição específicos, inibidores intracelulares ou alterando as vias de sinalização intracelular. Nocautear KLF4 pode melhorar a regeneração do axônio e acelerar a taxa de crescimento do axônio. A redução da expressão de KLF4 promove a regeneração do axônio através da via JAK-STAT3, e KLF4 promove a via JAK-STAT3 para promover a regeneração do axônio. Portanto, KLF4 pode estar envolvido no processo de anti-inflamatório, Anti-apoptose, regeneração de axônios e acúmulo de ferro no SNC, que desempenha um papel fundamental na geração de Da. Esses achados sugerem que o KLF4 representa um potencial alvo terapêutico para da. No entanto, os mecanismos celulares e moleculares profundos dos efeitos do KLF4 na da permanecem obscuros e mais investigações são necessárias.
contribuições do autor
ZQC, XHZ e YJ escreveram o manuscrito. SHG e JYL modificaram a estrutura do manuscrito. BJL e RJC forneceram as revisões críticas. Todos os autores aprovaram a versão final do manuscrito para submissão.
Financiamento
Este trabalho foi apoiado por doações de Ciências Naturais da Fundação da China (NSFC) (81871070, 31571126, 31471120) e Jilin a Ciência e a Tecnologia Agência de financiamento (Concessão Nºs 20180519003JH, 20180414051GH, 20170414034GH e 20180414050GH).
Declaração de conflito de interesses
os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Cacabelos, R. (2018). Houve melhorias na descoberta de medicamentos para a doença de Alzheimer nos últimos 5 anos. Expo. Opin. Droga Discov. 13, 523–538. doi: 10.1080/17460441.2018.1457645
Resumo do PubMed / texto completo do CrossRef / Google Scholar
Liu, Y., Shi, J., e Chen, X. (2015). Identificação de novos alvos para rinite alérgica sazonal durante e fora da estação do pólen por análise de microarray. Otorrinolaringologia Acta. 135, 1330–1336. doi: 10.3109 / 00016489.2015.1067906
PubMed Abstract / CrossRef texto completo / Google Scholar
Serini, S., e Calviello, G. (2016). Redução do estresse oxidativo / nitrosativo no cérebro e seu envolvimento no efeito neuroprotetor do PUFA n-3 na doença de Alzheimer. Moeda. Alzheimer Res. 13, 123-134. doi: 10.2174/1567205012666150921101147
PubMed Abstract / CrossRef texto completo / Google Scholar